牛角瓜组培快繁过程中生理生化指标的变化
2016-06-04唐军荣郑元刘惠民马焕成陈诗刘忠美西南林业大学西南地区生物多样性保育国家林业局重点实验室云南昆明650224西南林业大学云南省高校林木遗传改良与繁育重点实验室云南昆明650224
唐军荣郑 元刘惠民马焕成陈 诗刘忠美(.西南林业大学西南地区生物多样性保育国家林业局重点实验室,云南昆明650224;2.西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南昆明650224)
牛角瓜组培快繁过程中生理生化指标的变化
唐军荣1,2郑 元1刘惠民1马焕成1陈 诗1刘忠美1
(1.西南林业大学西南地区生物多样性保育国家林业局重点实验室,云南昆明650224;2.西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南昆明650224)
摘要:以牛角瓜组培苗为材料,对牛角瓜组培快繁过程中不同阶段的几种生理生化指标进行了测定,为其组培器官发生的调控提供依据。结果表明:牛角瓜增殖和生根过程中的形态变化与SOD、POD、CAT活性、可溶性糖和可溶性蛋白含量存在一定的相关性;在增殖过程中SOD活性变化先升后降,POD活性变化规律总体呈现下降趋势,CAT的活性变化呈现上升趋势,可溶性蛋白含量变化先降后升,可溶性糖含量呈上升趋势。在生根过程中SOD、POD和CAT酶的活性变化趋势基本一致,总体呈现“上升—下降—上升”,可溶性蛋白含量总体变化趋势为“升高—下降—缓慢升高”,可溶性糖含量总体变化趋势为先缓慢升高,后又缓慢下降。
关键词:牛角瓜;抗氧化酶活性;可溶性蛋白;可溶性糖;组培快繁
牛角瓜(Calotropis gigantea)属萝藦科(Asclepiadaceae)牛角瓜属(Calotropis)直立灌木,产于云南、四川、广西和广东等省区,生长于低海拔向阳山坡、旷野地及海边[1]。牛角瓜的光合特性研究显示,牛角瓜对高温、高光照具有较强的耐性[2],其种子采用水浸处理能有效提高种子发芽率[3]。牛角瓜的果实纤维属天然纤维,是一种新型生态环保的纺织材料,具有广阔的开发前景[4]。
植物生长是通过细胞分裂和伸长完成的,不同的生长发育时期,其生理生化方面的性质也会发生相应的变化,对组培苗形态发生过程中生理生化的变化研究,有助于观察分析组培过程中组织的形成、分化、发育。目前,对该项研究已有较多报道,如周洁[5]通过研究沙棘(Hippophae rhamnoides)组培苗生根的生理生化机制,为提高沙棘组培苗生根率提供了重要依据;张有铎等[6]对菜用大黄(Rheum rhaponticum)组培苗不同生根培养阶段的形态指标和生理指标进行了观察研究,探讨了生理生化指标与组培苗移栽成活率之间的关系;郎贤波[7]对树莓(Rubus corchorifolius)茎段增殖和发根过程中主要生理指标变化与形态发生的相关性进行了探讨,对树莓的组培苗生产具有积极指导意义。对于牛角瓜的组培研究,李克烈等[8]以牛角瓜的叶片为外植体,开展了牛角瓜的组织培养研究,通过叶片诱导出愈伤组织,最后分化出不定芽,试管苗生根培养后,其移栽成活率可达85%以上,而关于牛角瓜组培过程中的生理生化指标研究则未见相关报道。试验以前期建立的牛角瓜离体快繁体系为基础,分析牛角瓜组培过程中不同时期生理生化指标的变化,探讨牛角瓜组培过程中这些生理生化指标与增殖、生根的关系,为牛角瓜组培苗的离体再生提供理论依据,并为进一步遗传转化和倍性育种奠定坚实的基础,同时也对其他木本植物形态建成条件的探索,调控离体器官形态发生等具有实际意义。
1 材料与方法
1.1试验材料
在牛角瓜组培过程中的增殖和生根阶段,分别取组培苗作为试验材料。
1.2方法
1.2.1样品采集
1)增殖阶段:增殖培养基为MS+1.0 mg/ L 6-BA+0.1 mg/ L NAA+30 g/ L白砂糖+5.1 g/ L琼脂粉,pH为5.8。每瓶接种4枚茎段,在相同条件(光照、温度)下进行培养,分别在接种后第20 d(不定芽形成)、30 d(不定芽伸长生长)和40 d(不定芽木质化)时进行取样,称取完后备用。试验重复3次,取样3次。
2)生根阶段:生根培养基为1/2MS+0.2 mg/ L IBA+15 g/ L白砂糖+5.1 g/ L琼脂粉+0.1 g/ L活性炭,pH值为5.8,培养条件同上,每瓶接种4株。生根培养分别于接种时第14 d(不定根形成)、24 d(不定根伸长生长)和30 d(不定根木质化)时进行取样,称取完后备用。试验重复3次,取样3次。
1.2.2测定方法
具体方法[9-10]:超氧化物岐化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)的活性采用分光光度计法测定,可溶性蛋白含量采用紫外吸收法测定,可溶性糖含量采用蒽酮比色法测定。
1.2.3数据处理
试验数据采用Excel 2003和SPSS 17.0进行统计分析。
2 结果与分析
2.1增殖过程中生理生化变化
2.1.1增殖过程中SOD、POD、CAT的酶活性变化
牛角瓜在增殖时,根据形态变化大致划分为3个部分,20 d以前以不定芽形成为主,在21~30 d时以不定芽的伸长生长为主;在31~40 d时以营养物质积累为主。外部形态及内部的酶活性都发生着相应的变化,见图1。
由图1可知,SOD呈倒“V”字型变化,不定芽的伸长生长阶段时SOD活性最高,这说明牛角瓜在形成不定芽时,细胞内产生的活性氧少,而对超氧阴离子自由基等活性氧具有清除能力的SOD活性也低。当处于伸长生长阶段时超氧阴离子自由基等活性氧含量增加,诱导SOD酶的活性相应达到最大,因而更好的诠释了SOD与不定芽的形成和伸长生长关系紧密。POD在整个增殖阶段一直呈下降趋势,在启动阶段,芽原基已经大量形成,不定芽开始大量产生,此时POD活性最高,POD能使组织中所含的某些碳水化合物转化成木质素,增加木质化程度。因此,随着芽体的伸长生长,增殖过程的不断进行,POD活性开始出现下降,表明组培苗在前期活动较为剧烈,不断进行新芽的分化。而CAT含量随着培养时间的增长则表现出缓慢上升的趋势,表明随着CAT活性的增加,其对H2O2的清除能力也在增加,能够减少细胞内的活性氧,使组培苗免受伤害。
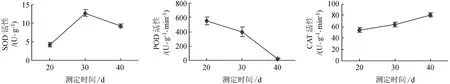
图1 牛角瓜增殖阶段的酶活性变化Fig.1 The changes of enzyme activity in the proliferation stage
2.1.2增殖过程中可溶性蛋白含量变化
可溶性蛋白含量变化见图2。在不定芽形成期,蛋白质含量最高,说明此时增殖材料代谢活跃,为不定芽的分化提供充足的蛋白质;随着不定芽的生长,此时,蛋白质大量消耗,含量开始快速下降,到最后趋于平稳,表明体内共需达了平衡。蛋白质是细胞的重要组成成分,在细胞的生命活动中起重要作用。在不定芽形成期,新的蛋白质还没有合成,而细胞启动所需的物质是由细胞内原有可溶性蛋白质转变而来;随着不定芽的生长,对蛋白质的消耗量增加,从而使得牛角瓜可溶性蛋白质含量呈下降趋势;到后期,牛角瓜的不定芽生长缓慢,木质化程度增加,细胞合成的大量蛋白质超过了不定芽的需要量,即可溶性蛋白含量呈现出上升趋势。
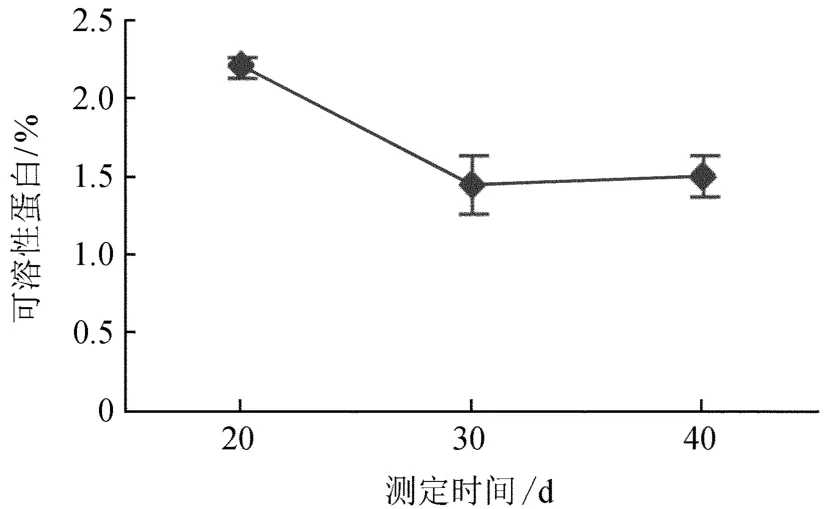
图2 增殖过程中可溶性蛋白含量变化Fig.2 The changes of soluble protein content in the process of proliferation
2.1.3增殖过程中可溶性糖含量变化
可溶性糖是光合作用的初级产物,也是植物体内多糖、蛋白质等大分子化合物合成的基础,增殖过程中可溶性糖含量变化见图3。由图3可知,在牛角瓜增殖过程中,牛角瓜组培苗可溶性糖含量变化先趋于平缓,后期表现出快速上升。糖类物质在增殖过程中的变化,将直接反映牛角瓜在形态结构上的变化情况,在不定芽形成及伸长生长阶段,可溶性糖的消耗和产生基本维持平衡,后期含量逐渐升高,可能是随着组培苗的生长发育,可溶性糖得到大量的积累。
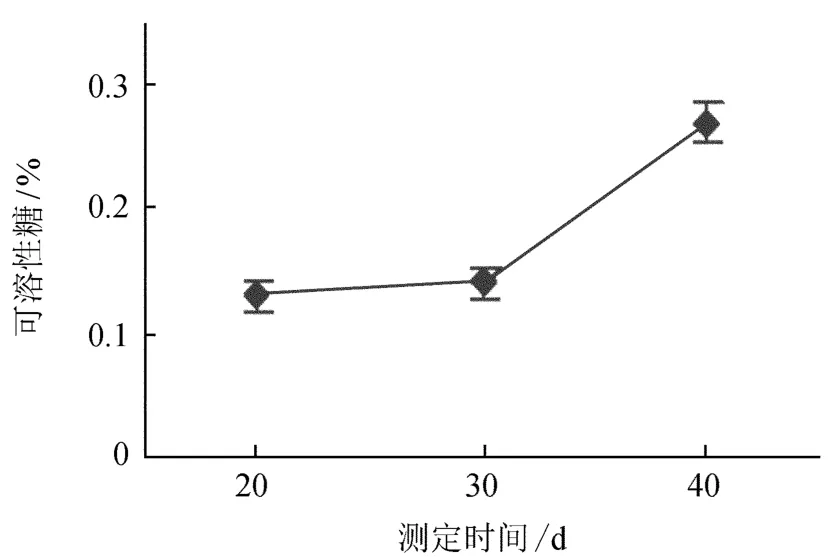
图3 增殖过程中可溶性糖含量变化Fig.3 The changes of soluble sugar content in the process of proliferation
2.2生根过程中生理生化变化
2.2.1生根过程中SOD、POD、CAT的酶活性变化
将增殖结束后的牛角瓜组培苗进行生根培养,在生根过程中形态变化见表1,酶活性变化见图4。酶活性的总体变化趋势为先升后降,最后再上升。当无根组培苗接种到生根培养基后,原有的生长状态被打破,导致SOD活性升高;随着不定根的形成和伸长生长,新的平衡状态得以形成,酶活性下降;但又由于后期根系伸长生长后,组培苗在营养和空间方面产生了竞争,使得酶活性又逐渐升高。POD的变化趋势是先上升,后缓慢下降,之后又开始升高,因为在根的起源和生长过程中POD主要通过氧化IAA而起作用,根未形成时POD的活性处在较低水平,降解IAA能力弱,使内源IAA得到积累,对诱导根原基有利,随着根系长出,POD活性迅速增加,降解IAA作用增强,IAA水平下降,有利于根原基的生长和根的发育。CAT活性的变化趋势为先上升,后下降,最后缓慢上升。当根开始伸长生后,植株能够通过根系大量从培养基中吸收营收,不利状态得以改变,使得POD和CAT出现降低;后期生长速度加快,在一定条件下,组培苗之间产生营养和空间竞争,CAT、POD活性又出现了升高。
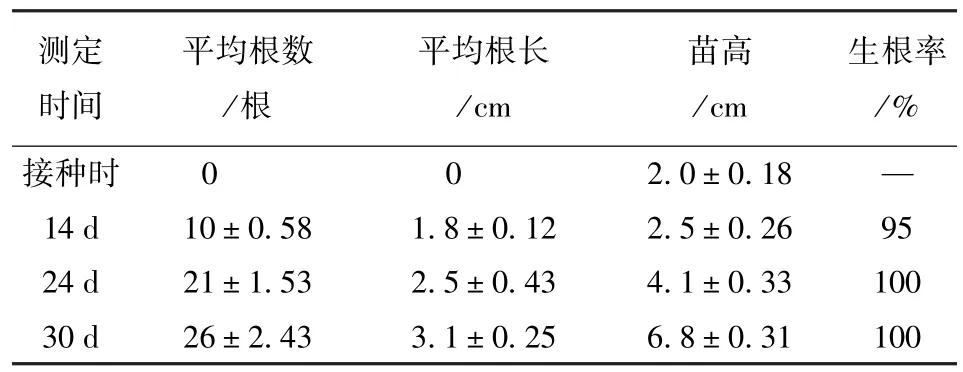
表1 牛角瓜的生根过程中的形态变化Table 1 The changes of Calotropis gigantea morphology in the process of rooting
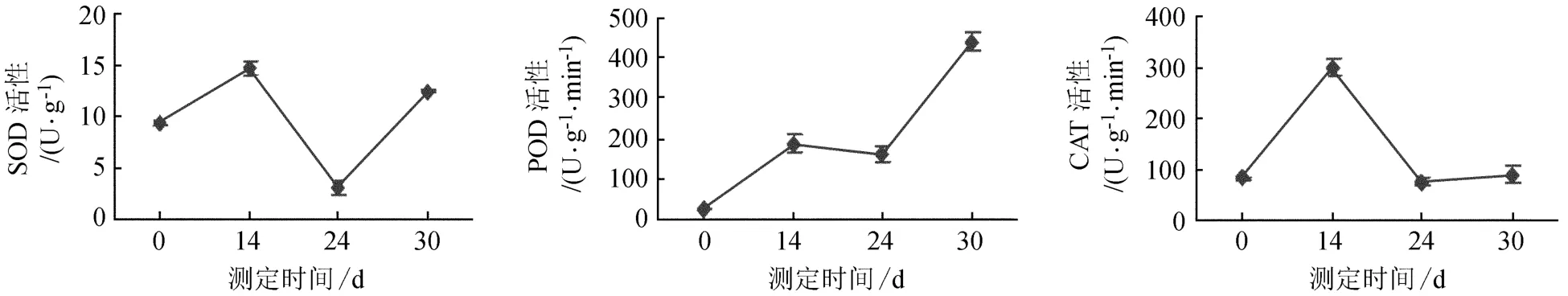
图4 生根过程中的酶活性变化Fig.4 The changes of enzyme activity in the process of rooting
2.2.2生根过程中可溶性蛋白含量变化
可溶性蛋白虽只占蛋白质的一部分,但是生物体能吸收利用的主要是可溶性蛋白,它在生命体活动中发挥着运输协调、免疫保护、产生和传导神经活动、控制生长分化等功能。由图5可知,牛角瓜组培苗可溶性蛋白含量变化先升高,然后缓慢下降,之后又呈现缓慢上升趋势。后期酶活性的升高,其抵抗力增加,有利于蛋白的合成,则可溶性蛋白含量升高。说明在生根的不同时期,牛角瓜组培苗可溶性蛋白的表达量不一致,而这些可溶性蛋白可能对根的形成有一定的促进作用。
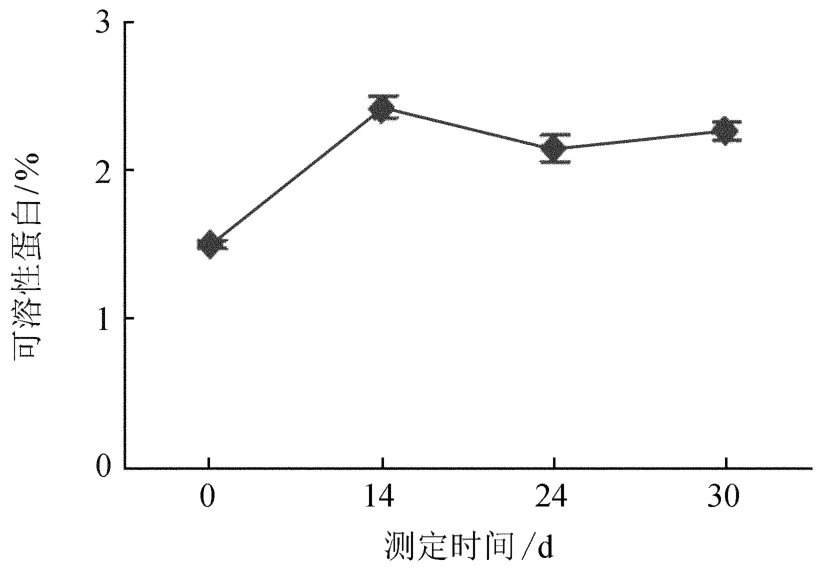
图5 生根过程中可溶性蛋白质含量的变化Fig.5 The changes of soluble protein content in the process of rooting
2.2.3生根过程中可溶性糖含量变化
由图6可知,牛角瓜组培苗可溶性糖含量变化先缓慢上升,后缓慢下降,可溶性糖含量变化幅度小。由于组培苗刚接种在生根培养基上时,其切口处受到生长素的刺激,在切口处慢慢形成根原基,同时牛角瓜的可溶性糖在慢慢的积累,用于前期根的诱导需求;根系长出后,根的伸长生长和苗高的生长需要大量能量,导致自身贮备的可溶性糖开始降低。另一方面,生根苗已经可以通过根系从培养基中快速获取营养,并满足自身部分需求,一定程度上使得下降趋于平缓。
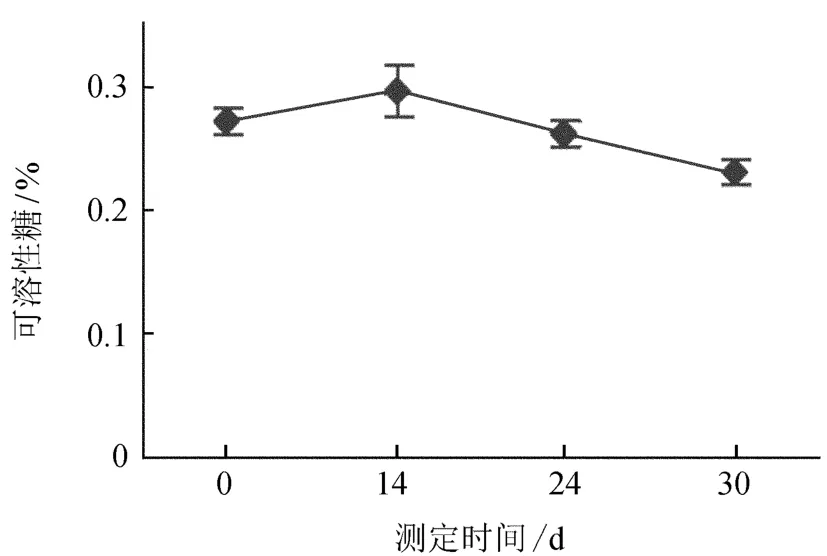
图6 生根过程中可溶性糖含量的变化Fig.6 The changes of soluble sugar content in the process of rooting
3 结论与讨论
在植物组培过程中,组培苗的外部形态变化受培养基种类、继代周期、培养条件等影响,在外部形态的变化过程中,其内部相关的生理生化指标也会呈现出规律性变化。组培苗在培养过程中,其培养基中的激素对组培苗影响最大,特别是分裂素与生长素的比值决定了组培苗的生长发育方向。由于激素的添加,导致了组培苗原有的激素水平被破坏,使组培苗处于一定的逆境中,为了适应新的环境,其酶活性等指标也不断发生着变化。超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)在植物体内普遍存在,并相互协调,清除植物体内过剩的自由基,使自由基维持在一个低水平上,有效防御活性氧对生物体的毒害作用,从而防止自由基对植物细胞造成伤害[11-12]。不定芽的形态发生和早期芽原基的形成与过氧化物酶、可溶性糖、可溶性蛋白的含量有一定的相关性[13]。此外,可溶性糖作为一种能源消耗物质,在植物不定芽发生时,为新陈代谢活跃的胚细胞提供充足的能源,反映了体内作为有效营养物的碳水化合物和能量水平[14]。
牛角瓜的生理生化指标在组培过程中的变化情况为:在增殖阶段,SOD呈先升后降趋势,POD呈下降趋势,CAT呈上升趋势,可溶性蛋白含量呈先降后缓慢上升趋势,可溶性糖的含量则一直呈上升趋势;在生根过程中,SOD、POD和CAT酶活性的总体变化规律相对较一致,先升后降,最后又上升,可溶性蛋白含量则呈“上升—下降—缓慢上升”的趋势,可溶性糖含量先缓慢上升,后又缓慢下降,变化幅度小。牛角瓜增殖过程中CAT活性的变化趋势与鹅掌楸(Liriodendron chinese)组织培养中增殖时的CAT变化趋势一致,但可溶性糖含量的变化则不相同,这可能与植物种类或者添加的激素种类有关[15]。沙棘组培苗生根过程中,POD呈现先上升后下降,再上升的变化趋势,但其活性较低,表明植物生长调节物质可以通过调节体内氧化酶活性来促进不定根的形成[5],这也与本研究的结果相似。此外,牛角瓜组培苗生根过程中的可溶性糖含量变化与王瑞等[16]对油茶(Camellia oleifera)的组培苗生根研究结果一致;另外,在虎耳兰的植株再生时,叶片愈伤组织的诱导,以及后期不定芽的产生及生长阶段,其体内的可溶性蛋白也发生着相应的动态变化[17]。
牛角瓜在组培过程中,由于激素的刺激,导致其形态发生了变化,增殖阶段表现为不定芽的形成、伸长生长和木质化;而在生根阶段,则表现为不定根的形成、伸长生长及木质化。这些形态变化之前,其生理生化指标已发生,外部形态和内部生理指标间存在着较大的关联性,因此,其研究结果对于牛角瓜优良单株离体再生体系的建立及优化,都具有一定的理论指导性。为了更好地提示组培过程中各个环节的动态变化,今后可以借助切片技术从细胞水平更加直观地观察其细胞结构变化与外部形态变化的相关性。
[参考文献]
[1]中国科学院.中国植物志(第63卷)[M].北京:科学出版社,1977:384-386.
[2]高柱,王小玲,余发新,等.干热河谷牛角瓜光合特性[J].东北林业大学学报,2014,42(3):19-23.
[3]郑元,罗明灿,高柱,等.牛角瓜的研究动态[J].西南林业大学学报,2015,35(5):97-103
[4]黄惠民.一种纺纱用牛角瓜纤维棉条及其加工方法和设备.中国,CN101565860[P].2009-10-28.
[5]周洁.沙棘组培快繁体系的建立及组培苗生根的生理生化机制研究[D].沈阳:沈阳农业大学,2005.
[6]张有铎,蔡祖国,赵一鹏.菜用大黄组培苗生根特性研究[J].湖北农业科学,2009,48(11):2759-2761.
[7]郎贤波.丰满红树莓组培快繁及其生理生化特性的研究[D].延边:延边大学,2007.
[8]李克烈,罗联忠,陈伟,等.牛角瓜的组织培养[J].广西农业生物科学,2007,26(3):247-248.
[9]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:267-268.
[10]洛文静,李奕松.植物生理学实验教程[M].北京:中国林业出版社,2000:267-268.
[11]孙国荣,彭永臻,阎秀峰,等.干旱胁迫对白桦实生苗保护酶活性及脂质过氧化作用的影响[J].林业科学,2003,39(1):165-167.
[12]陈少瑜,郎南军,贾利强,等.干旱胁迫对坡柳等抗旱树种幼苗膜脂过氧化及保护酶活性的影响[J].植物研究,2006,26(1):88-92.
[13]蒋波.芥菜离休培养芽再生过程中的生理生化变化研究[D].重庆:西南大学,2010.
[14]陈陆琴.五种木本植物的组织培养及其生理生化研究[D].大连:辽宁师范大学,2002.
[15]路承香.鹅掌楸组织培养及其再生过程中生理生化特性研究[D].兰州:甘肃农业大学,2008.
[16]王瑞,陈永忠,王湘南,等.油茶组培苗生根过程中生理生化指标的变化[J].经济林研究,2015,33(2):68-72.
[17]杨银萍.虎耳兰离体再生体系的建立及其生理生化研究[D].上海:上海交通大学,2004.
(责任编辑韩明跃)
第1作者:唐军荣(1982—),男,讲师。研究方向:植物快繁和育种。Email:306740911@qq.com。
Changes of Physiological and Biochemical Index of Calotropis gigantea in the Process of Tissue Culture and Rapid Propagation
Tang Junrong1,2,Zheng Yuan1,Liu Huimin1,Ma Huancheng1,Chen Shi1,Liu Zhongmei1
(1.Key Laboratory of State Forestry Administration for Biodiversity Conservation in Southwest China,Southwest Forestry University,Kunming Yunnan 650224,China;2.Key Laboratory for Forest Genetic and Tree Improvement&Propagation in Universities of Yunnan Province,Southwest Forestry University,Kunming Yunnan 650224,China)
Abstract:Taking tissue culture seedling of Calotropis gigantea as the material,some physiological-biochemical index were studied during different growth periods in the process of tissue culture and rapid propagation,and it provided the basis for the regulation of the morphology of plant′s organs.The results were as follows:There were some relationships between the morphosis and the activity of SOD,POD,CAT and the content of soluble sugar and soluble protein in the stage of proliferation and rooting.During the proliferation stage,SOD activity was first increased and then decreased,and POD activity showed a declining tendency as a whole,and CAT activity showed an increasing tendency,and the content of soluble protein was firstly decreased and then increased,and the content of soluble sugar was increased.During the rooting stage,activity of SOD,POD and CAT showed a same tendency of “rise-fall-rise”,and the content of soluble protein was firstly increased,then decreased and finally increased slowly,and the content of soluble sugar was firstly increased slowly and then decreased slowly.
Key words:Calotropis gigantea;anti-oxidant enzyme activity;soluble protein;soluble sugar;tissue culture and rapid propagation
通信作者:刘惠民(1957—),男,教授。研究方向:经济林培育。Email:hmliu@swfc.edu.cn。
基金项目:国家林业局林业公益性行业项目(201304810)资助;西南林业大学云南省省级重点学科(林学)资助;西南地区生物多样性保育国家林业局重点实验室开放基金资助。
收稿日期:2015-10-14
doi:10.11929/ j.issn.2095-1914.2016.03.009
中图分类号:S723.1
文献标志码:A
文章编号:2095-1914(2016)03-0049-05
