热激对多歧苏铁叶绿素含量及荧光特性的影响
2016-06-04郑艳玲马焕成西南林业大学国家林业局西南地区生物多样性保育重点实验室云南昆明650224
郑艳玲 马焕成(西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南昆明650224)
热激对多歧苏铁叶绿素含量及荧光特性的影响
郑艳玲 马焕成
(西南林业大学国家林业局西南地区生物多样性保育重点实验室,云南昆明650224)
摘要:为研究多歧苏铁对高温胁迫的响应,探索多歧苏铁高温下的生态适应策略,以多歧苏铁离体叶片为材料,研究高温(25、35、45、55℃)对多歧苏铁叶绿素的含量及荧光参数的影响。结果表明:随着温度升高,叶绿素a,叶绿素b和叶绿素(a+b)的含量都呈现出先降后升的趋势,45℃热激后降至最低,55℃热激后又上升;但叶绿素a/ b在各处理温度间无显著变化。在25~45℃下,除35℃热激后的Y(Ⅱ)显著升高外,Fo、Fm、Fv/ Fm、Y(NPQ)、Y(NO)、qP、NPQ、ETRmax、α、Ik均无显著差异;55℃热激后,Ik较25~45℃热激无显著变化,但Fo和Y(NO)显著提高,其余荧光参数Fm、Fv/ Fm、qP、NPQ、ETRmax、α均显著降低。在激发能分配方面,随着温度升高,PSⅡ反应中心吸收光能通过天线热耗散的比例(D)呈增加趋势;用于光化学反应的比例(P)在35℃时最高,55℃时最低;过剩激发能比例(E)在25~45℃时无显著差异,但55℃时显著降低。综上所述,多歧苏铁对高温具有一定的耐受性,在25~45℃下,光合活性并未受到影响,但55℃热激后,PSⅡ反应中心光化学活性降低,光合电子传递过程受抑,出现光抑制。
关键词:多歧苏铁;热激;叶绿素含量;荧光特性;能量耗散
苏铁类植物大约起源于距今约有3亿多年的石炭纪后期,到中生代的侏罗纪达到鼎盛,进入早白垩纪以后开始走向衰退。它们对于研究古生物学、古气候学、古地理学及种子植物的起源与演化等均具有重要意义。我国仅有苏铁属(Cycas)1属,且云南分布的苏铁属植物占全国的50%左右[1]。其中,具三回羽状二叉分歧复叶的多歧苏铁(Cycas multipinnata)属于叉叶类苏铁,是苏铁属植物中最近化的典型[2]。多歧苏铁在中国分布于红河州的屏边、河口和个旧等县、市,具有极高的研究和观赏价值。但由于人为采挖和栖息地破坏等因素,现存种群正面临灭绝的威胁,已被列为国家一级保护植物。目前,对多歧苏铁的研究集中在解剖学及分类学方面,而多歧苏铁对生态因子的适应性研究较少。经观察,多歧苏铁在河口较高的温度(极端高温超过40℃)下长势良好,能开花结实,且1年中能多次萌生新叶,但多歧苏铁对高温的适应性尚不清楚。
光合作用与植物的生长发育密切相关。叶绿体是植物光合作用的场所,是对胁迫较为敏感的细胞器[3-4]。叶绿素同光合作用关系密切,影响植物对光能的吸收、传递以及在PSⅠ、PSⅡ之间的分配和转换,其含量在一定程度上能反映植物同化物质的能力。叶绿素荧光作为光合作用研究的理想探针,在测定叶片光合作用过程中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用。通过植物叶绿素荧光可以快速、灵敏、可靠、无损伤的了解植物光合作用生理状况及其与环境的关系[5-6]。本研究以多歧苏铁的叶片为试材,分析高温对多歧苏铁叶绿素含量和叶绿素荧光特性的影响,从而为多歧苏铁的高温适应性及其引种驯化提供参考。
1 材料与方法
1.1材料处理
在河口从多年生多歧苏铁植株上剪下叶片,插在水中,当天带回昆明。第2天进行热激处理。热激处理时,将叶柄插在盛水的广口瓶中,分别在25、35、45、55℃培养箱暗中处理2 h。
1.2测定方法
1.2.1叶绿素含量测定
热激处理后,参照王学奎[7]方法,略作修改。称取待测样品0.2 g,剪碎,装入具塞刻度试管中,加入95%乙醇10 mL使叶片完全浸入液体中,加盖,室温下置于暗处,当叶片完全变白时即可在665、649、470 nm比色。每个处理设3次重复。
1.2.2叶绿素荧光测定
热激处理后,采用PAM-2500调制式叶绿素荧光仪(WALZ,Germany)测定暗适应下叶片的初始荧光(Fo)、最大荧光(Fm)、PSⅡ最大光化学效率(Fv/ Fm);PSⅡ实际光化学效率Y(Ⅱ)、PSⅡ调节性能量耗散量子产额Y(NPQ),PSⅡ非调节性能量耗散量子产额Y(NO),光化学淬灭系数(qP)和非光化学淬灭系数(NPQ);PSⅡ最大电子传递速率(ETRmax)、表观光合效率(α)和半饱和光强(Ik),以上参数均由仪器自动给出。PSⅡ吸收光能分配百分率根据Demmig-Adams[8]公式计算:天线色素耗散的能量D = 1- Fv′/ Fm′;光化学反应的能量P= Fv′/ Fm′×qP;过剩光能E= Fv′/ Fm′×(1-qP)。每个处理设4次重复。
1.3数据处理与分析
采用Excel 2007和SPSS 15.0进行数据分析、处理和绘图,用LSD进行差异显著性检验及多重比较,所有数据采用均值±标准差表示。
2 结果与分析
2.1热激对多歧苏铁叶绿素含量的影响
叶绿素含量与植物的光合能力密切相关。随着温度升高,叶绿素a,叶绿素b和叶绿素a+b的含量都呈先降后升的趋势(表1)。以叶绿素a+b的含量变化为例,多歧苏铁在45℃热激后,叶绿素a+b含量(1.541±0.041)mg/ g较25℃和35℃热激处理显著降低,分别降低24.5%和18.1%。但55℃热激后叶绿素a+b含量(2.330±0.207)mg/ g又开始升高,显著高于35℃和45℃热激处理,但与25℃热激处理无显著差异。各温度处理间,叶绿素a/ b无显著差异(均值2.567±0.120)。
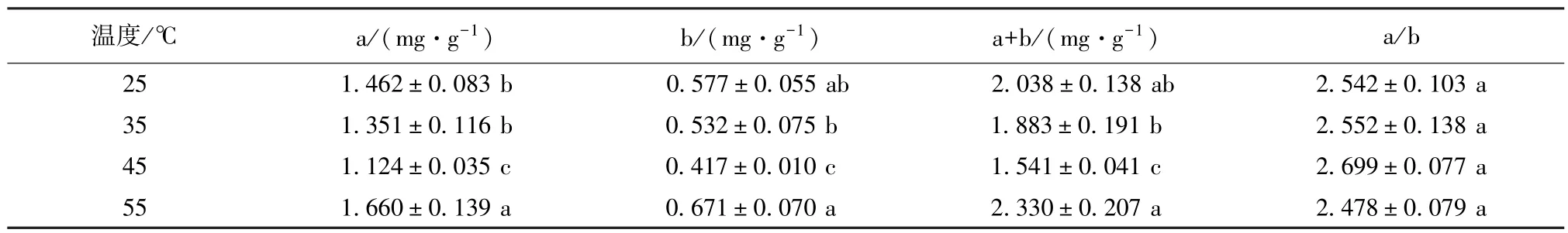
表1 热激对多歧苏铁叶绿素含量的影响Table 1 Effects of heat shock on chlorophyll content of Cycas multipinnata
2.2热激对多歧苏铁Fo、Fm和Fv/ Fm的影响
Fo是PSⅡ反应中心完全开放时的荧光产量,其值上升可能是PSⅡ反应中心发生可逆失活或不可逆破坏造成的[9]。Fm为PSⅡ反应中心完全关闭时的荧光产量,可反映通过PSⅡ的电子传递情况。一些研究表明,Fm下降是天线降解造成的,但也有学者认为Fm下降与供体侧放氧复合体在高温下失活有关[10-11]。Fv/ Fm是PSⅡ最大光化学效率,是光抑制的敏感指标[12]。25、35、45℃热激处理间,Fo、Fm和Fv/ Fm均无显著差异(图1)。与25~45℃热激处理相比,55℃热激处理后的Fo显著升高,分别比25、35、45℃处理升高97.0%、96.5%和80.4%;Fm显著降低,分别比25、35、45℃处理降低41.0%、32.7%和33.0%;Fv/ Fm也显著降低,分别比25、35、45℃处理降低65.2%、63.8%和62.5%。
2.3热激对多歧苏铁Y(Ⅱ)、Y(NPQ)、Y(NO)、qP和NPQ的影响
Y(Ⅱ)为PSⅡ实际光化学效率,是PSⅡ反应中心部分关闭情况下实际PSⅡ光能捕获效率,其值大小反映PSⅡ反应中心的开放程度[13]。35℃热激处理后的Y(Ⅱ)显著高于25℃和45℃热激处理,分别高出13.0%和21.4%(表2),55℃热激处理后的Y(Ⅱ)显著降低。Y(NPQ)为PSⅡ调节性能量耗散的量子产额,是光保护的重要指标;Y(NO)为PSⅡ非调节性能量耗散的量子产额,是光损伤的重要指标。25~45℃热激处理间Y(NPQ)和Y(NO)均无显著差异,但55℃处理后的Y(NPQ)较25~45℃处理后的显著降低而Y(NO)显著升高。qP 是PSⅡ天线色素吸收的光能用于光化学电子传递的份额,较低的qP反映PSⅡ中开放的反应中心比例和参与CO2固定的电子减少[13-14]。25、35、45℃热激处理间的qP无显著差异,但55℃热激处理的qP显著降低,分别比25、35、45℃下降35.5%、43.9%和37.2%。NPQ反映的是天线色素吸收的光能不能用于电子传递而以热的形式耗散掉的光能部分,热耗散是植物PSⅡ光保护的重要机制。25、35、45℃热激处理间的NPQ无显著差异,但55℃热激处理后NPQ显著降低,分别比25、35、45℃下降64.8%、54.8%和61.0%。可见,55℃高温胁迫下,多歧苏铁已不能将天线色素吸收的多余能量以热能形式耗散,以减轻光合机构的破坏。
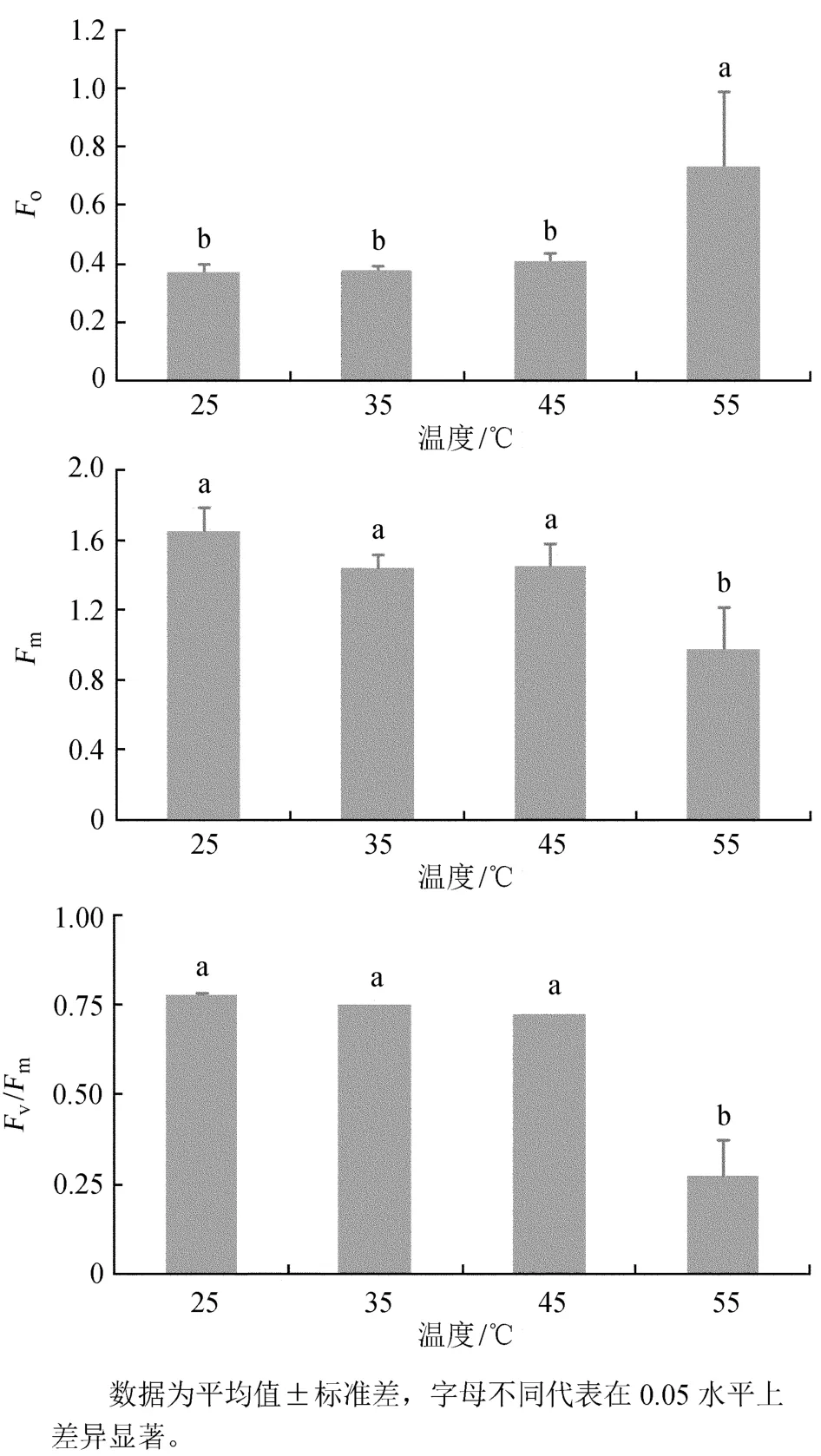
图1 热激对多歧苏铁Fo、Fv和Fv/ Fm的影响Fig.1 Effects of heat shock on Fo,Fvand Fv/ Fmof Cycas multipinnata
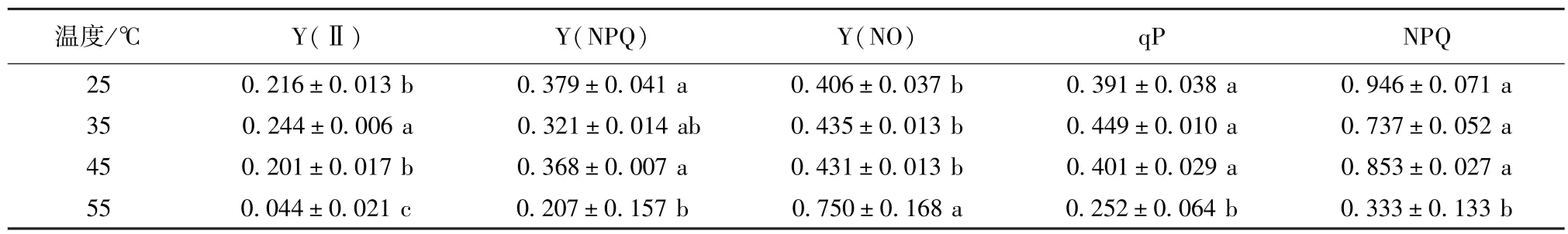
表2 热激对多歧苏铁叶绿素荧光特性的影响Table 2 Effects of heat shock on chlorophyll fluorescence characteristics of Cycas multipinnata
2.4热激对多歧苏铁能量分配的影响
植物叶片吸收的光能可分为3部分:一是在天线色素上热耗散的部分(D),二是用于光化学反应的部分(P),三是反应中心的过剩激发能部分(E)。热激对多歧苏铁能量分配的影响结果见图2。
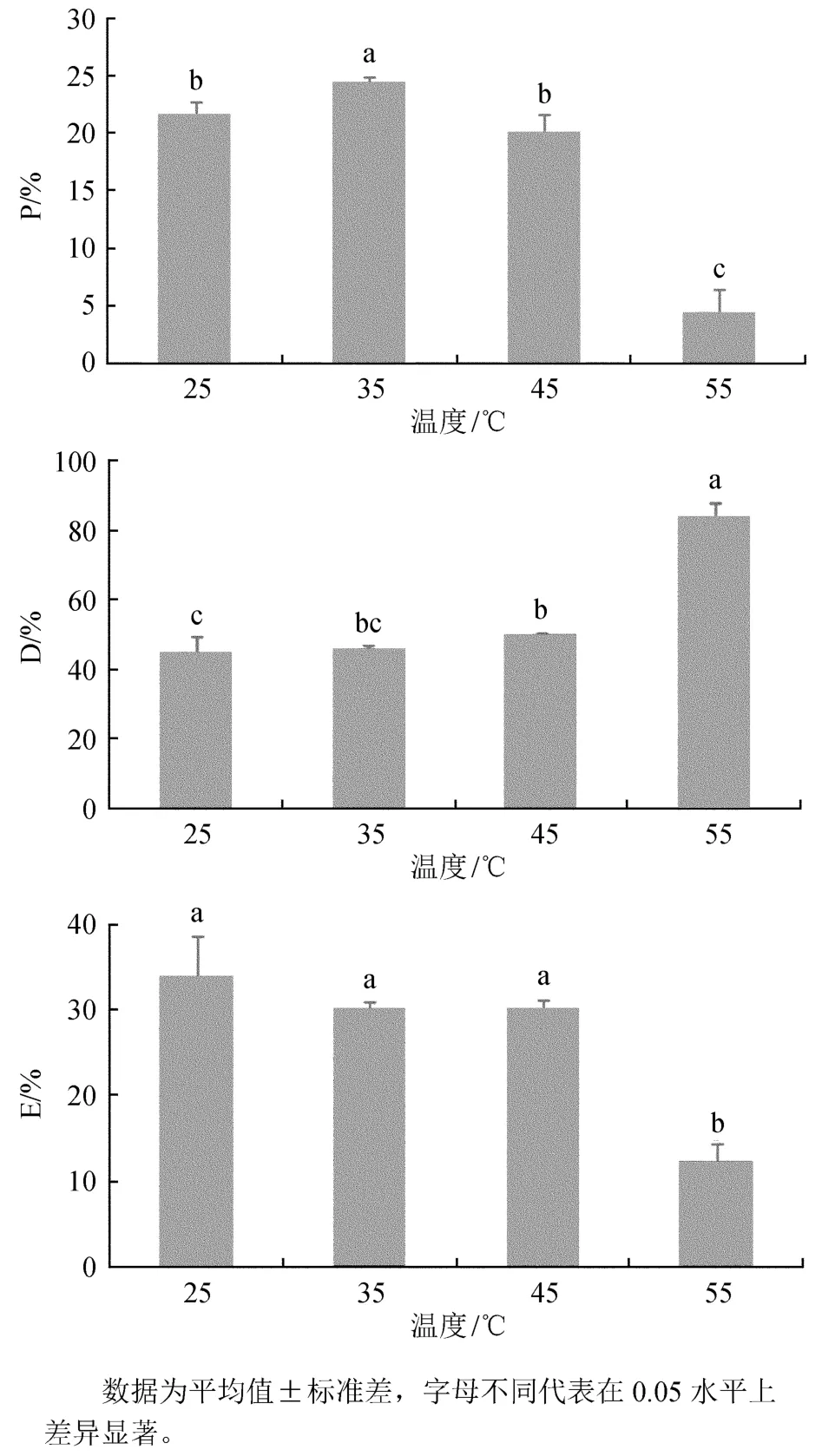
图2 热激对多歧苏铁吸收光能分配比例的影响Fig.2 Effects of heat shock on the distribution of absorbed light in Cycas multipinnata
随着处理温度的升高,D呈上升趋势;25℃处理与45℃处理后的P无显著差异,但35℃处理后的P显著高于其他处理,55℃热激后的P显著低于其他处理;25、35、45℃处理后的E无显著差异,但显著高于55℃处理后的E。可见在25~45℃,多歧苏铁激发能分配比例差异不大,但55℃高温胁迫后,PSⅡ反应中心关闭程度增大,使天线色素吸收的激发能进入PSⅡ光化学反应的部分显著减少,而通过天线色素耗散的激发能显著增加。
2.5热激对多歧苏铁ETRmax、α和Ik的影响
将快速光响应曲线进行拟合,可以获得一系列反映光合能力的参数,包括最大电子传递速率ETRmax、表观光合效率α和半饱和光强Ik。25、35、45℃处理间的ETRmax和α无显著差异,但分别显著高于55℃处理后的ETRmax和α。不同温度处理间的Ik无显著差异(表3)。
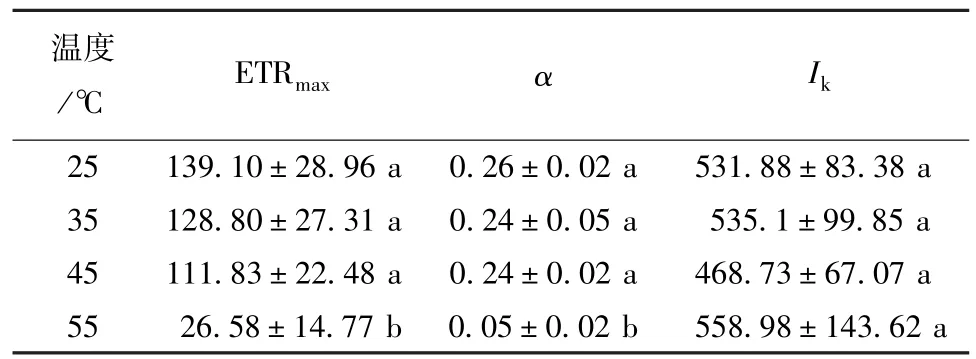
表3 热激对多歧苏铁ETR-PAR响应曲线参数的影响Table 3 Effects of heat shock on parameters of ETR-PAR response curve of Cycas multipinnata
3 结论与讨论
叶绿素作为光合作用中光能的吸收,传递和转化的载体,在植物光合作用中起着关键作用。大量研究表明,在逆境胁迫下,植物体内叶绿素会受到不同程度的破坏,使其含量降低[15]。但也有研究表明植物体内叶绿素含量会随胁迫强度出现高低波动[16-17]。本研究结果显示多歧苏铁的叶绿素a,叶绿素b和叶绿素a+b随温度升高都呈现出先降后升的趋势,在45℃时含量降到最低,55℃时含量又显著提高。45℃时叶绿素含量降低可能与叶绿素的合成受阻及自由基积累加速了叶绿素的降解有关[18-19]。55℃时叶绿素含量又显著升高,具体机理尚不明确。但有学者认为叶绿素含量在胁迫条件下升高是因为:1)叶绿素合成过程需要脯氨酸的参与,胁迫条件下脯氨酸大量累积为叶绿素合成提供物质基础;2)胁迫下植物叶片的叶绿素与叶绿体蛋白之间的结合变得松驰,松驰的叶绿素容易被提取,导致植物在胁迫条件下叶绿素含量的增加[20-21]。张慧[17]的研究也表明蛇足石杉(Huperzia serrata)叶绿素含量在35℃及40℃胁迫下随着处理时间的延长呈先降后升的变化趋势。
PSⅡ被认为是光合作用过程中对高温最敏感的环节,但不同植物对高温的热敏感部位不尽相同[22-23]。PSⅡ位于类囊体膜上,一般认为,高温下因类囊体膜结构发生改变导致Fo增加,反映了PSⅡ反应中心的失活或捕光色素复合体与PSⅡ的分离[24-25]。多歧苏铁在45℃热激2 h后Fo并没有变化,而在55℃热激2 h后才增加,反映了类囊体膜结构对高温具有一定的耐受性。
当植物光合机构吸收的光能超过光合电子传递所能利用的量时,会引起氧化胁迫,导致叶绿体结构的破坏并干扰细胞代谢,从而引起光抑制现象发生[26]。多歧苏铁在25~45℃热激处理间,Fm、Fv/ Fm、Y(NPQ)、Y(NO)、NPQ和qP均无显著差异,但55℃热激后Y(NO)显著升高,Fm、Fv/ Fm、NPQ和qP均显著下降,表明多歧苏铁在25~45℃时PSⅡ反应中心活性尚未受到影响,但是55℃热激后,PSⅡ反应中心受到破坏或可逆失活,关闭程度增大,产生光抑制。研究表明很多植物可以通过热耗散有效避免过剩光能对光合机构的损伤。这类植物在逆境胁迫下表现为NPQ升高,天线色素耗散的能量在叶片所吸收的光能中所占的比例增加[5,27]。在55℃热胁迫下,P显著降低的同时,D显著提高,而NPQ却显著降低。NPQ的显著降低可能是PSⅡ反应中心可逆失活或遭到破坏,使其吸收的光能总量急剧减少导致的。D显著提高而E显著降低,可以看出,在高温胁迫下多歧苏铁可以对能量分配作出有利于光合机构保护的调整,但由于PSⅡ潜在活性降低,仍然无法摆脱过剩激发能对光合机构的损害,这与Fo和Y(NO)显著升高,PSⅡ活性下降、关闭程度增强的结果一致。
PSII光合电子传递速率与光合有效辐射所得到的光响应曲线反映了植物叶片对光照的适应能力。多歧苏铁在25~55℃下,Ik无显著差异。在25~45℃下,ETRmax与α均无显著差异,但分别显著高于55℃处理后的ETRmax与α。表明多歧苏铁在25~55℃温度区间对强光的耐受能力相差不大,但是其在25~45℃区间内的电子传递速率和光能利用率显著高于在55℃下的情况。
综上所述,在25~45℃下,除叶绿素含量有一定波动和多歧苏铁在35℃热激后的Y(Ⅱ)及光化学能量分配(P)显著高出外,其余叶绿素荧光参数均无显著差异。可见,多歧苏铁对高温具有一定的基础耐受性,其具体的生理生化和分子机制尚不清楚。但45℃下,叶绿素含量的降低可能有利于减少对光能的吸收,从而避免过剩光能对光合机构的破坏。55℃热激后,光合机构受到损伤或可逆失活,导致反应中心活性降低,电子传递路径受抑,因此会对多歧苏铁的生长发育产生不利影响。
[参考文献]
[1]吴萍,张开平.云南苏铁植物的现状及保护对策[J].林业调查规划,2008,33(4):116-119.
[2]郑芳勤.叉叶类苏铁是苏铁属植物中最近化的种群[J].植物学通报,2001,18(2):246-250.
[3]Cheeseman J M.Mechanisms of salinity tolerance in plants [J].Plant Physiology,1988,87:547-550.
[4]Tausz M,Sircelj H,Grill D.The glutathione system as a stress marker in plant ecophysiology:is a stress-response concept valid?[J].Journal of Experimental Botany,2004,55:1955-1962.
[5]Ishida A,Yamazaki J Y,Harayama H,et al.Photoprotection of evergreen and drought-deciduous tree leaves to overcome the dry season in monsoonal tropical dry forests in Thailand[J].Tree Physiology,2013,34:15-28.
[6]Jiang H X,Chen L S,Zheng J G,et al.Aluminum-induced effects on PhotosystemⅡphotochemistry in citrus leaves assessed by chlorophyll a fluorescence transient [J].Tree Physiology,2008,28:1863-1871.
[7]王学奎.植物生理生化实验原理和技术[M].北京:高等教育出版社,2006.
[8]Demmig-Adams B,Adams W W.Using chlorophyll fluorescence to assess the fraction of absorbed light allocated to thermal dissipation of excess excitation[J].Physiologia Plantarum,1996,98:253-264.
[9]Demmig B,Björkman O.Comparison of the effect of excessive light on chlorophyll fluorescence(77K)and photon yield of O2evolution in leaves of higher plants [J].Planta,1987,171:171-184.
[10]Schreiber U,Berry J A.Heat induced changes in chlorophyll fluorescence in intact leaves correlated with damage of the photosynthetic apparatus[J].Planta,1977,136:233-238.
[11]Sundby C,Melis A,Maenpaa P,et al.Temperaturedependent changes in the antenna size of PhotosystemⅡ:Reversible conversion of PhotosystemⅡαto PhotosystemⅡβ[J].Biochimica et Biophysica Acta(BBA)-Bioenergetics,1986,851:475-483.
[12]Björkman O,Demmig B.Photon yield of O2evolution and chlorophyll fluorescence characteristics at 77K among vascular plants of diverse origins[J].Planta,1987,170:489-504.
[13]Sarijeva G,Knapp M,Lichtenthaler H K.Differences in photosyntbetic activity,chlorophyll and carotenoid levels,and in chlorophyll fluorescence parameters in green sun and shade leaves of Ginkgo and Fagus[J].Journal of Plant Physiology,2007,164(7):950-955.
[14]余利平,张春雷,马霓,等.甘蓝型油菜对干旱和低磷双重胁迫的生理反应Ⅱ:叶片叶绿素含量及叶绿素荧光参数[J].干旱地区农业研究,2013,31 (2):169-175.
[15]李娟娟,许晓妍,朱文旭,等.淹水胁迫对丁香叶绿素含量及荧光特性的影响[J].经济林研究,2012,30(2):43-47.
[16]徐焕文,刘宇,姜静,等.盐胁迫对白桦光合特性及叶绿素荧光参数的影响[J].西南林业大学学报,2015,35(4):21-26.
[17]张慧.高温胁迫对蛇足石杉生理生化特性的影响[D].长沙:中南林业科技大学,2012.
[18]郭培国,李荣华.夜间高温胁迫对水稻叶片光合机构的影响[J].植物学报,2000,42(7):673-678.
[19]Tewari A K,Tripathy B C.Temperature-stress-induced impairment of chlorophyll biosynthetic reactions in cucumber and wheat[J].Plant Physiology,1998,117:851-858.
[20]赵可夫.植物抗盐生理[M].北京:中国科学技术出版社,1993.
[21]Strogonov B P.Structure and function of plant cell in saline habitats[M].New York:Halsted Press,1973.
[22]孙宪芝.菊花光合作用对高温胁迫的响应机理研究[D].泰安:山东农业大学,2008.
[23]Fryer M J.Relationship between CO2assimilation,photosynthetic electron transport,and active O2metabolism in leaves of maize in the field during periods of low temperature[J].Plant Physiology,1998,116:571-580.
[24]王梅,高志奎,黄瑞虹,等.茄子光系统Ⅱ的热胁迫特性[J].应用生态学报,2007,18(1):63-68.
[25]吴韩英,寿森炎,朱祝军,等.高温胁迫对甜椒光合作用和叶绿素荧光的影响[J].园艺学报,2001,28(6):517-521.
[26]Foyer C H,Lelandais M,Kunert K J.Photooxidative stress in plants[J].Physiologia Plantarum,1994,2:696-717.
[27]吴雪霞,查丁石.NaCl胁迫对茄子幼苗叶片叶绿素荧光参数和能量分配的影响[J].华北农学报,2009,24(6):83-87.
(责任编辑张坤)
第1作者:郑艳玲(1981—),女,博士,讲师。研究方向:驯化生物学及种质资源保存。Email:flashingzyl@163.com。
Effects of Heat Shock on Chlorophyll Content and Fluorescence Characteristics of Cycas multipinnata
Zheng Yanling,Ma Huancheng
(Key Laboratory of Biodiversity Conservation in Southwest China,State Forestry Administration,Southwest Forestry University,Kunming Yunnan 650224,China)
Abstract:In order to investigate the physiological responses of C.multipinnata to heat stress and explore the ecological adaptive mechanisms of this species under heat stress conditions.Detached leaves were used to compare the effects on chlorophyll content and fluorescence parameter of different temperatures(25,35,45,55℃).The results showed that the content of chlorophyll a,chlorophyll b and chlorophyll(a+b)first rising then falling with the increase of temperature.They were decreased to the lowest level after heat shock at 45℃and then increased after heat shock at 55℃.However,chlorophyll a/ b did not vary significantly among leaves treated at different temperatures.Fo,Fm,Fv/ Fm,Y(NPQ),Y(NO),qP,NPQ,ETRmax,α and Ikdid not vary significantly,but Y(Ⅱ)of leaves heated at 35℃was significantly higher than that of leaves heated at 25-45℃.After leaves heated at 55℃,Ikdid not change significantly,but Foand Y(NO)increased significantly and other fluorescence parameters including Fm,Fv/ Fm,qP,NPQ,ETRmaxand α decreased significantly,compared with that of leaves heated at 25-45℃.The fraction of absorbed light allocated to antenna heat dissipation(D)increased with the increase of temperature.The fraction of absorbed light in photochemistry(P)reached to the highest at 35℃but then de-book=2,ebook=5creased to the lowest at 55℃.The fraction of excess excitation energy(E)did not vary significantly at 25-45℃,but decreased significantly at 55℃.In conclusion,C.multipinnata possessed relatively high tolerance to heat stress,and the photosynthetic activity was not affected at 25-45℃;however,the activity of PSⅡreaction center was decreased and the pathway of photosynthetic electron transport was inhibited at 55℃.
Key words:Cycas multipinnata,heat shock,chlorophyll content,fluorescence characteristics,excitation energy dissipation
基金项目:国家自然科学基金项目(31560093)资助;西南林业大学云南省省级重点学科(林学)资助;西南地区生物多样性保育国家林业局重点实验室开放基金资助。
收稿日期:2015-12-18
doi:10.11929/ j.issn.2095-1914.2016.03.001
中图分类号:S718.43
文献标志码:A
文章编号:2095-1914(2016)03-0001-06
