疑似多倍体小木漆的倍性鉴定
2016-06-04韩国伟李旦赵月明田斌和润喜4欧光龙尹五元4何承忠西南林业大学云南省高校林木遗传改良与繁育重点实验室云南昆明6504西南林业大学西南地区生物多样性保育国家林业局重点实验室云南昆明6504西南林业大学云南生物多样性研究院云南昆明6504西南林业大学西南山地森林资源保育与利用省部共建教育部重点实验室云南昆明6504
韩国伟李 旦赵月明田 斌和润喜,4欧光龙尹五元,4何承忠,4(1.西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南昆明6504;.西南林业大学西南地区生物多样性保育国家林业局重点实验室,云南昆明6504;.西南林业大学云南生物多样性研究院,云南昆明6504;4.西南林业大学西南山地森林资源保育与利用省部共建教育部重点实验室,云南昆明6504)
疑似多倍体小木漆的倍性鉴定
韩国伟1,2李 旦3赵月明1,2田 斌2和润喜1,2,4欧光龙2尹五元1,2,4何承忠1,2,4
(1.西南林业大学云南省高校林木遗传改良与繁育重点实验室,云南昆明650224;2.西南林业大学西南地区生物多样性保育国家林业局重点实验室,云南昆明650224;3.西南林业大学云南生物多样性研究院,云南昆明650224;4.西南林业大学西南山地森林资源保育与利用省部共建教育部重点实验室,云南昆明650224)
摘要:以云南省昭通市疑似多倍体小木漆为试材,采用二倍体漆树为对照,通过叶片下表皮气孔观察、流式细胞仪倍性分析、基因组大小测定3种方法对其倍性进行鉴定。结果表明:疑似多倍体小木漆气孔密度为二倍体漆树的0.52倍,气孔长度为二倍体漆树的1.38倍,保卫细胞内叶绿体的个数为二倍体漆树的1.73倍。经流式细胞仪检测分析,疑似多倍体小木漆体细胞倍性为二倍体漆树的1.5倍,其基因组大小(2C DNA含量)平均为(1.22±0.06)pg,而二倍体漆树的基因组大小(2C DNA含量)平均为(0.96±0.04)pg,基因组大小之比为1.27∶1。综上所述,采集的疑似多倍体小木漆为天然三倍体漆树。
关键词:小木漆;倍性;基因组大小;流式细胞仪
漆树(Toxicodendron vernicifluum)隶属于漆树科(Anacardiaceae)漆树属,落叶乔木,主要分布于我国陕西、云南、四川、甘肃、重庆、贵州和湖北7个省市,印度、朝鲜、日本也有分布[1-2]。漆树的主要产品为生漆,是目前唯一来自于绿色植物,经过生物酶催化作用,在常温条件就能够固化成膜的生物高分子涂料,具有耐酸碱、耐磨、耐高温、绝缘性好、附着力强等特点,不仅具有“涂料之王”的美誉,也是现代农业、工业和军工等领域的重要原料[2-3]。此外,漆树也是优良的蜜源、药用、材用及生态保护树种,属于经济价值高,产品类型多的重要经济树种[4-5]。
我国漆树资源丰富,品种繁多,但这些品种大都是二倍体,三倍体漆树在自然界中存在不多,直至1985年才首次发现产于陕西平利县的“大红袍”品种为三倍体漆树(2n = 3X = 45)[6],这是迄今发现的唯一天然三倍体漆树资源,在国内外引起广泛关注。课题组在前期对昭通市小木漆种质资源调查中发现,部分小木漆树体具有高度不育、枝叶茂密、叶片肥大、树干粗壮、产漆量高的特征,初步推测该树体可能为多倍体。为此,本研究采用叶片下表皮气孔特征观测、流式细胞仪倍性分析、基因组大小测定3种方法,进一步明确疑似多倍体小木漆的倍性,探明其优良性状的遗传基础,为良种审定及其推广应用提供科学理论依据。
1 材料与方法
1.1材料来源
试验材料于2013年3月采自云南昭通市,选取疑似多倍体小木漆5株的根段,截为15 cm左右长度的根段,埋根育苗于西南林业大学格林温室。2个月后以根萌幼苗为试验材料,采集嫩叶进行叶片下表皮气孔特征观测、倍性测定及基因组大小分析,二倍体漆树嫩叶采集于播种繁殖获得的幼苗,作为对照材料。水稻品种日本晴(Oryza sativa subsp.japonica cv.Nipponbare)取自中国科学院昆明植物研究所。
1.2研究方法
1.2.1叶片下表皮气孔特征观察
5月中旬对叶片进行取样,随机选取两种漆树各10株幼苗,从每株顶端向下第2~4轮正常叶中选1片叶,放于无菌水中保鲜,带回实验室。从叶片上撕取其中部的下表皮置于载玻片上,滴1~2滴蒸馏水,加上盖玻片,在10×40倍的显微镜(Axiovert 200M)下选4个视野,统计每个视野内的气孔个数及长度。并在每个视野中选取5个清晰的保卫细胞,统计叶绿体数量,并用Zsiss Axion Vision 4.8软件拍照,计算平均值。
1.2.2倍性测定
参照白风莹等[7]方法进行。取2种漆树各3株苗木的新鲜叶片20 mg,加入1 mL的裂解液,构成为LB 01 buffer:15 mmol/ L Trise,2 mmol/ L Na2EDTA,0.5 mmol/ L spermine.4 HCI,80 mmol/ L KCl,20 mmol/ L NaCl 0.1%(v/ v),TritonX-100 (pH 8.0),用剃须刀片在冰上迅速切碎。用400目的尼龙网过滤至2 mL的离心管中加入DAPI 50 μL,充分混匀。使用cyflow ploidy analyser(Partec公司)仪器进行流式细胞仪倍性分析,并采用Mod Fit软件(Yerity Software House公司)分析结果。每样品重复3次。
1.2.3基因组大小测定
参照周至里等[8]方法进行。以水稻品种日本晴为内标,分别采集两种漆树各3株苗木的新鲜叶片1 g,蒸馏水快速清洗后用滤纸吸干,放在冰上预冷,加入预冷的解离液(1~2 mL),用锋利的刀片一次性快速切碎。用400目的滤膜将解离液过滤至1.5 mL离心管中,置于4℃冰箱中孵育5 min,1 000 r/ min 4℃离心5 min。弃去上清液,向沉淀中加入100 μL预冷的解离液,再向细胞悬液中各加入150 μL预冷的碘化丙啶(PI)染料,置于4℃冰箱中避光染色10 min。染色后移至上样管,上机检测,每个样品收集5 000~10 000个颗粒,采用流式细胞仪Cyflow Space(Partec公司)进行测定,每样品重复测定3次。测定过程采用488 nm的蓝光激发,收集FL2通道的荧光并检测PI发射的荧光强度。漆树样品核DNA含量(pg)的计算公式如下:

2 结果与分析
2.1叶片下表皮气孔特征比较
在10×40倍的显微镜下可清楚地观察到疑似多倍体小木漆的气孔大小和单位面积内的数量与二倍体漆树之间存在着明显差异(图1~2),其中疑似多倍体小木漆的气孔长度大于二倍体漆树,而单位面积内气孔数量小于二倍体漆树。

图1 疑似多倍体漆树气孔密度与大小Fig.1 The density and size of stomata in pseudo-polyploidy of T.vernicifluum

图2 二倍体漆树气孔密度与大小Fig.2 The density and size of stomata in diploid T.vernicifluum
疑似多倍体小木漆与二倍体漆树气孔长度、单积面积内数量及保卫细胞内叶绿体数见表1。由表1可知,疑似多倍体小木漆的气孔长度为二倍体漆树的1.38倍,单位面积内气孔的数量为二倍体漆树的0.52倍,而保卫细胞内叶绿体数量为二倍体漆树的1.73倍。

表1 二倍体和疑似多倍体漆树气孔长度、数量及叶绿体数Table 1 The lenghth and number of stomata and chloroplast number in diploidy and pseudo-polyploidy of T.vernicifluum
2.2染色体倍性鉴定
采集疑似多倍体小木漆根萌苗和二倍体漆树实生苗的幼嫩叶片进行倍性检测,通过流式细胞仪可以清楚地鉴定出倍性水平。由图3可见,二倍体漆树的荧光通道值为50,而疑似多倍体小木漆的荧光通道值为75,荧光峰值的通道位置反映了测试样品的倍性。由此可见,疑似多倍体小木漆的倍性为二倍体漆树的1.5倍,表明该多倍体为天然三倍体。

图3 二倍体漆树和疑似多倍体小木漆的倍性流式细胞分析Fig.3 Flow cytometry analysis of ploidy in diploidy and pseudo-polyploidy of T.vernicifluum
2.3基因组大小比较
本试验采用水稻品种日本晴作为内标,应用流式细胞仪测定了3份水稻样品,计算G0/ G1峰荧光均值为108.33。之后测定疑似多倍体和二倍体漆树共计6份样品,每份样品重复测定3次。3份二倍体漆树和3份疑似多倍体小木漆的流式细胞图谱见图4和图5,其2C DNA含量统计结果见表2。

图4 二倍体漆树样品的流式细胞分析Fig.4 Flow cytometry analysis of diploid T.vernicifluum
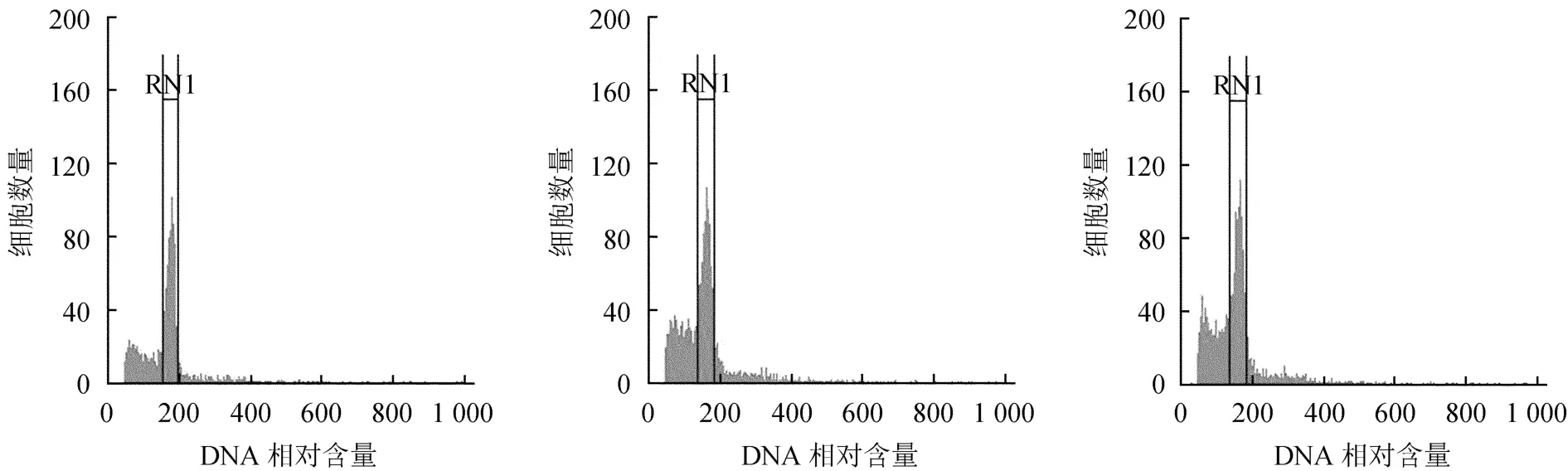
图5 疑似多倍体漆树样品的流式细胞分析Fig.5 Flow cytometry analysis of pseudo-polyploid T.vernicifluum
已知水稻品种日本晴的2C DNA含量为0.795 pg[9],根据所测样品的PI发射荧光强度,计算出疑似多倍体小木漆的基因组大小(2C DNA含量)平均为(1.22±0.06)pg,二倍体漆树基因组大小(2C DNA含量)平均为(0.96±0.04)pg,疑似多倍体小木漆的基因组大小为二倍体漆树的1.27倍。

表2 二倍体漆树与疑似多倍体小木漆2C DNA含量Table 2 2C DNA contents of diploid and pseudopolyploid T.vernicifluum
3 结论与讨论
刘谦虎等[10]在漆树气孔的观察和测定过程中发现,三倍体漆树大红袍的气孔密度为二倍体漆树品种的66%~69%,其长轴较野生漆树长14%。此外,在大量多倍体鉴定方法的研究中发现,保卫细胞内叶绿体数目与倍性密切相关,是有效的多倍体简接鉴定方法[11-14]。本研究中,通过统计二倍体漆树和疑似多倍体小木漆叶片下表皮气孔的特征发现,在相同视野内,疑似多倍体小木漆气孔个数为二倍体的0.52倍,气孔长度为二倍体的1.38倍,保卫细胞内叶绿体的个数为二倍体的1.73倍。该研究结果与刘谦虎等[10]、施先锋等[11]研究结果一致。
流式细胞仪的最大特点是可以自动快速地测定同一个细胞的多种相关参数,并同时可以获得细胞的2种散射光强以及3种不同波长荧光强度的信息。这些信息可以代表细胞或细胞器的各种形态参数、生物学特性、生化成分以及细胞功能,因而可用于多种用途的检测工作[15]。其中,流式细胞仪鉴定植物倍性的可靠性已得到众多实验的证实,近年来已发展成为取代染色体计数方法的一种快捷而可靠的技术手段得到越来越广泛的应用[16-21]。本研究中,经流式细胞仪检测表明,二倍体漆树植株主峰荧光强度位于50左右,疑似多倍体小木漆植株主峰荧光强度位于75左右,其值约为二倍体漆树的1.5倍。根据漆树样品的PI发射荧光强度,计算出二倍体漆树的基因组大小(2C DNA含量)平均为(0.96±0.04)pg,疑似多倍体小木漆的基因组大小(2C DNA含量)平均为(1.22±0.06)pg,多倍体2C DNA的含量为二倍体2C DNA含量的1.27倍。
综合叶片下表皮气孔观察、流式细胞仪倍性分析、基因组大小测定3种方法鉴定的结果可见,疑似多倍体小木漆相比二倍体漆树而言,其气孔密度明显降低,气孔长度明显增长,保卫细胞内叶绿体的数量明显增多,倍性增高1.5倍,基因组大小增大1.27倍,表明前期采集的疑似多倍体小木漆为天然三倍体。
[参考文献]
[1]杨胜辉.漆树的生物学特性及开发利用前景[J].内蒙古林业调查设计,2011(6):48-49.
[2]张鹏,廖声熙,崔凯,等.中国漆树资源与品种现状及产业发展前景[J].世界林业研究,2013,26(2):65-69.
[3]Hashida K,Tabata M,Kuroda K,et al.Phenolic extractives in the trunk of Toxicodendron vernicifluum:chemical characteristics,contents and radial distribution[J].Journal of Wood Science,2014,60(2):160-168.
[4]Suk K T,Baik S K,Kim H S,et al.Antibacterial effects of the urushiol component in the sap of the lacquer tree (Rhus verniciflua Stokes)on Helicobacter pylori[J].Helicobacter,2011,16(6):434-443.
[5]贺娜,张飞龙,张瑞琴.漆树资源,环境与人类文化:漆树与经济社会,人类健康[J].中国生漆,2012,30(4):17-24.
[6]尚宗燕,张继祖,刘谦虎,等.漆树染色体观察及三倍体漆树的发现[J].西北植物学报,1985,5(3):187-191.
[7]白凤莹,曾青青,康宁,等.毛白杨基因库优树倍性检测及性状对比分析[J].北京林业大学学报(自然科学版),2015,37(4):113-119.
[8]周至里,熊智,马焕成,等.两种木棉科植物基因组大小测定[J].西部林业科学,2014,43(2):97-101.
[9]International Rice Genome Sequencing Project.The mapbased sequence of the rice genome[J].Nature,2005,436(7052):793-800.
[10]刘谦虎,张继祖,尚宗燕,等.漆树气孔的观察和测定[J].陕西林业科技,1986(1):1-2.
[11]施先锋,彭金光,李煜华,等.西瓜多倍体鉴定方法的研究[J].浙江农业科学,2010(2):273-275.
[12]武晓阳,孟义江,袁静娅,等.乌拉尔甘草四倍体的离体诱导及倍性鉴定[J].河北农业大学学报,2009,31(4):18-21.
[13]Shiga I,Uno Y,Kanechi M,et al.Identification of polyploidy of in vitro anther-derived shoots of Asparagus officinalis L.by flow cytometric analysis and measurement of stomatal length[J].Journal of the Japanese Society for Horticultural Science,2009,78(1):103-108.
[14]周玉丽,任士福,张成合.连翘多倍体诱导与鉴定[J].河北农业大学学报,2011,34(1):73-77.
[15]何克健.流式细胞技术与流式细胞仪[J].医疗装备,2004,13(5):6-8.
[16]Farnham M W,Caniglia E J,Thomas C E.Efficient ploidy determination of anther-derived broccoli[J].HortScience,1998,33(2):323-327.
[17]Wang M,Farnham M W,Nannes J S P.Ploidy of broccoli regenerated from microspore culture versus anther culture[J].Plant Breeding,1999,118(3):249-252.
[18]范国强,杨志清,曹艳春,等.毛泡桐同源四倍体的诱导[J].植物生理学通讯,2007,43(1):109-111.
[19]马爱红,范培格,孙建设,等.四倍体葡萄诱导技术的研究[J].中国农业科学,2005,38(8):1645-1651.
[20]张振超,张蜀宁,张伟,等.四倍体不结球白菜的诱导及染色体倍性鉴定[J].西北植物学报,2007,27(1):28-32.
[21]Nobuo K,Sachiho Y,Katsumi O,et al.Morphological characteristics and their inheritance in colchicine-induced Salvia polyploids[J].Journal of the Japanese Society for Horticultural Science,2008,77(2):186-191.
(责任编辑张坤)
第1作者:韩国伟(1991—),男,硕士生。研究方向:林木遗传育种与良种繁育。Email:1224907140@qq.com。
Ploidy Identification of Pseudo-Polyploidy in Toxicodendron vernicifluum
Han Guowei1,2,Li Dan3,Zhao Yueming1,2,Tian Bin2,He Runxi1,2,4,Ou Guanglong2,Yin Wuyuan1,2,4,He Chengzhong1,2,4
(1.Key Laboratory for Forest Geneticand Tree Improvement&Propagation in Universities of Yunnan Province,Southwest Forestry University,Kunming Yunnan 650224,China;2.Key Laboratory of Biodiversity Conservation in Southwest China,State Forestry Administration,Southwest Forestry University,Kunming Yunnan 650224,China;3.Yunnan Academy of Biodiversity,Southwest Forestry University,Kunming Yunnan 650224,China;4.Key Laboratory for Forest Resources Conservation and Use in the Southwest Mountains of China,Ministry of Education,Southwest Forestry University,Kunming Yunnan 650224,China)
Abstract:With a pseudo-polyploidy of Toxicodendron vernicifluum in Zhaotong,Yunnan province as the experimental materials,and the diploid T.vernicifluum as the control group,ploidy were determined by observation of the stomotal characteristic of leaf lower epidermis,analysis of flow cytometry and measurement of genome size.The results showed that the stomata density of pseudo-polyploidy of T.vernicifluum was 0.52 times,the length of stomata was 1.38 times,and the number of chloroplast in the guard cells was 1.73 times compared with diploid T.vernicifluum,respectively.According to the results by flow cytometry analysis,the ploidy of somatic cell in pseudo-polyploidy of T.vernicifluum was 1.5 times to that of the diploid T.vernicifluum,the average genome sizes(the content of 2C DNA)of pseudo-polyploidy of T.vernicifluum and diploid T.vernicifluum was about(1.22±0.06)pgbook=8,ebook=11and(0.96±0.04)pg,respectively,and the average genome sizes of pseudo-polyploidy of T.vernicifluum was 1.27 times to diploid T.vernicifluum.Above all,it could be concluded that the pseudo-polyploidy of T.vernicifluum was a natural triploid lacquer.
Key words:Toxicodendron vernicifluum,ploidy,genome size,flow cytometry
通信作者:何承忠(1970—),男,博士,教授。研究方向:林木遗传育种与生物技术。Email:hcz70@163.com。
基金项目:云南省教育厅重大专项(ZD2013014)资助;西南林业大学云南省省级重点学科(林学)建设项目资助;西南林业大学大学生创新基金项目(C1475)资助;西南林业大学科研启动基金项目(111409)资助;西南地区生物多样性保育国家林业局重点实验室开放基金资助。
收稿日期:2015-12-26
doi:10.11929/ j.issn.2095-1914.2016.03.002
中图分类号:S718.46
文献标志码:A
文章编号:2095-1914(2016)03-0007-05
