调节性T细胞及辅助性T细胞在慢性阻塞性肺疾病模型大鼠的表达及临床意义
2016-06-04陈艳蓉王梦然
陈艳蓉 肖 瑶 刘 彦 王梦然 张 建
(首都医科大学附属北京友谊医院医疗保健中心内科,北京 100050)
调节性T细胞及辅助性T细胞在慢性阻塞性肺疾病模型大鼠的表达及临床意义
陈艳蓉肖瑶刘彦王梦然张建
(首都医科大学附属北京友谊医院医疗保健中心内科,北京100050)
〔摘要〕目的探讨慢性阻塞性肺疾病(COPD)模型大鼠调节性T细胞(Treg)、辅助性T细胞(Th17)的表达及临床意义。方法按随机数字法将80只大鼠随机分为模型组和对照组各40只,分别测定两组大鼠肺功能,包括用力肺活量(FVC)、0.3 s用力呼气容积(FEV 0.3)、用力呼气峰值流速(PEF)、FEV0.3/FVC以及炎性因子,包括白细胞介素(IL)-6、IL-17、IL-1β、IL-35以及IL-10水平,并检测肺组织IL-17、FoxP3及外周血Treg水平。结果模型组大鼠日渐少动、皮毛无光泽、大便稀、呼吸急促,有咳嗽、痰鸣音和分泌物;对照组大鼠则正常活动和呼吸。模型组大鼠FEV0.3、FVC、PEF、FEV0.3/FVC较对照组显著降低(P<0.01);模型组大鼠血清IL-6、IL-17、IL-1β水平较对照组显著升高,而IL-10及IL-35水平显著降低(P<0.001);模型组肺组织中FoxP3的相对表达量显著低于对照组,而IL-7相对表达量显著高于对照组(P<0.001),且模型组外周血Treg水平显著低于对照组(P<0.001)。结论COPD病变存在高炎性反应,与Th17和Treg表达失衡,调节功能降低,以致炎性反应进一步加重有关。
〔关键词〕慢性阻塞性肺疾病;调节性T细胞;Th17细胞
慢性阻塞性肺疾病(COPD)是呼吸系统中的常见病变〔1〕。调节性T细胞(Treg)属于控制机体自身免疫反应的一类细胞亚群,与自身免疫性疾病有密切关系〔2〕。辅助性T细胞(Th17)是新发现的一种可分泌白细胞介素(IL)-17的T细胞亚群,对自身免疫病变、机体防御等方面有重要作用。Th17和Treg在体内免疫环境中具有重要的维持作用,且两者在分化过程中能相互一致,任意一种表达失衡都可能导致局部甚至全身性异常免疫变化,导致一系列免疫性疾病、感染、肿瘤等〔3〕,本研究分析Treg、Th17在COPD模型大鼠中的表达及意义。
1材料与方法
1.1材料80只雄性大鼠,鼠龄6个月,重量170~200 g,平均(183±12)g,由大连医科大学动物实验中心提供,许可证号SCXK(辽)2008-2002,清洁级标准饲养。将大鼠按照编号分为模型组和对照组各40只。
1.2建模方法COPD改良法建立起动物模型,并于试验开始的第1、14天采用6%的水合氯醛麻醉成功后,暴露大鼠气管并注入200 μl(1 mg/ml)脂多糖(由美国Sigma公司提供,批号为20100109558)。第2天将模型大鼠放入烟室内,以香烟丝10支(红三环牌,滁州卷烟厂生产,每支焦油含量为11 mg,尼古丁为0.8 mg)、锯末50 g混合后点燃烟熏,1次/d,30 min/次,造模周期为28 d。
1.3方法
1.3.1观察大鼠生长情况每天对大鼠活动情况、精神、大便、反应、呼吸系统变化(是否咳嗽、有无痰鸣音、呼吸道分泌物)等情况进行观察和记录。
1.3.2大鼠肺功能测定采用动物肺功能分析系统(北京贝兰博科技有限公司,型号为AniRes2003)测定大鼠用力肺活量(FVC)、0.3 s用力呼气容积(FEV0.3)、用力呼气峰值流速(PEF)以及FEV0.3/FVC。测定方法:以10%的水合氯醛(0.35 ml/100 g)经大鼠腹腔注射行麻醉,成功后由经气管插管,将大鼠放置到体描箱中,头置于低位,连接呼吸机行机械通气法测定肺功能。测定时采用外加压力法使之深吸气和深呼气,以确保能快速、准确测定出各项肺功能指标。
1.3.3大鼠炎性因子水平检测采用酶联免疫吸附法测定建模28 d后血清炎性因子,包括IL-6、IL-17、IL-1β、IL-35以及IL-10水平,由经培训的专业人员严格按照试剂盒操作说明进行。方法:采用包被缓冲液将IL-6、IL-17、IL-1β、IL-10及IL-35捕获抗体(均由美国RD公司提供)稀释为适宜浓度;各凹孔分别加入稀释抗体100 μl,室温条件下孵育2 h;结束后移除包被液,并采用0.05%吐温-20洗涤缓冲液对凹孔清洗2次;再次分别加封闭液300 μl,经室温下孵育1 h后倒出残留液,300 μl洗涤液清洗2次;各凹孔再分别加入稀释生物素化检测抗体100 μl,37℃条件下孵育1 h;倒出洗涤液,连续重复3次。每凹孔增加稀释后的碱性磷酸酶标记特异性抗体溶液100 μl,室温下孵育1 h;倒出残余液体后进行3次洗涤;洗涤液浸泡5min;倒出液体于各凹孔倒入洗涤液进行洗涤,连续洗涤5次;各孔加入底物200 μl;室温下显色30 min,后于凹孔中加入0.05 ml H2SO4,并采用酶标仪(美国Bio-TEK公司提供,型号ELX800)波长约410 mm测定IL-6、IL-17、IL-1β、IL-10及IL-35光密度(OD值)。
1.3.4大鼠肺组织IL-17、FoxP3的表达建模完成28 d后以链霉抗生物素蛋白-过氧化酶法进行检测,经由专业人员根据相关试剂盒的操作说明书严格进行。方法:①首先制作肺组织切片:于大鼠右肺取组织以10%甲醛48 h固定,对右肺上叶和肺门组织进行冲洗、脱水、透明、浸蜡、包埋等常规处理后,制成5 μm厚度的切片;再对切片进行脱蜡、脱水、染色和中性树胶封片等常规处理,后备用。②表达情况测定:将IL-17、FoxP3单克隆抗体(美国Santa Cruz公司提供,批号为SC-165)按照1∶200进行稀释,在各肺组织切片中人选择一张,采用磷酸盐缓冲液(PBS)0.01 mol/L代替一抗染色,作为阴性对照。在切片中选5个视野,以细胞核、细胞质中有黄色至棕褐色颗粒为阳性反应。免疫组化染色半定量测定:采用由美国Image-pro plus公司提供的专业图像分析软件系统对图像进行分析,以积分光密度(IOD)来表示肺组织中IL-17、FoxP3的蛋白表达情况,IOD越高蛋白表达越高(IOD为面积密度和平均光密度的乘积)。
1.3.5大鼠外周血Treg水平检测建模成功28 d后,取100 μl新鲜血液按照每管106个细胞分别加入1.0 μg CD25单抗(美国BD公司提供,批号132004)、0.25 μg CD4单抗(美国BD公司提供,批号110240),避光约0.5 h后加入1 ml红细胞裂解液,再避光约20 min。后以PBS清洗2遍,离心后除去上清液,采用流式细胞仪(美国Beckman Coulter,型号Epicsel XL)对Treg表达情况进行检测。
1.4统计学方法采用SPSS18.0软件进行χ2检验、t检验。
2结果
2.1两组大鼠体征观察外观:对照组大鼠均活泼好动,全身皮毛有光泽、食量正常,体重均渐渐增高;模型组大鼠日渐蜷伏、少动、拱背、蜷卧、食量减少,毛不具有光泽、易脱落,大便溏稀、体重与对照组相比较低。呼吸:对照组大鼠呼吸较为平稳,呼吸道内无分泌物,无痰鸣音;模型组大鼠则呼吸急促、口鼻流出明显分泌物,不时闻及痰鸣音、咳嗽,且随着入组时间的加长,症状渐渐加重。
2.2两组大鼠肺功能指标比较模型组大鼠FEV0.3、FVC、PEF、FEV0.3/FVC较对照组显著降低(P<0.01),见表1。
2.3两组大鼠炎性因子水平比较模型组大鼠血清IL-6、IL-17、IL-1β水平较对照组显著升高,而IL-10及IL-35水平显著降低(P<0.001),见表2。
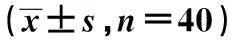
表1 两组大鼠肺功能指标比较
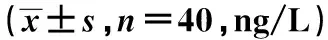
表2 两组大鼠模型血清炎性因子水平比较
2.4两组肺组织中IL-7、FoxP3和外周血中Treg水平比较模型组肺组织中FoxP3的相对表达量显著低于对照组,而IL-7相对表达量显著高于对照组(P<0.001),且模型组外周血Treg水平显著低于对照组(P<0.001),见表3。
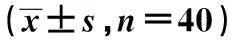
表3 两组大鼠模型肺组织中IL-7、FoxP3表达情况和
3讨论
COPD作为一种全身性病变,不仅累及呼吸系统,而且病程进展过程中对全身器官、相关系统均有不良影响〔4〕。COPD病机较为复杂,早期研究认为巨噬细胞、中性粒细胞是导致COPD炎性反应的主要细胞,但随着近年来研究的不断深入已证实,T淋巴细胞导致的炎性反应以及自身免疫均是激活巨噬细胞、中性粒细胞的关键〔4〕。由于二氧化碳潴留、低氧以及反复性感染等导致机体长时间处于应激状态,促进了下丘脑-垂体-肾上腺髓质轴的过度兴奋,提高了胰高糖素、糖皮质激素、儿茶酚胺等分解激素的水平,胰岛素释放被抑制,进而发生胰岛素抵抗(IR),造成血糖增高现象〔5〕。这不仅增加了机体能量消耗,还对病患呼吸肌力量、免疫功能等造成损伤,引起毛细血管闭塞、肺小动脉硬化等,进而形成死腔样通气,肺通气/血流失衡,氧合指数显著降低,局部组织严重缺氧,最终形成恶性循环〔6〕。
研究显示,香烟所参与的激活T细胞并介导相应免疫应答,对COPD的气道炎性反应具有持续性进展作用〔7〕。本研究与相关文献〔8〕报道结果一致,证实COPD大鼠模型肺功能降低后,肺组织中FoxP3表达降低,其免疫调节作用降低,难以抑制机体收到的炎性刺激,进而导致COPD肺功能持续性降低,这也可能是临床上COPD患者出现肺气肿的原因〔9〕。
Treg作为一组CD4T细胞亚型,以负免疫调节功能为主,可介导免疫调节、加强免疫耐受性,以维持内环境的稳定状态。Treg表达异常与多种慢性炎性病变、自身免疫性疾病均有密切关系〔10〕。Treg细胞免疫机制主要体现在3个方面:①细胞-细胞接触依赖性机制,也是Treg主要作用机制,CD4+CD25+Treg通过效应T细胞的该作用机制对T细胞增殖、IL-2转录和表达进行抑制〔11〕;②抑制性细胞因子依赖机制,目前普遍认为IL-2、IL-10等因子在Treg细胞抑制功能中有重要作用;③通过与抗原呈递细胞来调节机体的免疫功能。王华英等〔1〕提出了Treg/Th17平衡的新理论。Th17能特异性分泌出IL-17,将中性粒细胞、巨噬细胞向炎性组织聚集,加重炎性反应。Treg则可抑制炎症反应,以维持免疫稳定性。两者通过相互抑制、拮抗,促使内环境维持在相对平衡的状态〔12〕。本研究进一步证实了COPD导致炎性反应,Treg、Th17的表达明显失衡〔13〕。COPD的肺功能与Treg、Th17表达情况密切相关,且Treg、Th17在免疫调节中有相互抑制、拮抗作用。当Treg、Th17表达失衡,机体免疫调节功能降低,则导致炎性反应加重。因此临床检测二者有助于针对病情制定科学、有效的治疗方案,值得进一步研究。
4参考文献
1王华英,翁跃颂,应华娟,等.慢性阻塞性肺疾病患者 Th17/Treg 细胞失衡与肺功能相关性研究〔J〕.中华微生物学和免疫学杂志,2014;34(7):527-33.
2林琳.老年慢性阻塞性肺疾病患者外周血HIF-1α、IL-18、Th17和Treg的表达及与肺功能的关系〔J〕.中国老年学杂志,2015;35(17):4927-9.
3黄娟,李光熙,金在艳,等.慢性阻塞性肺疾病急性加重对患者生活质量的影响〔J〕.现代生物医学进展,2015;15(15):2863-7.
4张建全,钟小宁.Th17细胞在慢性阻塞性肺疾病肺部炎症中的作用〔J〕.国际免疫学杂志,2010;33(5):354-7.
5陈宁,徐燕,张永红,等.慢性阻塞性肺病大鼠外周血中Foxp3+调节性T细胞及IL-17、IL-6水平的变化〔J〕.中国现代医学杂志,2014;24(27):24-8.
6Bai J,Qiu SL,Zhong XN,etal.Erythromycin enhances CD4+Foxp3+regulatory T-cell responses in a rat model of smoke-induced lung inflammation〔J〕.Mediat Inflamm,2012;2012(2):410232-40.
7范伟,刘朝晖,张溪林,等.慢性阻塞性肺疾病大鼠膈肌萎缩信号通路与白细胞介素17相关性的研究〔J〕.中国呼吸与危重监护杂志,2011;10(6):527-32.
8陈钢,谢灿茂,罗志扬,等.慢性阻塞性肺疾病加重期和稳定期Th17和Treg细胞的表达〔J〕.中山大学学报(医学科学版),2013;34(6):917-21.
9仝重芳,李卫东,赵卉,等.辛伐他汀对慢性阻塞性肺疾病大鼠白细胞介素-6基质金属蛋白酶-9表达的影响〔J〕.中国药物与临床,2011;11(3):266-7.
10王成阳,刘向国,彭青和,等.Foxp3/Treg与RORγt/Th17细胞失衡在慢性阻塞性肺疾病大鼠中的作用〔J〕.中华危重病急救医学,2014;30(12):860-4.
11王成阳,刘向国,王传博,等.COPD大鼠T细胞介导转录因子对Th1/Th2细胞调控的实验研究〔J〕.四川大学学报(医学版),2014;45(6):941-5.
12李向阳,曾宪升,何江玲,等.慢性阻塞性肺疾病患者外周血CD4+CD25+CD127(Low/-)调节性T细胞的检测及临床意义〔J〕.现代生物医学进展,2010;10(7):1294-6.
13Li Y,Li SY,Li JS,etal.A rat model for stable chronic obstructive pulmonary disease induced by cigarette smoke inhalation and repetitive bacterial infection〔J〕.Biol Pharm Bull,2012;35(10):1752-60.
〔2015-06-11修回〕
(编辑李相军/滕欣航)
第一作者:陈艳蓉(1980-),女,硕士,住院医师,主要从事老年医学,呼吸病学方面的研究。
〔中图分类号〕R563
〔文献标识码〕A
〔文章编号〕1005-9202(2016)09-2078-03;
doi:10.3969/j.issn.1005-9202.2016.09.013
通讯作者:张建(1955-),男,主任医师,主要从事老年病,呼吸病学方面的研究。
