丘脑-皮层动态功能连接特点和性别差异
2016-06-02张仁杰张久权聂生东
季 冰, 张仁杰, 张久权, 聂生东
(1.上海理工大学 光电信息与计算机工程学院,上海 200093; 2.上海理工大学 医学影像工程研究院,上海 200093;3.重庆市第三军医大学附属西南医院 放射科,重庆 400038)
丘脑-皮层动态功能连接特点和性别差异
季冰1,2,张仁杰1,张久权3,聂生东2
(1.上海理工大学 光电信息与计算机工程学院,上海200093; 2.上海理工大学 医学影像工程研究院,上海200093;3.重庆市第三军医大学附属西南医院 放射科,重庆400038)
摘要:利用丘脑-皮层连接的动态特性估计男性和女性丘脑-皮层功能连接的不同状态,并通过统计学方法分析性别对于动态丘脑-皮层功能连接模式的影响.结果表明:在男性和女性中各自发现了9个动态功能连接状态,且在9个状态中,男性的丘脑-皮层的功能连接显著高于女性的丘脑-皮层的功能连接,拓展了人们对于丘脑-皮层连接的理解,并且探讨了动态丘脑-皮层功能连接的性别差异.
关键词:丘脑; 功能连接; 动态特性; 性别差异
丘脑作为连接不同皮层下区域和大脑皮层的中继站,除嗅觉外,所有各种感觉的传导通路均通过丘脑再投射到大脑皮层区域.不少学者已经利用静息态磁共振成像(resting-state functional magnetic resonance imaging,rs-fMRI)技术探究了丘脑和皮层功能连接[1-4].但是,这些研究只考虑了功能连接的静态模式,或是假设连接随着时间的变化是固定不变的[5].然而,研究表明功能连接的强度不仅在同一扫描时间内发生变化,而且在很短的扫描范围(秒)内都会发生变化[6].所以,考虑功能连接的动态变化特性可以提供更全面和可靠的丘脑和皮层的连接模式.
另外,男性和女性在生理上、心理上以及社会分工的不同都会影响功能连接[7-8].前人利用弥散张量成像(diffusion tensor imaging,DTI)技术发现男性的脑白质微观结构的各向异性值显著地高于女性的各向异性值[9].有研究利用fMRI技术发现男性与女性在感觉、认知、运动及工作记忆等方面存在很大的差异[10-14].但是,这些研究只是建立在静态分析的基础上.因此,有必要进一步探讨丘脑-皮层动态功能连接的性别差异.
本研究旨在探索丘脑-皮层(丘脑-前额皮层、丘脑-前运动区皮层和运动区皮层、丘脑-体感皮层、丘脑-顶叶皮层和枕叶皮层、丘脑-颞叶皮层)的功能连接模式的动态特性.并在此基础上进一步探究在各个功能连接状态下,男性和女性的丘脑-皮层的功能连接模式的差异.
1对象和方法
1.1静息态磁共振数据的获取和预处理
分析中采用的静息态fMRI数据是从人类连接组项目 (human connectome project,HCP) 开放公共网站(www.humanconnectomeproject.org)中获得[15],使用西门子3T扫描仪,32通道头线圈结构.被试被要求保持睁眼状态并盯着十字架.图像的获得参数:平面视野(field of view,FOV)为208 mm×180 mm,层数为72,体素大小为2 mm×2 mm×2 mm,TR时间(脉冲重复时间)为720 ms,TE时间(脉冲回波时间)为33.1 ms,1 200个时间点.本研究从明尼苏达大学和华盛顿大学数据库中挑选了前64个被试(32个男性,32个女性,年龄为22~36岁).
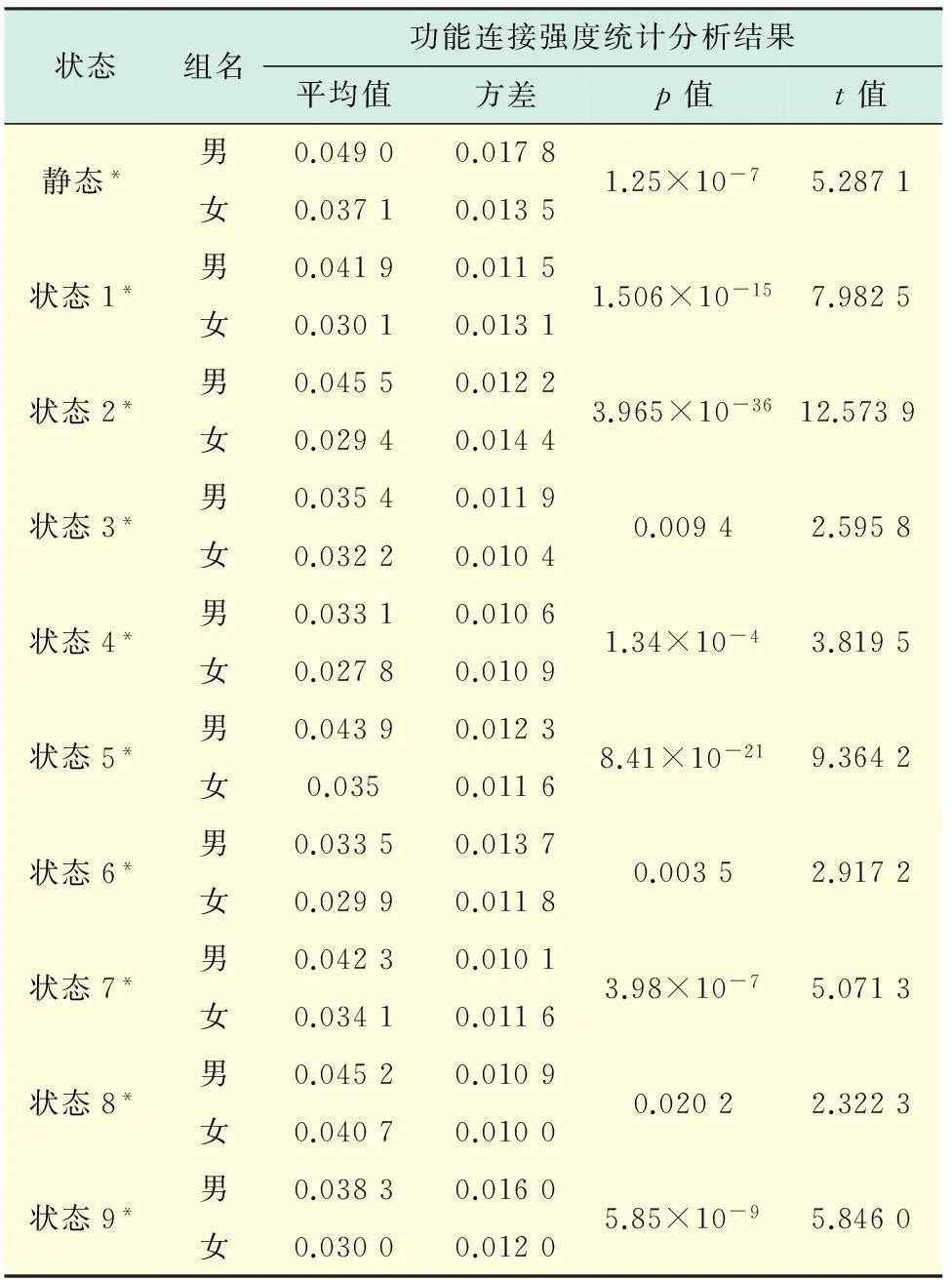
除了常规的基于体积的HCP预处理步骤(时间头动校正、多模态配准、标准空间变换、以独立成分为基础的FIX方法降噪和回归滋扰信号)[16-17]之外,还使用的预处理步骤包括:带通滤波(0.009 Hz 1.2研究流程图 使用滑动窗(sliding window,SW)的方法将整个时间序列内的丘脑和皮层信号分割成以窗为单位的丘脑和皮层信号,在每个窗宽内计算丘脑和皮层的连接矩阵,将男性和女性各自所包含的被试中各个窗宽内的丘脑和皮层的连接矩阵串连在一起作为输入,使用归一化图谱聚类算法(normalized spectral clustering)进行聚类,得到所有样本各个状态时的丘脑-皮层功能连接模式,然后回到男性和女性所包含的各被试中提取各个状态的丘脑、左侧皮层、右侧皮层的时间序列,并串连在一起计算男性和女性各个动态丘脑-皮层功能连接状态,将男性和女性基于个体的各个状态的丘脑-皮层功能连接状态模式进行独立样本t检验,如图1所示(见下页). 1.3感兴趣区域的确定 在MNI152标准空间上将每个半球的皮层感兴趣区域划分为5个,2个半球总共10个,所选定区域包括双边的:a.前额皮层(prefrontal cortex,PFC);b.前运动区皮层(premotor cortex,PMC)和运动区皮层(motor cortex,MC);c.体感皮层(somatosensory cortex,SC);d.顶叶皮层(parietal cortex,PC)、枕叶皮层(occipital cortex,OC);e.颞叶皮层(temporal cortex,TE)[4].丘脑区域(mask)是从牛津大学皮层下结构图谱(http:∥fsl.fmrib.ox.ac.uk/fsl/fslwiki/Atlases)中获得,并除去了一些进入脑室和白质的区域. 1.4动态功能连接 SW方法通常用来研究动态功能连接特性[18-19].在每个滑动窗宽内,对每个丘脑体素与同侧的每个皮层区域进行偏相关运算,生成了丘脑-皮层矩阵(左侧矩阵大小为1 057×5,右侧矩阵大小为1 049×5),并通过费舍尔转换变成Z-评分值,产生了丘脑-皮层功能连接矩阵(矩阵大小为2 106×5).在这里使用的偏相关分析方法[4]是用于衡量丘脑每个体素与每个皮层感兴趣区域的相关性,同时控制其余4个皮层区域对相关性的影响. 1.5滑动窗宽 动态连接分析的滑动窗宽值由网络运算中的模块化算法确定[20].基于丘脑-皮层的功能连接,先计算模块值Q*,再计算Q*方差值,以Q*方差值的截止点确定最优的滑动窗宽值.Q*的公式定义为 1.6时间尺度上的聚类 使用相似度准则方法估计丘脑-皮层连接模式的相似性[21].相似度准则方法是用于计算种子点位置之间的相关性,这种方法类似于计算组间方差,相似度值的取值范围是[0,1].两组变量的相似程度越高,该值越大,具体的公式为 图1 流程图 归一化的图谱聚类算法[22-23]是对相似性矩阵的归一化拉普拉斯特征向量进行降维,然后对降维后的特征向量进行聚类,产生丘脑-皮层的连接状态.归一化拉普拉斯矩阵定义为 式中:Li,j=D-Ai,j是拉普拉斯矩阵;D为图谱的度矩阵,它是指连接每个顶点的总边数;Ai,j是邻接矩阵,代表顶点i和顶点j的相似度. 在使用归一化的图谱聚类算法之前,聚类数目根据类内距离与类间距离之比的最小值确定.在确定群体功能连接状态后,返回到男性被试中,将对应状态的丘脑时间序列、左皮层时间序列和右皮层时间序列串连在一起计算男性群各个状态的丘脑-皮层功能连接状态.同样的方法适用于女性被试,最终确定女性群各个状态的丘脑-皮层功能连接状态.在男性和女性的各个动态功能连接状态中,采用“赢者全胜”(winner take all)的方法计算丘脑体素与5大皮层区域的最强功能连接,以此估计有多少个丘脑体素与前额叶皮层保持最强的功能连接. 马尔科夫链(Markov chain,MC)模型用于衡量不同状态之间的切换频率.MC模型的前提假设是下一状态的发生只与当前状态有关或者说是下一状态只受当前状态的影响,而与前一个状态无关. 1.7统计学处理 将男性和女性包含的各个被试对应的各个状态的丘脑-皮层连接矩阵各自串联在一起,采用Matlab软件(Matlab 2012b)先进行正态分布检验,然后进行独立样本t检验 (p<0.05),一共进行了9次两独立样本t检验.同样的方法适用于男性和女性的静态数据. 2结果 2.1滑动窗宽值的确定 根据模块值M方差值的截止点,确定最优的滑动窗宽值为52个时间点(37 s),如图2所示.根据各个窗宽内计算所得的Q*值,计算Q*的方差值.如图2(b)所示,随着窗宽值的增加,Q*减少,并在52时间点或是37 s时,出现了截止点. 图2 模块值Q*和Q*方差值 2.2男性和女性动态功能连接状态 根据类内距离与类间距离之比准则,并结合归一化图谱聚类算法,计算了所有样本的动态功能连接状态数为9,如图3(a)所示(见下页).并计算了所有样本静态和各个状态的丘脑-皮层的连接模式、各个状态的时间发生率、静态的丘脑-皮层连接模式和各个状态的丘脑-皮层连接模式的相关系数值,如图3(b)所示(见下页).男性9个状态的时间发生率分别为13%,12%,11%,11%,11%,11%,11%,10%,10%,如图3(c)所示;女性9个状态的时间发生率分别为13%,12%,10%,11%,11%,11%,11%,11%,10%,计算了男性和女性中有多少个丘脑体素与前额叶皮层保持最强的功能连接,男性分别是63%,22%,27%,11%,10%,65%,78%,82%,52%,女性分别是48%,13%,34%,11%,11%,21%,13%,80%,12%. 2.3男性和女性各状态之间的过渡率 状态之间的过渡率是指前一状态发生的情况下,下一状态发生的可能性.利用MC模型计算了男性和女性所包含的被试各自状态之间的过渡率,并进一步计算了平均过渡率,如图4所示(见下页).沿着对角线的白色方块代表停留在相同的状态.对于不在对角线上的其余元素,例如,图4(a)中状态7和状态2之间的棕黄色方块表示男性从状态2过渡到状态7存在很高的可能性.在图4(b)中状态5和状态3中的棕黄色方块之间的棕黄色方块表示女性从状态3过渡到状态5存在很高的可能性.另外,从图4中可看出,从其余状态过渡到状态4具有很低的可能性,结合图5(见下页)的男性和女性的时间发生率(呈下降趋势),可以推测男性和女性在状态4时是浅睡眠状态. 图3 丘脑-皮层连接模式 2.4不同性别丘脑-皮层的连接差异 男性和女性的动态丘脑-皮层连接模式的比较结果表明,在静态和所有的动态状态中,男性的丘脑-皮层连接显著高于女性的丘脑-皮层连接(pJ=1.25×10-7,tJ=5.287 1;p1=1.51×10-15,t1=7.98;p2=3.97×10-36,t2=12.57;p3=0.009 4,t3=2.60;p4=1.34×10-4,t4=3.819 5;p5=8.41×10-21,t5=9.36;p6=0.003 5,t6=2.92;p7=3.98×10-7,t7=5.07;p8=0.020 2,t8=2.32;p9=5.85×10-9,t9=5.85).其中,J表示静态,pk代表p值,tk代表t值,k=1,2,…,9. 图4 各状态之间的过渡率 图5 在状态4时的时间发生率 3讨论 与前人的全脑动态功能连接研究[24-26]相比,本文首次揭示了丘脑-皮层的动态功能连接模式,并且探究了不同的功能连接状态的性别差异.如下页表1所示. 将动态的丘脑-皮层连接结果与静态的丘脑-皮层连接结果相比较,发现了主状态(时间发生率最高,状态1)中的丘脑-皮层连接与静态的丘脑-皮层连接相关性很高.例如,男性在状态1中的连接模式与静态连接模式的相关系数值为0.79,女性在状态1中的连接模式与静态连接模式的相关系数值为0.53.与此同时,其余状态的功能连接模式并没有完全偏离静态模式,而是不同程度地偏离静态模式,这与前人的研究相吻合[27-28].例如,男性的其余状态(除主状态外)的丘脑-皮层的连接模式与静态连接模式相关系数值最低为0.36,女性的其余状态的丘脑-皮层的连接模式与静态连接模式相关系数值最低为0.39. 计算男性和女性在各个状态中有多少个丘脑体素与前额叶皮层存在最强功能连接后发现,男性最高为82%,女性最高为80%.男性所占的比例比女性所占的比例高,而且男性的平均比率(45.56%)比女性的平均比率(27%)要高.由于丘脑-前额皮层的功能连接主要参与判断、分析、思考及操作等方面的高级认知功能,所以,这一结果表明男性在这些方面比女性强,这与前人的研究相一致[13]. 表1男性和女性在静态和各个状态中丘脑-皮层 功能连接差异比较 Tab.1Gender difference in dynamic thalamo-cortical functional connections 状态组名功能连接强度统计分析结果平均值方差p值t值静态*男0.04900.0178女0.03710.01351.25×10-75.2871状态1*男0.04190.0115女0.03010.01311.506×10-157.9825状态2*男0.04550.0122女0.02940.01443.965×10-3612.5739 状态3*男0.03540.0119女0.03220.01040.00942.5958状态4*男0.03310.0106女0.02780.01091.34×10-43.8195状态5*男0.04390.0123女0.0350.01168.41×10-219.3642状态6*男0.03350.0137女0.02990.01180.00352.9172状态7*男0.04230.0101女0.03410.01163.98×10-75.0713状态8*男0.04520.0109女0.04070.01000.02022.3223状态9*男0.03830.0160女0.03000.01205.85×10-95.8460 * 通过独立样本t检验证明男性丘脑-皮层功能连接强度比女性丘脑-皮层功能连接强度显著高 从男性和女性的各状态之间的过渡率可以看出,男性从状态2过渡到状态7存在着很高的概率.男性在状态2中,丘脑与顶叶和枕叶皮层保持最强的功能连接关系;在状态7中,丘脑与前额叶皮层有最强的功能连接关系.说明男性主要从视觉功能过渡到判断、分析、思考及操作等功能.而男性在静态中,丘脑只与前额皮层有最强的功能连接关系,所以,动态研究除了包含静态分析提供的信息之外,还提供了静态所没有的信息.另外,还发现在男性和女性中,其余状态过渡到状态4的概率都很低.同时结合男性和女性在状态4时的时间发生率随着时间的增加呈下降趋势,有理由猜测状态4处于睡眠状态.因为,男性和女性的状态4 中,丘脑与顶叶和枕叶有最强功能连接关系,顶叶和枕叶皮层主要执行视觉功能,静息态扫描时被试没有特定的任务,随着扫描时间的增加,被试很容易处于浅度睡眠状态,视觉功能也逐渐下降. 将静态和各个动态功能连接状态时的男性和女性的丘脑-皮层功能连接进行独立样本t检验发现,在静态和所有的动态状态中,男性的丘脑-皮层功能连接强度均显著高于女性的.有研究表明,由于性激素在大脑早期发育过程中的影响,男性和女性丘脑-皮层功能连接发挥着不同的功能[29-30].已有学者利用fMRI技术发现,男性比女性在感觉、认知、运动和工作记忆任务的驱动下,会有更多的激活[10,12-13].丘脑作为神经信息传导的中继站,由体感皮层、运动皮层将感觉、运动信号反射到丘脑;由前额皮层将认知、决策信号投射到丘脑;也由顶叶皮层、枕叶皮层和颞叶皮层将学习信号传递到丘脑.本研究通过实证揭示了在9个功能连接状态中,男性的丘脑-皮层连接均比女性的显著强,这一结果与前人的研究结果[10,12-13]相一致.除此以外,与静态的结果相比,尤其在动态状态1,2,5,9时,男性的丘脑-皮层功能连接强度与女性的相比显著程度要高很多.说明不仅理论上确实存在着功能连接的动态变化特性,而且实验证明了功能连接的动态变化特性可以提供更全面的男性和女性丘脑和皮层的连接模式的差异特性. 本研究的不足在于根据丘脑-皮层连接关系选择了10大皮层区域(2个半球),更精细的皮层区域会提供更好的功能分辨率. 目前的研究没有采用更多的皮层划分区域,如解剖脑图谱,主要是因为采用了偏相关系数方法,考虑到每个窗宽只有52个时间点,皮层区域的数量需要小于6以确保每次回归10个以上的时间点. 总之,基于本研究发现的丘脑-皮层的动态特性和性别差异,以后进行正常人或是病人的研究时,需要考虑其动态特性和性别的影响. 参考文献: [1]Johansen-Berg H,Behrens T E,Sillery E,et al.Functional-anatomical validation and individual variation of diffusion tractography-based segmentation of the human thalamus[J].Cerebral Cortex,2005,15(1):31-39. [2]Schultz T.Segmenting thalamic nuclei: what can we gain from HARDI? medical image computing and computer-assisted intervention-MICCAI[J].2011,14(2):141-148. [3]Kim D J,Park B,Park H J.Functional connectivity-based identification of subdivisions of the basal ganglia and thalamus using multilevel independent component analysis of resting state Fmri[J].Human Brain Mapping,2013,34(6):1371-1385. [4]Zhang D Y,Snyder A Z,Shimony J S,et al.Noninvasive functional and structural connectivity mapping of the human thalamocortical system[J].Cerebral Cortex,2010,20(5):1187-1194. [5]Cole D M,Smith S M,Beckmann C F.Advances and pitfalls in the analysis and interpretation of resting-state fMRI data[J].Frontiers in Systems Neuroscience,2010,4(4):8. [6]Chang C,Glover G H.Time-frequency dynamics of resting-state brain connectivity measured with fMRI[J].Neuroimage,2010,50(1):81-98. [7]Xu X,Wang Q,Zhang M.Age,gender,and hemispheric differences in iron deposition in the human brain: an in vivo MRI study[J].Neuroimage,2008,40(1):35-42. [8]Pal D,Trivedi R,Saksena S,et al.Quantification of age-and gender-related changes in diffusion tensor imaging indices in deep grey matter of the normal human brain[J].J Clin Neurosci,2011,18(2):193-196. [9]Menzler K,Belke M,Wehrmann E,et al.Men and women are different: diffusion tensor imaging reveals sexual dimorphism in the microstructure of the thalamus,corpus callosum and cingulum[J].Neuroimage,2011,54(4):2557-2562. [10]Schienle A,Schäfer A,Stark R,et al.Gender differences in the processing of disgust-and fear-inducing pictures: an fMRI study[J].Neuroreport,2005,16(3):277-280. [11]Shirao N,Okamoto Y,Mantani T,et al.Gender differences in brain activity generated by unpleasant word stimuli concerning body image: an fMRI study[J].The British Journal of Psychiatry,2005,186(1):48-53. [12]Cowan R L,Rainey M,Levin J M,et al.Sex differences in response to red and blue light in human primary visual cortex: a bold fMRI study.Psychiatry research[J].Neuroimaging,2000,100(3):129-138. [13]Bell E C,Willson M C,Wilman A H,et al.Males and females differ in brain activation during cognitive tasks[J].Neuroimage,2006,30(2):529-538. [14]Goldstein J M,Jerram M,Poldrack R,et al.Sex differences in prefrontal cortical brain activity during fMRI of auditory verbal working memory[J].Neuropsychology,2005,19(4):509. [15]van Essen D C,Ugurbil K,Auerbach E,et al.The Human Connectome Project: a data acquisition perspective[J].Neuroimage,2012,62(4):2222-2231. [16]Glasser M F,Sotiropoulos S N,Wilson J A,et al.The minimal preprocessing pipelines for the human connectome project[J].Neuroimage,2013,80(20):105-124. [17]Salimi-Khorshidi G,Douaud G,Beckmann C F,et al.Automatic denoising of functional MRI data: combining independent component analysis and hierarchical fusion of classifiers[J].Neuroimage,2014,90:449-468. [18]Allen E A,Damaraju E,Plis S M,et al.Tracking whole-brain connectivity dynamics in the resting state[J].Cereb Cortex,2014,24(3):663-676. [19]Handwerker D A,Roopchansingh V,Gonzalez-Castillo J,et al.Periodic changes in fMRI connectivity[J].Neuroimage,2012,63(3):1712-1719. [20]Rubinov M,Sporns O.Weight-conserving characterization of complex functional brain networks[J].Neuroimage,2011,56(4):2068-2079. [21]Cohen A L,Fair D A,Dosenbach N U,et al.Defining functional areas in individual human brains using resting functional connectivity MRI[J].Neuroimage,2008,41(1):45-57. [22]Craddock R C,James G A,Holtzheimer P E,et al.A whole brain fMRI atlas generated via spatially constrained spectral clustering[J].Hum Brain Mapp,2012,33(8):1914-1928. [23]Ng A Y,Jordan M I,Weiss Y.On spectral clustering: analysis and an algorithm[J].Adv Neural Inf Process Syst,2002,14:849-856. [24]Hutchison R M,Womelsdorf T,Allen E A,et al.Dynamic functional connectivity: promise,issues and interpretations[J].Neuroimage,2013,80(1):360-378. [25]Jones D,Vemuri P,Murphy M,et al.Nonstationarity in the ‘resting brain’s’ modular architecture[J].Alzheimer’s and Dementia,2012,8(4S):689-703. [26]Kiviniemi V,Vire T,Remes J,et al.A sliding time-window ICA reveals spatial variability of the default mode network in time[J].Brain Connectivity,2011,1(4):339-347. [27]Allen E A,Damaraju E,Plis S M,et al.Tracking whole-brain connectivity dynamics in the resting state[J].Cereb Cortex,2014,24(3):663-676. [28]Deco G,Jirsa V,Friston K J.The dynamical and structural basis of brain activity[J].Principles of Brain Dynamics: Global State Interactions,2012,36(5):201-206. [29]Geary D C,Saults S J,Liu F,et al.Sex differences in spatial cognition,computational fluency,and arithmetical reasoning[J].J Exp Child Psychol,2000,77(4):337-353. [30]Postma A,Jager G,Kessels R P,et al.Sex differences for selective forms of spatial memory[J].Brain and Cognition,2004,54(1):24-34. (编辑:石瑛) Gender Difference in Dynamic Thalamo-Cortical Functional Connections JI Bing1,2,ZHANG Renjie1,ZHANG Jiuquan3,NIE Shengdong2 (1.School of Opitical-Electrical and Computer Engineering,University of Shanghai for Science and Technology,Shanghai 200093,China; 2.Institute of Medical Imaging Engineering,University of Shanghai for Science and Technology,Shanghai 200093,China; 3.Department of Radiology,Southwest Hospital,Third Military Medical University,Chongqing 400038,China) Abstract:The dynamic variation of thalamo-cortical functional connections was explicitly exploited to identify gender-specific dynamic states and statistical analysis was performed to examine the influense of gender factor on dynamic thalamo-cortical functional connectivity patterns by statistic analysis.The results reveal that for each of 9 gender-specific thalamo-cortical connectivity states,the strength of functional connectivity in men is significantly higher than that in women.These results extend our understanding of thalamo-cortical connectivity and demonstrate the gender difference in dynamic thalamo-cortical functional connections. Keywords :thalamus; functional connectivity; dynamic nature; gender difference 中图分类号:TK 81 文献标志码:A 通信作者:聂生东(1962-),男,教授.研究方向:医学图像处理与分析.E-mail:nsd4647@163.com 基金项目:国家自然科学基金资助项目(60972122);上海市自然科学基金资助项目(14ZR1427900) 收稿日期:2015-11-17 DOI:10.13255/j.cnki.jusst.2016.02.011 文章编号:1007-6735(2016)02-0160-08 第一作者: 季冰(1978-),女,博士研究生.研究方向:测试信号获取与处理.E-mail:jibing_usst@163.com