亚麻原麻及其粗纱生物酶处理工艺条件的优化
2016-06-01丁若垚郁崇文
郭 营, 丁若垚, 郁崇文
(1. 东华大学 纺织学院, 上海 201620; 2. 东华大学 生态纺织教育部重点实验室, 上海 201620;3. 东华大学 纺织面料技术教育部重点实验室, 上海 201620)
亚麻原麻及其粗纱生物酶处理工艺条件的优化
郭 营1,2,3, 丁若垚1,2, 郁崇文1,3
(1. 东华大学 纺织学院, 上海 201620; 2. 东华大学 生态纺织教育部重点实验室, 上海 201620;3. 东华大学 纺织面料技术教育部重点实验室, 上海 201620)
以亚麻打成麻及其粗纱为研究对象,以质量损失率、强度和细度(分裂度)作为评定标准,对生物酶处理工艺进行了研究。结果表明:在pH值为4的柠檬酸-柠檬酸钠缓冲溶液中,在40 ℃下,以180 r/min振荡处理4 h,果胶酶、木聚糖酶和甘露聚糖混合处理后的打成麻及粗纱的分裂度和强度最优,分裂度和细度分别为663 Nm和1.03 tex,强度分别为17.07、34.02 cN/tex,纤维强度均比化学方法处理后的高。采用扫描电镜、红外光谱对纤维上胶质的去除情况进行了分析,结果显示:酶处理后的麻纤维表面更加光滑;胶质含量下降。
亚麻; 果胶酶; 半纤维素酶; 打成麻; 亚麻粗纱
亚麻纤维是环保型纤维,具有独特的凉爽舒适性和吸湿透气性,被誉为植物纤维中的皇后[1]。在纺织生产中,亚麻脱胶一般是指亚麻粗纱的煮练,目的是去除部分黏结单纤维的非纤维素物质,使亚麻纤维分劈成具有可纺性能的亚麻工艺纤维。当前,亚麻粗纱的煮练一般分为碱煮、氧漂和氯漂等,但其煮练废液存在污染环境、不易降解、用水量大和高能耗等问题。
与传统的化学脱胶方法相比,亚麻生物脱胶方法具有条件温和,对纤维损伤少,环保无污染等优点,越来越多地用来替代化学方法。前人对微生物脱胶技术做了一定的探索工作,丁若垚[1]从海洋环境中筛选出了D3和D4 2株菌种,在其最优性能的发酵条件下制成发酵液,用于对粗纱脱胶,并对脱胶后的粗纱进行性能分析,结果表明,脱胶后纤维内部的果胶和半纤维素得到去除而木质素较难去除。纤维表面的化学组成变化不大,生物脱胶对纤维表面的处理较为柔和。郑磊等[2]探讨了假单胞菌DA10的发酵液用量、初始pH值、煮练温度等工艺条件对细菌煮练的影响,得到了该菌种在亚麻粗纱煮练中的最佳脱胶工艺参数,对亚麻快速生物脱胶技术进行初步探讨。目前生物脱胶技术被广泛应用于亚麻[3]、苎麻[4]、黄麻、红麻、大麻[5]等纤维的脱胶研究中。
微生物脱胶培养菌种步骤比较繁琐,对环境要求高,为缩短生产时间,本文主要研究了亚麻的生物酶脱胶处理工艺条件,酶脱胶被认为专一性强,与常规化学脱胶相比,脱胶制成率、纤维强力得到提高,大大改善了麻纤维的可纺性能,其制成的纱麻粒条干均匀,同时试验了亚麻打成麻与粗纱的生物酶脱胶工艺,前者为未来亚麻的精细化棉型化工艺进行了探索性研究,后者则对目前亚麻湿纺工艺的粗纱煮练提供了理论基础。此外,该脱胶加工中能耗减小,有利于环境保护。
1 材料与方法
1.1 材料和试剂
原料:亚麻打成麻,湖北精华纺织集团有限公司;亚麻粗纱,浙江金鹰集团有限公司,纤维线密度为1.23 tex,束纤维强度为34.87 cN/tex。
主要设备:YXQ-LS-50SI立式压力蒸汽灭菌锅(上海博讯实业有限公司医疗设备厂)、电热恒温鼓风干燥箱(黄石市恒丰医疗器械有限公司)、TF020型Sirolan-tensor束纤维强力仪(澳大利亚SIROLAN公司)、ATS-051 D/052D智能控制恒温摇床(上海堪鑫ChemStar仪器设备有限公司)、Y171C型纤维切断器(常州纺织仪器厂)、JN-B型精密扭力天平(量程10 mg,分度值0.02 mg)、FA系列电子天平(精度0.1 mg,上海方瑞仪器有限公司)、JSM-5600LV型扫描电子显微镜(JEOL公司)、HHS-8型电热恒温水浴锅(上海天平仪器厂)、Y801A型恒温烘箱(工作温度50~150 ℃,常州纺织仪器厂)、NEXUS-670型FTIR-Raman光谱仪(美国Nicolet公司)、D/Max-2550PC型X-射线衍射仪(日本RIGAKU公司) 。
试验试剂:纤维素酶(江苏锐阳生物科技有限公司),β-葡聚糖酶、甘露聚糖酶、果胶酶、木聚糖酶(江苏锐阳生物科技有限公司),乙酸、乙酸钠、柠檬酸、柠檬酸钠、磷酸二氢钠、NaOH(分析纯,AR级,国药集团化学试剂有限公司),H2O2(上海金鹿化工有限公司),三聚磷酸钠(国药集团化学试剂有限公司)。
1.2 试验方法
1.2.1 酶活性测定
采用DNS法[6]测定甘露聚糖酶、果胶酶、β-葡聚糖酶、木聚糖酶和纤维素酶的活性。
酶活力单位定义:在酶反应特定温度(25 ℃,其他为最适条件)下,每小时水解底物产生1 mg单糖所需的酶量,即为1个酶活力单位,用U/g表示。即:
式中:U为酶活力单位,U/g;G为酶解液中还原性醛基含量,mg;N为酶液稀释倍数;V为加酶液量,mL;t为酶解时间,h。试验测得纤维素酶(固体)酶活50 000 U/g,甘露聚糖酶酶活≥60 000 U/g,果胶酶酶活100 000 U/g,木聚糖酶酶活≥50 000 U/g,β-葡聚糖酶(固体)≥90 000 U/g。
1.2.2 酶法亚麻煮练流程
酶法亚麻煮练流程为:配制缓冲溶液→缓冲溶液湿热灭菌→亚麻打成麻/粗纱5.00 g→烘干至质量恒定→麻和缓冲溶液共同湿热灭菌→调节pH值→加酶→煮练→烘干至质量恒定。
流程说明:烘干温度为105 ℃,时间为2 h。缓冲溶液配制:分别配制0.05 mol/L柠檬酸-柠檬酸钠缓冲溶液、乙酸-乙酸钠0.1 mol/L;在室温下麻与缓冲溶液的浴比为1∶40。调节pH值至5,乙酸-乙酸钠缓冲溶液采用乙酸调节、柠檬酸-柠檬酸钠缓冲溶液采用柠檬酸调节。煮练的pH 值为4~5,于40 ℃下180 r/min振荡处理4 h。湿热灭菌,温度121 ℃,时间20 min,压强0.11 MPa。
1.3 煮练效果评价方法
1.3.1 纤维细度测定
采用中段切断称重法[7]测试纤维细度。先用纤维切断器切取20 mm长度的纤维,再用精密扭力天平对20 mm纤维进行称量,控制其质量在7.5~8.3 mg之间,最后计数。纤维计数方法如下:不分裂的或分裂不满10 mm的纤维计为1根,分裂达到10 mm以上的纤维按其分裂数计。称量后的纤维质量折算成公定质量(按公定回潮率12%计算)。测试3次,取其平均值。
1.3.2 单纤维强力测定
试样测试前在标准大气条件下平衡24 h。每个试样测试50次,取其平均值。
1.3.3 纤维质量损失率测定
纤维质量损失率G的计算方式如下。
式中:G1为煮练前纤维的干态质量,g;G2为煮练后纤维的干态质量,g。
1.3.4 傅里叶红外光谱测试
在干燥条件下,分别将亚麻打成麻、化学脱胶后亚麻、生物脱胶后的亚麻纤维混合均匀,研磨并压片。在NEXUS-670型FTIR-Raman光谱仪上进行红外光谱测试。
1.3.5 纤维广角X射线衍射测试
将打成麻、化学脱胶后亚麻、生物脱胶后的亚麻纤维在干燥条件下混合均匀后研磨。在日本RIGAKU公司D/Max-2550PC型号的X射线衍射仪上进行测定。
1.3.6 形貌观察
采用DXS-10A普及型智能化扫描电子显微镜观察纤维形貌。
2 结果与分析
2.1 单种酶处理亚麻打成麻
采用纤维素酶、β-葡聚糖酶、果胶酶、甘露聚糖酶、木聚糖酶分别对亚麻打成麻处理,文献[8-9]认为,纤维素酶和β-葡聚糖酶在pH值为5左右的醋酸-醋酸钠缓冲溶液中活性较好;文献[10-12]认为,果胶酶、甘露聚糖酶、木聚糖酶在pH值为4左右的柠檬酸-柠檬酸钠缓冲溶液中活性最好。煮练流程如上文所述,每种酶的质量为麻质量的5%,每种酶处理2个平行样,同时采用不加酶的缓冲溶液作空白对照,测得的质量损失率,取其平均值,平均质量损失率如表1所示。

表1 不同生物酶处理打成麻Tab.1 Treatment of Scotched flax by different enzyme
由表1 可知,纤维素酶和β-葡聚糖酶处理纤维损失较大,木聚糖酶、果胶酶与甘露聚糖酶有一定效果。
2.2 混合酶处理亚麻打成麻
在探讨单一酶处理打成麻的基础上,继续探讨木聚糖酶与另2种在相同pH值时酶活较高的果胶酶和甘露聚糖酶分别混合后处理打成麻,果胶酶和甘露聚糖酶的质量分数为5%,木聚糖酶的质量为麻质量分数的3%,处理时选取一个不加酶的缓冲溶液作空白对照。每样混合酶处理2组平行样,测得质量损失率如表2所示。由表可知,木聚糖酶在处理中起主要作用。

表2 不同混合酶处理亚麻打成麻Tab.2 Treatment of scotched flax by different mixing enzymes
2.3 打成麻生物酶煮练与化学煮练对比
将生物酶煮练与化学煮练对比。碱处理工艺:NaOH质量分数为5%~8%,三聚磷酸钠质量分数2%,100 ℃下水浴处理2 h; H2O2处理工艺:H2O2质量分数为3%~4%,NaOH质量分数为1%~2%,三聚磷酸钠质量分数为2%,80 ℃下水浴处理2 h,处理时选取2组平行样。5~8号中果胶酶和甘露聚糖酶的质量分别为麻质量的5%,9~10号中3种酶的质量分别为麻质量的3%,测得不同处理工艺下的亚麻分裂度和单纤强力,如表3所示。

表3 不同处理工艺下的纤维性能Tab.3 Fiber properties under different treatment processes
由表3可知,酶处理具有一定脱胶效果,接近化学脱胶效果。酶脱胶和化学脱胶后,酶脱胶后的强度接近化学脱胶后的强度。
2.4 粗纱生物酶煮练与化学煮练对比
因打成麻纤维强力下降过大,本文试验探讨了粗纱纤维的强度和细度,处理步骤同上,测得纤维性能如表4所示。
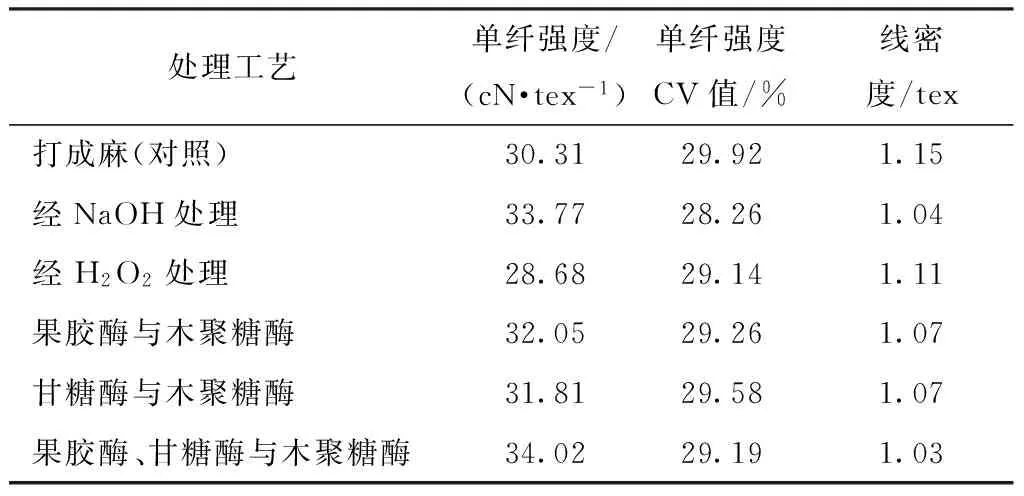
表4 不同处理工艺下的粗纱纤维性能Tab.4 Flax roving fiber properties under different treatment processes
由表4可知,酶脱胶的强度接近化学脱胶的强度,三酶混合处理纤维的强度高于化学脱胶处理纤维的强度。
2.5 微观测试分析
2.5.1 傅里叶红外光谱分析

注:1—亚麻打成麻; 2—化学处理后的亚麻; 3—生物处理后的亚麻。图1 化学脱胶与生物脱胶后的打成麻红外光谱图Fig.1 FT-IR spectra of untreated and treated flax
在NEXUS-670型FTIR-Raman光谱仪上进行红外光谱测试,测试结果如图1所示。由图可看出生物处理后的亚麻粗纱在1 158 cm-1处吸收峰无变化,而1 158 cm-1处吸收峰分别为β-d-葡萄糖甙键、C—O—C的特征吸收峰。这说明在生物处理过程中纤维素没有明显的改变和破坏。可看出,峰值在1 640 cm-1处的吸收峰有所减弱,其他特征峰无太大变化,而1 640 cm-1处为果胶的特征峰,说明生物处理后,果胶的含量有所降低,使胶质结构不再紧密,胶黏现象减弱,胶质去除较多。
2.5.2 纤维广角X射线衍射分析
将打成麻、化学脱胶后亚麻、生物脱胶后的亚麻纤维在干燥条件下混合均匀并研磨。在D/Max-2550PC型X射线衍射仪上进行测定,打成麻经物理和化学方法脱胶工艺处理后亚麻纤维的X射线衍射曲线如图2所示。

图2 化学脱胶和生物脱胶前后亚麻纤维的X射线衍射图Fig.2 X-ray diffraction diagrams of untreated and treated flax
由图可发现,物理和化学方法脱胶后亚麻纤维衍射强度曲线的图形并没有改变,一定程度上说明了在2种脱胶过程中纤维素的晶形是稳定的。衍射强度的不同反映出结晶程度不同,显然,经过生物脱胶处理后亚麻纤维具有更高的分辨率,纤维在22.94°处的衍射峰更为尖锐。
结晶度的计算结果表明,打成麻结晶度为59.33%,化学方法脱胶后结晶度为63.25%,生物脱胶后结晶度为64.86%,这是因为在脱胶工艺中生物方法对纤维素损伤小,因此生物方法脱胶后纤维的结晶度最大。
2.5.3 形貌分析
每种纤维取5~10根,镀金属导电膜,然后放在JSM-5600LV型扫描电子显微镜中观察,结果如图3所示。

图3 亚麻纤维的电镜照片(×3 000)Fig.3 SEM images of flax fibers (×3 000). (a) Fibers in untreated flax; (b) Treated by chemistry degumming process; (c) Treated by enzyme degumming process
试验选取了打成麻、化学处理后的亚麻纤维和生物处理后的亚麻纤维分别进行扫描电子显微镜观察。将处理前后的纤维照片作对比,图3(a)中打成麻表面含有大量的胶质等非纤维素物质,纤维表面较粗糙,不光滑,不平整。图3(b)中,经化学处理后,亚麻纤维表面胶质得到部分去除,纤维表面不完全光滑。图3(c)中经生物处理后的亚麻纤维,其表面更光滑,更清晰。这表明生物处理过程中纤维表面非纤维素胶质去除得比较多。
3 结 语
果胶酶-木聚糖酶混合酶、甘糖酶-木聚糖酶混合酶分别处理亚麻后的质量损失率均比果胶酶-甘露聚糖酶混合酶的质量损失率高;亚麻打成麻生物处理后强度接近化学处理后的强度;亚麻粗纱经果胶酶、甘露聚糖酶和木聚糖酶3种酶混合处理后纤维的强度高于化学处理后纤维的强度。
红外光谱分析表明,在1 640 cm-1处的吸收峰有所减弱,此处为果胶的特征峰,说明经过生物处理后的纤维中果胶含量下降。纤维广角X射线衍射测试显示,生物方法处理纤维后纤维结晶度增加,这是因为生物脱胶后亚麻纤维的无定形区减少,纤维素的体密度增加,因此生物方法脱胶后纤维的结晶度最大。
[1] 丁若垚. 亚麻粗纱脱胶微生物的选育与应用[D]. 上海:东华大学, 2013:3-5. DING Ruoyao. Selection and application of microorganism for scouring of flax roving [D]. Shanghai: Donghua University, 2013:3-5.
[2] 郑磊, 丁若垚, 郁崇文. 脱胶细菌在亚麻粗纱煮练中的初步应用[J].纺织学报,2012, 33(8): 66-70. ZHENG Lei, DING Ruoyao, YU Chongwen. Preliminary application of degumming bacterium in scouring of flax roves[J]. Journal of Textile Research, 2012, 33(8): 66-70.
[3] 彭源德, 刘正初, 金关荣, 等. 亚麻快速生物脱胶技术工厂化生产研究[J].中国农业科学, 2005, 38(4): 849-853. PENG Yuande, LIU Zhengchu, JIN Guanrong, et al.Study on technique of fast microbial retting of flax[J].Scientia Agricultura Sinica, 2005, 38(4): 849 - 853.
[4] BASUS, SAHAMN. Large-scale degumming of ramie fibre using a newly isolated Bacillus pumilus DKSl with high pectatelyase activity [J]. Journal of lndustrial Microbiology & Biotechnology, 2009,36 (2):239-245.
[5] 彭源德,唐守伟,杨喜爱, 等. 大麻快速脱胶菌株的选育与脱胶性能鉴定[J].纺织学报, 2007, 28(12):66-68. PENG Yuande, TANG Shouwei, YANG Xiai, et al.Breeding of a fast retting bacterium and appraisal of retting function in hemp[J].Journal of Textile Research,2007, 28(12): 66 - 68.
[6] 王清吉, 尹西竹, 刘永举,等. DNS法测定饲用木聚糖活力[J]. 兽药与饲料添加剂, 2000(5):10.
WANG Qingji, YIN Xizhu, LIU Yongju, et al. DNS assay feeding xylanase activity[J]. Veterinary Pharmaceuticals & Feed Additives, 2000(5):10.
[7] 董政娥,丁若垚,郑磊,等.亚麻粗纱细菌煮练工艺优化探讨[J]. 毛纺科技, 2013(3):42-46.
[8] 刘幸乐,姚继明,吴远明. 酸的种类、pH和温度对酸性纤维素酶活力的影响[J]. 印染助剂, 2012(12):11-14.
LIU Xingle, YAO Jiming,WU Yuanming. Effects of acids, pH and temperature on acid cellulase activity[J]. Textile Auxiliaries, 2012(12):11-14.
[9] 魏有霞, 韩增祥. 酶制剂活性的测定及稳定性的研究[J]. 饲料工业, 2006(24):46-48.
WEI Youxia, HAN Zengxiang. The estimation of active and study of stability on enzyme preparation[J]. Feed Industry, 2006(24):46-48.
[10] 杨辉, 张娟, 王旭. 果胶酶活力测定中酶活力与稀释倍数的研究[J]. 食品研究与开发, 2006(9):96-98.
YANG Hui, ZHANG Juan, WANG Xu. Study on the relationship between the activity of rectinase and the dilution ratio in pectinase assays[J].Food Research and Developent,2006(9):96-98.
[11] 李长影, 孔雯, 王家昕,等. β甘露聚糖酶产生菌的分离鉴定和酶学性质[J]. 华中农业大学学报, 2011(2):138-142.
LI Changying, KONG Wen, WANG Jiaxin, et al. Isolation identification and enzymatic characterization of β-mannanase producing strain[J]. Journal of Huazhong Agricultural University, 2011(2) :138-142.
[12] 聂国兴, 李春喜, 张建新,等. 底物浓度、DNS量对木聚糖酶活性测定结果的影响[J]. 饲料工业,2002(11):24-25.
NIE Guoxing, LI Chunxi, ZHANG Jianxin, et al.The effects of substrate concentration and DNS on the activity of xylanase[J]. Feed Industry, 2002(11):24-25.
Optimizing of enzyme treatment process conditions of scotched flax and flax roving
GUO Ying1,2,3, DING Ruoyao1,2, YU Chongwen1,3
(1.CollegeofTextiles,DonghuaUniversity,Shanghai201620,China; 2.KeyLaboratoryofScience&TechnologyofEco-Textile,MinistryofEducation,DonghuaUniversity,Shanghai201620,China; 3.KeyLaboratoryofTextileScience&Technology,MinistryofEducation,DonghuaUniversity,Shanghai201620,China)
This study aims at scotched flax and flax roving, besides, the weight loss, strength and the degree of fiber splitting as a measure of the standard for different enzyme treatment process. Under the conditions of the enzyme treatment: pH 4.0, 0.1 mol/L of citric acid-sodium citrate buffer, 40 ℃ and 180 r/min with shock treatment ,4 h. The results suggested that the tenacity and fineness of fiber after using mixing enzymes are 663 Nm and 1.03 tex, respectively, and the strength is 17.07 cN/tex and 34.02 cN/tex, respectively, which are higher than the conventional scouring process. In addition, scanning electron microscopy (SEM)and FT-IR spectroscopy were used to evaluate the removal of gummy materials on the fiber bundles. SEM results showed that the surface of hemp fiber is much smoother by the enzyme treatment; and the FT-IR spectroscopic results suggested the gum decreased.
flax; pectinase; hemicellulase; scotched flax; flax roving
10.13475/j.fzxb.20150104106
2015-01-20
2015-08-05
中国博士后科学基金面上资助项目(2014M561386);国家麻类产业技术体系建设专项资金资助项目(CARS-19);东华大学中央高校基本科研业务费专项资金项目(15D110144)
郭营(1990—),女,硕士生。研究方向为亚麻纤维生物脱胶技术。郁崇文,通信作者,E-mail:yucw@dhu.edu.com。
TS 102.221
A
