髓源抑制性细胞与肾脏疾病
2016-06-01徐孝东综述鲍浩审校
徐孝东 综述 鲍浩 审校
髓源抑制性细胞与肾脏疾病
徐孝东 综述 鲍浩 审校
髓源抑制性细胞(MDSCs)是一类未成熟且具有免疫负调控作用的髓系细胞群体,在维持机体免疫平衡和慢性肾脏病的发生发展中起重要作用。MDSCs为一群异质性的细胞群体,对其细胞表型和作用机制目前并未完全阐明,本文就MDSCs的来源、表型鉴定及在肾脏疾病中的作用做一综述。
髓源抑制性细胞肾脏疾病
髓源抑制性细胞(MDSCs)是近年发现的一类具有负向免疫调控效应的细胞群体,主要由髓系祖细胞及巨噬细胞、粒细胞和树突状细胞的前体细胞组成[1]。正常人骨髓产生的未成熟髓样细胞分化为成熟的粒细胞、巨噬细胞或树突状细胞;在病理状态如肿瘤、炎症、感染、器官移植或自身免疫性疾病,未成熟的髓样细胞分化受阻,出现异常增殖和活化,形成MDSCs。MDSCs可抑制机体正常的免疫功能,参与免疫逃逸、免疫耐受、炎症反应等过程。本文就MDSCs的来源、表型鉴定及在肾脏疾病中的作用作一综述。
MDSCs来源及表型鉴定
在生理情况下,鼠源性MDSCs占骨髓细胞的20%~30%,脾脏细胞的2%~4%,外周血的2%~4%,胰腺的1%~2%,在淋巴结中的含量<1%[2]。肿瘤组织中可见大量MDSCs浸润,但所占比例与数量因肿瘤类型而异,且与肿瘤组织大小及进展有关。MDSCs不仅在肿瘤中有免疫调控作用,而且在细菌或寄生虫感染、急慢性炎症、外伤和器官移植等病理状态具有免疫调节作用。MDSCs在生理条件下呈现非激活状态,而肿瘤微环境中的炎症反应或非肿瘤的慢性炎症反应使MDSCs募集并活化[3],在生理应激条件下,未成熟髓系细胞会短暂扩增,然后迅速分化成熟[4]。虽然这群细胞具有MDSCs的负向免疫调控功能,但由于存在时间短,对免疫应答的影响程度很低。而在肿瘤或慢性感染等病理情况下,机体产生的细胞因子如白细胞介素1β(IL-1β)、IL-4、IL-10、血管内皮生长因子(VEGF)、转化生长因子β(TGF-β)等,以联合和剂量依赖的形式诱导MDSCs活化并产生显著的负向免疫调控作用。MDSCs是一类异质性细胞群体,其异质性主要源于细胞标志的表达模式。
鼠源性MDSCs细胞表型的鉴定鼠源性MDSCs的研究始于1990年,在研究治疗性抗肿瘤疫苗时发现伴随着CD11b+Gr1+细胞的累积,其CD8+T细胞功能在体内外受到一定的抑制。随后的研究发现这类细胞缺乏成熟的髓系细胞相关标志分子[5]。
鼠源性MDSCs被定义为Gr-1+CD11b+,多项研究表明,在不同小鼠肿瘤模型中MDSCs的Gr-1蛋白表达水平有所差异,根据Gr-1蛋白表达量不同可将MDSCs进一步分为Gr-1int单核系MDSCs(Mo-MDSCs)和Gr-1high粒系MDSCs(PMN-MDSCs)[1]。然而,在肿瘤组织和骨髓中,仅根据Gr-1蛋白表达量差异并不能完全将Mo-MDSCs和PMN-MDSCs区分开,因为Gr-1蛋白分子的表达是一个连续过程,并没有明显的强弱表达界限。后续研究发现,根据与Gr-1分子不同表位(Ly-6G与Ly6C)的抗体特异性结合位点的不同又可进一步将MDSCs表型鉴定为CD11b+Ly-6G+Ly6ClowSSChig的PMN-MDSCs和CD11b+Ly-6GLy6ChighSSClow的Mo-MDSCs。与PMN-MDSCs相比,Mo-MDSCs不仅表达CD11b+Ly-6G-Ly6Chigh,而且还高表达单核细胞标志分子F4/80、ICAM-1和CCR2等[6]。尽管CD11b和Ly-6被认为是鼠源性MDSCs的标志分子,但该观点尚存在争议。有研究报道,在荷瘤小鼠体内注射Ly6G单抗后并不能有效去除MDSCs,原因是因为Gr-1标记分子除在MDSCs表面表达之外,在正常细胞上也有相应表达[6]。
人源性MDSCs细胞表型的鉴定Pak等[7]首次在头颈部肿瘤患者体内发现并描述了人源性MDSCs,随后在鳞状上皮癌、小细胞性肺癌、肝细胞癌、肾癌、膀胱癌、多发性骨髓瘤、慢性淋巴细胞白血病和恶性胶质瘤患者体内也观察到MDSCs的存在[8-10]。这类细胞大多表达CD34和CD33分子,而低表达或不表达HLA-DR及CD86、CD40等共刺激分子[8]。MDSCs另一个特征性标志分子为IL-4R (CD124),其可在黑色素瘤和结肠癌患者体内的CD14+单核系和CD15+的粒系细胞表面表达。此外,吲哚胺2,3-双加氧酶(IDO)是细胞内调节色氨酸代谢和抗肿瘤免疫调节通路的关键酶[11],在CLL、自体造血干细胞移植患者的CD14+HLA-DRlow/-细胞中表达上调。黑色素瘤患者体内程序性死亡配体1(PDL1)水平与HLA-DR的表达呈负相关,慢性淋巴细胞白血病(CLL)患者体内Mo-MDSC细胞表面PD-L1显著上调[9]。因此,IDO和PD-L1或许可作为鉴定CD14+HLA-DRlow/-MDSCs的标志分子。然而,IDO为胞内表达,用它作为抗原标志不仅会导致分析过程复杂,而且很难选择合适的抗IDO单克隆抗体对其进行标记。其次,使用抗IDO或PD-L1单克隆抗体并不能有效降低MDSCs对T细胞的免疫抑制功能,因此利用IDO和PD-L1作为鉴定MDSCs的标志分子的合理性还需要实验来进行验证。在乳腺癌患者中MDSCs亚群的分子标志为Lineage-HLA-DR-CD33+CD11b+[10],而如何选择合适的Lineage系抗体则尤为重要,不同研究使用的Lineage抗体不同,但多数研究都会选择CD3、CD19和CD56抗体来排除成熟淋巴细胞的干扰[9-10,12],而部分研究会增加CD14和CD16抗体来排除单核细胞和粒细胞的干扰[12]。
针对MDSCs研究尽管已有20多年,但由于缺乏特异性标记分子,加之MDSCs在不同疾病或微环境中表达相异的抗原,导致人源性MDSCs表型至今没有统一认识。为阐明不同疾病或组织中MDSCs表型鉴定及使用情况,我们通过文献检索对其进行归纳(表1)。

在不同疾病中MDSCs表型情况[8,12-13]
MDSCs负向免疫调控机制
MDSCs具有抑制机体免疫应答的功能,可参与免疫逃逸、免疫耐受、炎症反应等过程。MDSCs主要通过以下机制发挥负向免疫调控。
诱导调节性T细胞(Tregs)扩增和活化研究发现,不同MDSCs亚群不仅可促进Tregs扩增,还可诱导初始CD4+T细胞向Tregs转变。研究认为这一现象与细胞-细胞间接触(包括CD40-CD40L结合)和MDSCs所分泌的细胞因子(如IFN-γ,IL-10和TGF-β等)有关[14]。例如人源性CD14+HLADRlow/-MDSCs可通过分泌TGF-β和视黄酸诱导Th17细胞向Tregs转分化[15]。在不同肿瘤小鼠模型中也发现,不同细胞因子或分子对MDSCs诱导Treg扩增的作用机制不同。例如在卵巢癌小鼠模型中,MDSCs诱导Treg扩增需依赖细胞毒性T细胞抗原4(CTLA4)的表达[16],而在淋巴瘤小鼠模型中,MDSCs通过上调ARG1来诱导Tregs扩增[17]。尽管如此,也有研究人为MDSCs与Tregs之间并无直接联系。如Movahedi等[18]发现在肿瘤生长过程中,Tregs比例并不随MDSCs水平而发生变化,提示MDSCs可能并不参与介导Tregs的扩增。Dugast等[19]也在大鼠肾移植免疫耐受模型中发现MDSCs并不能显著诱导Tregs扩增。因此,MDSCs诱导Tregs作用机理方面仍需进一步研究。
消耗淋巴细胞所需营养物质L-精氨酸为机体非必需氨基酸,是诱导性一氧化氮合成酶(iNOS)和精氨酸酶1(ARG1)的催化底物。MDSCs可高表达iNOS和ARG1,从而大量消耗微环境中的L-精氨酸[20]。L-精氨酸为体内T细胞表面TCRζ链合成的必需物质,微环境中L-精氨酸的大量消耗不仅会导致TCRζ链合成受阻,而且还会抑制Cyclin D3和细胞周期蛋白依赖性激酶4(CDK4)的表达,最终抑制T淋巴细胞的增殖。不仅如此,L-精氨酸的大量消耗还会导致T细胞分泌细胞因子的能力下降(如IFN-γ和IL-5)[21]。半胱氨酸为T细胞激活所必需的氨基酸,但T细胞内不仅缺乏将甲硫氨酸转化为半胱氨酸的胱硫醚酶,而且还缺乏将胞外胱氨酸转运至胞内并还原成半胱氨酸的Xc转运蛋白。因此,T细胞激活必须依赖巨噬细胞或DC等抗原提呈细胞所输出的半胱氨酸,以维持T细胞的正常活动。MDSCs不表达胱硫醚酶,但能表达Xc转运蛋白将胞外的胱氨酸转运到胞内并还原成半胱氨酸,由于MDSCs同时缺乏中性氨基酸转运蛋白的表达,因此,也无法将胞内的半胱氨酸转运到胞外[22]。在炎症、肿瘤或其他病理状态下,MDSCs的扩增和积聚能够使其和微环境中的抗原提呈细胞竞争胞外的胱氨酸,进而抑制T细胞激活和增殖水平[23]。
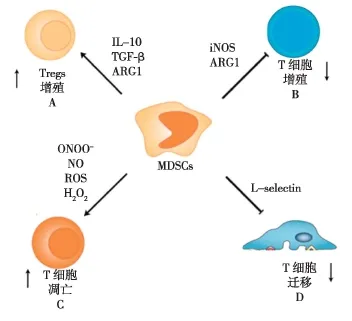
图1MDSCs负向调控T淋巴细胞增殖及活化的作用机制
产生NO和ROS病理状态下,MDSCs的积聚可产生大量iNOS,iNOS除可消耗微环境中的L-精氨酸来抑制TCRζ链的正常表达外,还可分解L-精氨酸产生大量NO。研究表明,NO不仅抑制抗原提呈细胞表达MHC分子而且还通过CD95直接诱导T细胞凋亡[20]。除NO之外,MDSCs还可产生ROS来发挥免疫抑制作用。虽然Mo-MDSCs和PMNMDSCs都具有分泌NO和ROS的能力,但两种亚群发挥免疫抑制机制却不同,Mo-MDSCs主要依赖STAT1和iNOS并通过合成NO发挥免疫抑制作用,而PMN-MDSCs则依赖ARG1并合成ROS的方式来发生免疫抑制作用[1]。
干扰淋巴细胞转移L-selectin(CD62L)是白细胞与内皮细胞之间相互作用的关键分子,L-selectin的表达能够诱导初始T细胞向外周淋巴结迁移和炎症部位聚集。多项研究表明,MDSCs的扩增和积聚可直接下调未致敏T细胞表面L-selectin的表达水平,使其无法顺利的向淋巴结的迁移。例如将初始T细胞和MDSCs共培养后发现,T细胞表面L-selectin表达水平显著降低,其次利用无荷瘤小鼠T细胞和MDSCs培养后也发现了同样现象[24]。而MDSCs引起L-selectin表达降低的机制有可能是通过ADAM17酶裂解L-selectin胞外结构域引起,进而降低T淋巴细胞向外周淋巴结归巢的能力[25]。
MDSCs还可通过其他机制发挥免疫抑制作用。例如Li等[26]在荷瘤小鼠模型及体外实验中发现,与自然杀伤细胞(NK细胞)共培养后,MDSCs可显著抑制NK细胞毒效应、阻断NK细胞受体NKG2D信号传导途径并下调IFN-γ的合成水平,在培养基中添加TGF-β抗体可解除该抑制作用。此外,MDSCs作为巨噬细胞的前体细胞,可在肿瘤微环境中被诱导分化成为肿瘤相关巨噬细胞(TAM),而TAM则可通过高表达iNOS和ARG1等方式来进一步诱导T淋巴细胞发生凋亡。
MDSCs与肾脏疾病的关系
MDSCs是肿瘤发生发展中一个关键性免疫抑制细胞,目前已在多种肿瘤中报道了MDSCs的积聚和免疫抑制功能,包括头颈部恶性肿瘤、结肠癌、乳腺癌、肺癌及肾细胞癌等。而靶向MDSCs的肿瘤治疗策略日益得到研究者的重视和关注,主要包括以下几个方面: (1)促进MDSCs的分化。全反式维甲酸(ATRA)可诱导MDSCs向DCs和巨噬细胞的分化,从而降低机体内MDSCs水平[27]。(2)抑制MDSCs的扩增。VEGF能促进MDSCs扩增,而应用VEGF特异性抗体能显著降低患者循环性MDSCs的数量[28]。(3)阻断MDSCs的功能。如肾癌患者分离出的MDSCs用CDDO处理后,可抑制MDSCs合成和分泌ROS,降低MDSCs的免疫抑制能力[29]。(4)剔除MDSCs。如临床试验证实舒尼替尼可显著降低患者外周血MDSCs的数量,恢复Th1细胞分泌IFN-γ水平的能力[30]。
此外,MDSCs作为宿主体内重要的一类免疫细胞群体,除在癌症发生发展中起到负调节作用之外,在器官移植及自体免疫性疾病中也起到重要的调控功能。在许多器官移植模型中(如骨髓、肾、心脏以及皮肤移植等),MDSCs的聚积对器官移植后的排斥反应起抑制作用。其次,用CD28单抗诱导的大鼠肾脏同种器官移植可显著增加受体外周血中CD11b+CD80/86+MDSCs的积聚,MDSCs的积聚抑制T淋巴细胞增殖,并通过iNOS途径诱导T淋巴细胞凋亡[31]。尽管研究发现,过继转移MDSCs并不能延长同种异体肾脏移植的存活时间,但MDSCs仍可通过分泌NO来抑制同种T细胞的增殖水平[19]。在人体肾脏器官移植术后,外周血CD11b+CD33+HLA-DR-MDSCs数量显著增加,这些MDSCs的增加可诱导Tregs比例的上调,起到免疫抑制的作用[32]。其次,从肾脏移植受着外周血中分离的MDSCs不仅具有扩增Tregs的作用外,体外实验还证实MDSCs可显著下调CD4+T细胞分泌IL-17的水平[33]。因此,MDSCs在肾脏器官移植过程中起到一定的保护作用。高迁移率族蛋白B1(HMGB1)为内源性危险相关模式分子,它在介导系统性红斑狼疮等自身免疫性疾病的发生发展中扮演着重要角色。Jessica等则在CD24基因敲除的狼疮样小鼠模型中发现,HMGB1可以介导体内MDSCs的扩增,且通过体内外实验证实MDSCs含量上调不仅显著抑制机体T淋巴细胞活性和促炎因子的分泌水平,还对小鼠狼疮样病理有明显改善[34]。
特发性肾病综合征[局灶节段性肾小球硬化(FSGS)和微小病变(MCD)]是由T细胞功能异常导致的。而大剂量激素疗法仍是儿童和青壮年FSGS患者的常用治疗方案。本课题组在前期研究MDSCs与FSGS关系时发现,对GCs治疗敏感的FSGS患者,经GCs治疗后外周血中CD11b+HLADR-CD14-CD15+MDSCs数量迅速增加;而GCs不敏感的FSGS患者,外周血CD11b+HLA-DR-CD14-CD15+MDSCs未发生变化。并且通过体内外实验,证实了GCs可以上调MDSCs来抑制T细胞增殖、树突状细胞和巨噬细胞浸润,缓解足细胞病变[12]。
小结:MDSCs作为免疫系统的负调节成分,在维持机体的免疫平衡中有重要意义,以MDSCs为靶点的免疫疗法在动物实验中显示了可能的应用前景。由于MDSCs为一群异质性的细胞群体,对表型的认识还未完全清楚,需进一步探索新的标志分子来区分和定义各类亚群并研究其具体的作用机制。随着研究的不断深入,越来越多的表型被发现,其实验技术也不断成熟。这或许能促使我们从MDSCs表型及表达特异性抗原方面来进一步阐述其调控机制,为寻找治疗肿瘤或免疫性疾病提供有效的新靶点。
1Youn JI,Nagaraj S,Collazo M,et al.Subsets of myeloid-derived suppressor cells in tumor-bearing mice.J Immunol,2008,181(8): 5791-5802.
2Zhao F,Obermann S,von Wasielewski R,et al.Increase in frequency of myeloid-derivedsuppressorcellsinmicewithspontaneous pancreatic carcinoma.Immunology,2009,128(1):141-149.
3Baniyash M.Chronic inflammation,immunosuppression and cancer: new insights and outlook.Semin Cancer Biol,2006,16(1):80-88.
4Ko JS,Bukowski RM,Fincke JH.Myeloid-derived suppressor cells:a novel therapeutic target.Curr Oncol Rep,2009,11(2):87-93.
5Bronte V,Apolloni E,Cabrelle A,et al.Identification of a CD11b (+)/Gr-1(+)/CD31(+)myeloid progenitor capable of activating or suppressing CD8(+)T cells.Blood,2000,96(12):3838-3846.
6Dolcetti L,Peranzoni E,Ugel S,et al.Hierarchy of immunosuppressive strength among myeloid-derived suppressor cell subsets is determined by GM-CSF.Eur J Immunol,2010,40(1):22-35.
7Pak AS,Wright MA,Matthews JP,et al.Mechanisms of immune suppression in patients with head and neck cancer:presence of CD34 (+)cells which suppress immune functions within cancers that secrete granulocyte-macrophage colony-stimulating factor.Clin Cancer Res,1995,1(1):95-103.
8Solito S,Marigo I,Pinton L,et al.Myeloid-derived suppressor cell heterogeneity in human cancers.Ann N Y Acad Sci,2014,1319:47-65.
9Chavan R,Salvador D,Gustafson MP,et al.Untreated stage IV melanomapatientsexhibitabnormalmonocytephenotypesand decreased functional capacity.Cancer Immunol Res,2014,2(3): 241-248.
10 Diaz-Montero CM,Salem ML,Nishimura MI,et al.Increased circulating myeloid-derived suppressor cells correlate with clinical cancer stage,metastatictumorburden,anddoxorubicin-cyclophosphamide chemotherapy.Cancer Immunol Immunother,2009,58(1):49-59.
11 Grohmann U,Bronte V.Control of immune response by amino acid metabolism.Immunol Rev,2010,236:243-264.
12 Damuzzo V,Pinton L,Desantis G,et al.Complexity and challenges in defining myeloid-derived suppressor cells.Cytometry B Clin Cytom,2015,88(2):77-91.
13 Li L,Zhang T,Diao W,et al.Role of Myeloid-Derived Suppressor Cells in Glucocorticoid-Mediated Amelioration of FSGS.J Am Soc Nephrol,2015,26(9):2183-2197.
14 Pan PY,Ma G,Weber KJ,et al.Immune stimulatory receptor CD40 is required for T-cell suppression and T regulatory cell activation mediated by myeloid-derived suppressor cells in cancer.Cancer Res,2010,70(1):99-108.
15 Hoechst B,Gamrekelashvili J,Manns MP,et al.Plasticity of human Th17 cells and iTregs is orchestrated by different subsets of myeloid cells.Blood,2011,117(24):6532-6541.
16 Yang R,Cai Z,Zhang Y,et al.CD80 in immune suppression by mouse ovarian carcinoma-associated Gr-1+CD11b+myeloid cells.Cancer Res,2006,66(13):6807-6815.
17 Serafini P,Mgebroff S,Noonan K,et al.Myeloid-derived suppressor cells promote cross-tolerance in B-cell lymphoma by expanding regulatory T cells.Cancer Res,2008,68(13):5439-5449.
18 Movahedi K,Guilliams M,Van den Bossche J,et al.Identification of discrete tumor-induced myeloid-derived suppressor cell subpopulations with distinct T cell-suppressive activity.Blood,2008,111(8): 4233-4244.
19 Dugast AS,Haudebourg T,Coulon F,et al.Myeloid-derived suppressor cells accumulate in kidney allograft tolerance and specifically suppress effector T cell expansion.J Immunol,2008,180(12):7898-7906.
20 GabrilovichDI,NagarajS.Myeloid-derivedsuppressorcellsas regulators of the immune system.Nat Rev Immunol,2009,9(3): 162-174.
21 Zea AH,Rodriguez PC,Culotta KS,et al.L-Arginine modulates CD3zeta expression and T cell function in activated human T lymphocytes.Cell Immunol,2004,232(1-2):21-31.
22 Highfill SL,Rodriguez PC,Zhou Q,et al.Bone marrow myeloidderived suppressor cells(MDSCs)inhibit graft-versus-host disease (GVHD)via an arginase-1-dependent mechanism that is up-regulated by interleukin-13.Blood,2010,116(25):5738-5747.
23 Almand B,Clark JI,Nikitina E,et al.Increased production of immaturemyeloidcellsincancerpatients:amechanismof immunosuppression in cancer.J Immunol,2001,166(1):678-689.
24 Wang Y,Herrera AH,Li Y,et al.Regulation of mature ADAM17 by redox agents for L-selectin shedding.J Immunol,2009,182(4): 2449-2457.
25 Galkina E,Tanousis K,Preece G,et al.L-selectin shedding does not regulate constitutive T cell trafficking but controls the migration pathways of antigen-activated T lymphocytes.J Exp Med,2003,198 (9):1323-1335.
26 Li H,Han Y,Guo Q,et al.Cancer-expanded myeloid-derived suppressor cells induce anergy of NK cells through membrane-bound TGF-beta 1.J Immunol,2009,182(1):240-249.
27 Kusmartsev S,Cheng F,Yu B,et al.All-trans-retinoic acid eliminates immature myeloid cells from tumor-bearing mice and improves the effect of vaccination.Cancer Res,2003,63(15):4441-4449.
28 Kusmartsev S,Eruslanov E,Kübler H,et al.Oxidative stress regulates expression of VEGFR1 in myeloid cells:link to tumor-induced immune suppression in renal cell carcinoma.J Immunol,2008,181 (1):346-353.
29 Nagaraj S,Youn JI,Weber H,et al.Anti-inflammatory triterpenoid blocks immune suppressive function of MDSCs and improves immune response in cancer.Clin Cancer Res,2010,16(6):1812-1823.
30 Ko JS,Zea AH,Rini BI,et al.Sunitinib mediates reversal of myeloidderived suppressor cell accumulation in renal cell carcinoma patients.Clin Cancer Res,2009,15(6):2148-2157.
31 Wu T,Zhao Y,Zhao Y.The roles of myeloid-derived suppressor cells in transplantation.Expert Rev Clin Immunol,2014,10(10): 1385-1394.
32 Luan Y,Mosheir E,Menon MC,et al.Monocytic myeloid-derived suppressor cells accumulate in renal transplant patients and mediate CD4(+)Foxp3(+)Treg expansion.Am J Transplant,2013,13(12): 3123-3131.
33 Meng F,Chen S,Guo X,et al.Clinical significance of myeloid-derived suppressor cells in human renal transplantation with acute T cellmediated rejection.Inflammation,2014,37(5):1799-1805.
34 Thaxton JE,Liu B,Zheng P,et al.Deletion of CD24 impairs development of heat shock protein gp96-driven autoimmune disease through expansion of myeloid-derived suppressor cells.J Immunol,2014,192(12):5679-5686.
Myeloid-derived suppressor cells in renal disease
XU Xiaodong,BAO Hao
National Clinical Research Center of Kidney Diseases,Jinling Hospital,Nanjing University School of Medicine,Nanjing 210016,China
Myeloid-derived suppressor cells(MDSCs)are a heterogeneous population of immature myeloid cells that can suppress T cell responses,play an important role in maintaining the immune balance and the development of chronic kidney disease.Due to the heterogeneity of MDSCs,the cells phenotype and mechanism has not been fully elucidated.This paper will review the study of MDSCs source,phenotype identification and its role in kidney disease.
myeloid-derived suppressor cellsrenal disease
2015-12-19
(本文编辑律舟清如)
10.3969/cndt.j.issn.1006-298X.2016.01.015
国家重点基础研究发展计划(973计划)(2012CB5176-06),国家自然科学基金(81200516),江苏自然科学基金(BK2012372)
南京军区南京总医院肾脏科国家肾脏疾病临床医学研究中心全军肾脏病研究所(南京,210016)
