Klotho
——慢性肾脏病的心血管保护因子
2016-06-01林文军综述刘志红审校
林文军 综述 刘志红 审校
·肾脏病基础·
Klotho
——慢性肾脏病的心血管保护因子
林文军 综述 刘志红 审校
Klotho是一种抗衰老基因。既往研究表明,Klotho不仅具有抗衰老作用,还有保护肾脏的作用。近年研究表明,Klotho蛋白具有激素样作用,除可在肾脏局部发挥作用外,还可作用于远端器官(如心血管系统)。慢性肾脏病患者常死于心血管疾病。由于Klotho高表达于肾脏且可作用于远端器官,因此,Klotho对慢性肾脏病相关心血管病变的作用成为近年研究热点。本文就Klotho对慢性肾脏病合并心血管病变的影响进行综述。
慢性肾脏病Klotho心血管
慢性肾脏病(CKD)发病率逐年升高,严重危害人类生命健康。CKD是心血管疾病(CVD)的独立危险因素。CKD合并CVD时,CKD进展加快,患者生存率显著下降,生活质量明显降低。CKD在进展为终末期肾病(ESRD)之前常死于CVD[1]。初步研究结果表明透析患者肾功能损伤程度与心血管事件死亡率显著相关。50%的ESRD患者会出现心血管事件,该部分人群心血管事件死亡率是一般人群的15~30倍[2]。
Klotho基因由韩国科学家Kuro-o等[3]于1997年发现。Klotho基因表达缺失的小鼠具有寿命缩短、动脉钙化、肺气肿和骨质疏松等衰老样表型。研究发现,年龄>40周岁的健康成年人血清Klotho水平下降[4];衰老相关疾病(如肿瘤、高血压及肾脏病)患者血清Klotho水平下降[5]。现已发现Klotho与多种生物学功能相关,其中大部分功能与寿命有关。
Klotho可保护心血管系统。Klotho直接与成纤维细胞生长因子(FGF)受体结合形成有助于FGF-23结合的高亲和力受体复合物,参与FGF-23对体内磷代谢的调节。此外,Klotho可能通过抑制氧化应激、调节炎症以及缓解血管钙化等多种机制保护心血管系统。因此,Klotho可能是CVD的一个重要调节因子[6]。本文旨在探讨Klotho在CKD相关CVD中的作用。
Klotho
人类Klotho基因位于染色体13q12,由5个外显子组成。Klotho基因可以转录形成两种转录本:一种是全长,该转录本可翻译为由1 012个氨基酸组成的分子量为130 kD的跨膜蛋白,即膜型;另外一种转录本可翻译为N端的549个氨基酸,分子量为65~70 kD的分泌型蛋白,即分泌型(图1)[7]。血液循环中的Klotho蛋白由膜型Klotho经水解产生的胞外区片段和分泌型Klotho组成(图1)。尿液、血清和脑脊液中均存在Klotho。Klotho以体液因子的形式存在于循环系统中,具有抗氧化、调节肾脏离子通道、拮抗Wnt信号通路、抗凋亡和抗衰老等作用[8]。
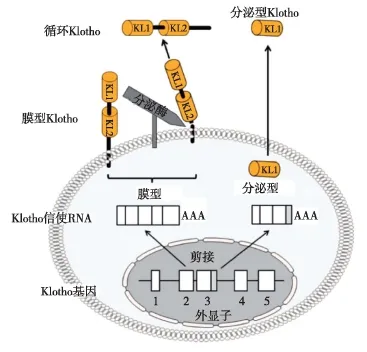
图1 膜型Klotho与分泌型Klotho[7]
CKD患者Klotho表达
Klotho表达缺失小鼠的表型与CKD存在相似特征,如高磷血症、高FGF-23、寿命缩短和血管钙化。CKD 2期患者血清中Klotho水平下降且与eGFR呈正相关[9]。多因素校正后,血清Klotho与eGFR独立相关[10]。然而,目前商品化Klotho检测试剂盒的组内变异系数、组间变异系数和线性范围存在差异[11]。使用不同的试剂盒可能增大检测结果的差异。然而,即便使用同一试剂盒,血清Klotho检测结果仍存在较大差异。Yamazaki等[4]认为成年人血清Klotho的正常范围为239~1 266 pg/ml (平均值±标准差:562±146 pg/ml),血清Klotho水平与肌酐和年龄呈负相关,提示血清Klotho水平可能受肾功能影响。然而,Sugiura等[12]使用相同的试剂盒发现CKD患者血清Klotho水平(平均值±标准差:1 413±614 pg/ml)是正常成年人(平均值: 404±87 pg/ml)的3~4倍。试剂盒的选取、入组标准、入组人数和正常值的选定可能会影响最终结果的判定。因此,应统一规范检测试剂盒,进行大规模多中心队列研究以确定正常成年人及CKD患者血清Klotho的水平。
Klotho表达水平受多种因素的影响。Klotho表达水平随年龄增长而出现下降,健康儿童Klotho水平显著高于健康成年人[4]。在高磷、高FGF-23及肾功能下降时,Klotho的表达均会受到抑制[13]。临床相关药物,如他汀类药物[14]、肾素血管紧张素拮抗剂[15],PPARγ激动剂[16]则可增加Klotho的表达。因此,在阐述CKD或ESRD患者血清中Klotho水平时,还需要考虑到上述这些因素的影响。
Klotho与CKD左心室肥厚
左心室肥厚(LVH)是心源性死亡的独立危险因素。超声心动图检查发现ESRD患者左心室肥厚(LVH)、心脏收缩功能障碍、心室扩张(扩张性心肌病)的患病率分别为74%、15%和32%[17-18]。这些病理改变与ESRD患者不良预后的相关性远远高于高血压、年龄、糖尿病、肥胖和脂质代谢紊乱等已知的传统心血管疾病危险因素。约50%的ESRD患者会因心脏结构和功能的异常出现突发性心律失常,甚至死亡[19]。
肾脏病早期(肾功能几乎正常时)即可出现左心室质量增加,最常见的类型是偏心性LVH;LVH呈进行性进展,80%进行肾脏替代治疗的患者患有LVH,主要类型为同心性LVH[19]。Levin等[20]对175名透析前患者实施超声心动图监测并评估他们的左心室质量指数(LVMI)。研究结果发现,随着肾功能的下降,LVH的发病率增加,当肾功能损伤严重时(CrCl<25 mL/min),45.2%的患者出现LVH。Paoletti等[21]对244例非糖尿病透析前患者研究分析后发现,CKD 1、2期LVH的患病率为51%,而CKD 3~5期LVH的患病率为78%。
CKD患者除了具有传统心血管危险因素外,还存在蛋白结合毒素[如硫酸吲哚酚(IS)]、低Klotho、白蛋白尿、肾素-血管紧张素-醛固酮系统(RAAS)的高反应性和骨及矿物质代谢异常等CKD特异性心血管危险因素。
Klotho可以缓解多种因素引起的LVH。Yang等[22]发现Klotho蛋白可缓解IS诱导的心肌肥厚。他们分析了86例CKD患者血清中IS与Klotho的关系,发现两者呈负相关。与野生型小鼠相比,IS可诱导Klotho表达缺失的杂合子小鼠发生更为严重的LVH。体外研究发现,Klotho可阻断由IS诱导、ROS介导的MAPK和ERK1/2信号通路的激活(图2)。由于Klotho是FGF-23的共受体,参与调节磷的代谢,因此CKD患者Klotho表达下降所引起的心肌病变也可能是通过上调血清中FGF-23或(和)磷的水平所致[23]。然而,最近的一项研究认为即便恢复血清中的磷和FGF-23至正常水平,也不能完全逆转Klotho表达缺失小鼠CKD模型的心肌肥厚表型,这表明Klotho可以通过非FGF-23和磷依赖的途径来缓解尿毒症心肌病变[24]。进一步的研究证实Klotho可以直接参与心脏的保护(图2)。Xie等[25]发现异丙肾上腺素(ISO)可加重Klotho表达缺失小鼠的心脏肥厚。注射Klotho蛋白可缓解ISO诱导的小鼠心脏结构改变,如心肌纤维排列紊乱、成纤维细胞增生、单核细胞浸润或间质和血管周围纤维化。其作用机制可能与瞬时受体电位阳离子通道6(TRPC6)通道的下调有关,其中TRPC6过表达可以导致心脏发育异常和早亡。另外,心肌细胞凋亡是心肌重塑的一个重要的过程,Klotho能够通过抑制内质网应激和活性氧(ROS)的产生来抑制心肌细胞凋亡[26]。
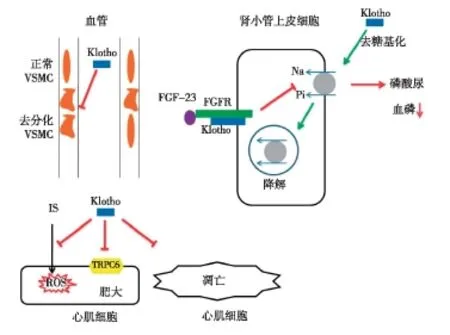
图2Klotho保护心血管作用机制
Klotho与CKD血管钙化
150多年前,Virchow[27]描述了尿毒症相关的软组织和血管钙化,他认为钙化是指钙从骨中被转移至软组织中。大约50年前,Parfitt等[28]详细地解释了尿毒症相关软组织和血管钙化,虽然以现在的标准来看,他提出的钙化机制已经过时,但他对损伤的描述非常准确,他认为在所有不同部位的异位钙化中,动脉钙化最为常见。
血管钙化是一种复杂、可调控的,由细胞驱动的病理过程,该过程由多种抑制性蛋白和诱导性蛋白参与。病变细胞和局部调控蛋白间平衡体系的打破促使钙化的发生。继而导致大动脉壁变厚,弹性减弱。与血管钙化相关的细胞机制是血管平滑肌细胞(VSMC)凋亡,该机制早于实际钙化的发生。此外,VSMC可发生表型转变,成为骨软骨原细胞,继而分泌基质小泡,沿凋亡小体形成胶原纤维,促进羟基磷石灰晶体的形成。值得注意的是,钙磷在细胞表型转换以及异位钙化形成的共同通路中均起到重要作用。细胞外磷水平增加会通过III型NaPi协同转运体(Pit-1和Pit-2)促进磷内流增加从而诱导VSMC发生矿化。这一过程伴随着成骨标志物(如RunX2)的过表达,从而促使VSMC发生去分化[29]。钙化可发生于血管内膜、血管中膜或两者同时出现。血管内膜钙化主要见于较大动脉中的动脉粥样硬化性斑块。血管中膜钙化可发生于任何大小的动脉,主要特征为沿弹力纤维分布的弥漫性矿物质沉积。两种形式的钙化在CKD患者的血管中均可检测到。然而,血管中膜钙化更为典型,更为常见。血管钙化在CKD早期即可出现,肾功能恶化时更为常见[30]。
Klotho可抑制血管钙化。小鼠过表达Klotho可以缓解肾功能损伤,增加磷酸尿,减少软组织钙化[31]。然而,过表达Klotho难免会打破矿物质、多种内分泌轴的稳态。因此,不能完全确定Klotho对血管钙化的直接作用。考虑到这些因素,Hu等[31]认为,Klotho通过间接作用和直接作用来发挥其保护作用(图2)。间接作用表现为Klotho促进尿磷排泄和缓解肾脏损伤[10]。Klotho与FGF-23受体结合激活FGF-23信号通路,抑制近端肾小管细胞刷状缘IIa型NaPi协同转运体,促进磷排泄。此外,Klotho通过非FGF-23依赖途径使近端肾小管IIa型NaPi协同转运体发生去糖基化,促进其内化,从而调控磷的转运[32]。直接作用表现为,Klotho可直接作用于在血管钙化起始和进展中均起到重要作用的VSMC。2011年,Hu等[31]证实重组的Klotho蛋白可以通过调节VSMC中Ⅲ型NaPi协同转运体的活性而抑制VSMC发生去分化。与上述发现一致,Lim等[33]发现把人动脉平滑肌细胞(HA-SMC)中的Klotho沉默后,HA-SMC会发生钙化。有趣的是,维生素D受体激动剂,如骨化三醇或帕立骨化醇处理后,可使在促进钙形成条件下培养的HA-SMC中的Klotho表达恢复,并且会增加尿毒症小鼠血液和尿液中的Klotho水平[33-34]。使用维生素D受体激动剂进行治疗,可以改善动脉中层钙化并增加抗钙化因子-骨桥蛋白的表达[34]。
小结:CKD早期即可出现CVD,而后者直接影响CKD患者的生存率和生活质量。Klotho高表达于肾脏,CKD患者肾脏组织Klotho和血清中Klotho均明显下降。Klotho水平下降会加速CKD及心血管病变的进展。大量动物实验表明,Klotho通过直接和间接作用保护心血管系统。外源性注射Klotho蛋白可缓解多种CKD小鼠模型心血管病变。Klotho有望成为治疗CKD及相关心血管病变新靶点。
1Schiffrin EL,Lipman ML,Mann JF.Chronic kidney disease:effects on the cardiovascular system.Circulation,2007,116(1):85-97.
2Foley RN,Parfrey PS,Sarnak MJ.Epidemiology of cardiovascular disease in chronic renal disease.J Am Soc Nephrol,1998,9(12 Suppl):S16-23.
3Kuro-o M,Matsumura Y,Aizawa H,et al.Mutation of the mouse klotho gene leads to a syndrome resembling ageing.Nature,1997,390 (6655);45-51.
4Yamazaki Y,Imura A,Urakawa I,et al.Establishment of sandwich ELISA for soluble alpha-Klotho measurement:Age-dependent change of soluble alpha-Klotho levels in healthy subjects.Biochem Biophys Res Commun,2010,398(3):513-518.
5Wang Y,Sun Z.Current understanding of Klotho.Ageing Res Rev,2009,8(1):43-51.
6Moe SM.Klotho:a master regulatorofcardiovasculardisease? Circulation,2012,125(18):2181-2183.
7Bian A,Neyra JA,Zhan M,et al.Klotho,stem cells,and aging.Clin Interv Aging,2015,10:1233-1243.
8Hu MC,Kuro-o M,Moe OW.Renal and extrarenal actions of Klotho.Semin Nephrol,2013,33(2):118-129.
9Shimamura Y,Hamada K,Inoue K,et al.Serum levels of soluble secreted α-Klotho are decreased in the early stages of chronic kidney disease,making it a probable novel biomarker for early diagnosis.Clin Exp Nephrol,2012,16(5):722-729.
10 Kim HR,Nam BY,Kim DW,et al.Circulating α-Klotho levels in CKD and relationship to progression.Am J Kidney Dis,2013,61(6): 899-909.
11 Heijboer AC,Blankenstein MA,Hoenderop J,et al.Laboratory aspects of circulating alpha-Klotho.Nephrol Dial Transplant,2013,28(9): 2283-2287.
12 Sugiura H,Tsuchiya K,Nitta K.Circulating levels of soluble alpha-Klotho in patients with chronic kidney disease.Clin Exp Nephrol,2011,15(5):795-796.
13 Torres PU,Prié D,Molina-Blétry V,et al.Klotho:an antiaging protein involved in mineral and vitamin D metabolism.Kidney Int,2007,71 (8):730-737.
14 Yoon HE,Lim SW,Piao SG,et al.Statin upregulates the expression of Klotho,an anti-aging gene,in experimental cyclosporine nephropathy.Nephron Exp Nephrol,2012,120(4):e123-e133.
15 Karalliedde J,Maltese G,Hill B,et al.Effect of renin-angiotensin system blockade on soluble Klotho in patients with type 2 diabetes,systolic hypertension,and albuminuria.Clin J Am Soc Nephrol,2013,8(11):1899-1905.
16 Zhang H,Li Y,Fan Y,et al.Klotho is a target gene of PPAR-gamma.Kidney Int,2008,74(6):732-739.
17 FoleyRN,ParfreyPS,KentGM,etal.Serialchangein echocardiographic parameters and cardiac failure in end-stage renal disease.J Am Soc Nephrol,2000,11(5):912-916.
18 FoleyRN,ParfreyPS,HarnettJD,etal.Clinicaland echocardiographic disease in patients starting end-stage renal disease therapy.Kidney Int,1995,47(1):186-192.
19 Stewart GA,Gansevoort RT,Mark PB,et al.Electrocardiographic abnormalities and uremic cardiomyopathy.Kidney Int,2005,67(1): 217-226.
20 Levin A,Singer J,Thompson CR,et al.Prevalent left ventricular hypertrophy in the predialysis population:identifying opportunities for intervention.Am J Kidney Dis,1996,27(3):347-354.
21 Paoletti E,Bellino D,Cassottana P,et al.Left ventricular hypertrophy in nondiabetic predialysis CKD.Am J Kidney Dis,2005,46(2): 320-327.
22 Yang K,Wang C,Nie L,et al.Klotho Protects Against Indoxyl Sulphate-Induced Myocardial Hypertrophy.J Am Soc Nephrol,2015,26(10):2434-2446.
23 Faul C,Amaral AP,Oskouei B,et al.FGF23 induces left ventricular hypertrophy.T J Clin Invest,2011,121(11):4393-4408.
24 Xie J,Yoon J,An SW,et al.Soluble Klotho protects against uremic cardiomyopathy independently of fibroblast growth factor 23 and phosphate.J Am Soc Nephrol,2015,26(5):1150-1160.
25 Xie J,Cha SK,An SW,et al.Cardioprotection by Klotho through downregulation of TRPC6 channels in the mouse heart.Nat Commun,2012,3:1238.
26 Song S,Gao P,Xiao H,et al.Klotho suppresses cardiomyocyteapoptosisinmicewithstress-inducedcardiacinjuryvia downregulation of endoplasmic reticulum stress.PLoS One,2013,8 (12):e82968.
27 Virchow R.Kalk-Metastasen.Virchows Arch Pathol Anat,1855,8(1): 103-113.
28 Parfitt AM.Soft-tissue calcification in uremia.Arch Intern Med,1969,124(5):544-556.
29 Steitz SA,Speer MY,Curinga G,et al.Smooth muscle cell phenotypic transition associated with calcification upregulation of cbfa1 and downregulation of smooth muscle lineage markers.Circ Res,2001,89 (12):1147-1154.
30 Temmar M,Liabeuf S,Renard C,et al.Pulse wave velocity and vascular calcification at different stages of chronic kidney disease.J Hypertens,2010,28(1):163-169.
31 Hu MC,Shi M,Zhang J,et al.Klotho deficiency causes vascular calcification in chronic kidney disease.J Am Soc Nephrol,2011,22 (1):124-136.
32 Kurosu H,Ogawa Y,Miyoshi M,et al.Regulation of fibroblast growth factor-23 signaling by Klotho.J Biol Chem,2006,281(10): 6120-6123.
33 Lim K,Lu TS,Molostvov G,et al.Vascular Klotho deficiency potentiates the development of human artery calcification and mediates resistance to fibroblast growth factor 23.Circulation,2012,125(18): 2243-2255.
34 Lau WL,Leaf EM,Hu MC,et al.Vitamin D receptor agonists increase Klotho and osteopontin while decreasing aortic calcification in mice with chronic kidney disease fed a high phosphate diet.Kidney Int,2012,82(12):1261-1270.
Klotho as a protective factor against cardiovascular disease in chronic kidney disease
LIN Wenjun,LIU Zhihong
National Clinical Research Center of Kidney Diseases,Jinling Hospital,Nanjing University School of Medicine,Nanjing 210016,China
Klotho is an anti-aging gene.Previous studies showed that Klotho not only exerted anti-aging function but also protected kidney.Recent researches have been reported that the function of klotho liked as a hormone.Klotho protein can act on remote targets,such as cardiovascular system.Since Klotho is highly expressed in kidney and can act on remote targets,the effect of Klotho on cardiovascular diseases in chronic kidney disease patients has been a hot spot in recent years.This article summaries the effect of Klotho on cardiovasular diseases in chronic kidney disease.
chronic kidney diseaseKlothocardiovascular
2015-11-25
(本文编辑律舟凡心)
10.3969/cndt.j.issn.1006-298X.2016.01.014
南京军区南京总医院肾脏科国家肾脏疾病临床医学研究中心全军肾脏病研究所(南京,210016)
