火龙果镰刀菌果腐病病原菌鉴定及生物学特性研究
2016-05-30朱迎迎高兆银李敏陈亮胡美姣
朱迎迎 高兆银 李敏 陈亮 胡美姣
摘 要 采用形态学特征观察、rDNA-ITS序列、EF-1α序列比对和系统发育树分析的方法对引起火龙果镰刀菌果腐病病原菌进行鉴定,并初步研究其生物学特性。结果表明:引起火龙果镰刀菌果腐病是单隔镰刀菌(Fusarium dimerum Penzig in Saccardo),这是该菌引起火龙果果腐病在国内的首次报道。该菌菌丝生长的适宜温度25~35 ℃,最适温度30 ℃,适宜产孢温度25~35 ℃,最适产孢温度30~35 ℃,致死温度75 ℃(10 min);适宜pH5~9,最适pH7,最适产孢pH4;连续光照、D-果糖为碳源、牛肉膏和蛋白胨为氮源时最有利于该菌菌丝生长;完全黑暗、D-半乳糖为碳源、尿素为氮源时最有利于该菌产孢。综合分析认为,该菌耐高温,光照充足、弱酸和富含有机营养的环境有利于该菌的生长和繁殖。
关键词 火龙果;果腐病;单隔镰刀菌;鉴定;生物学特性
中图分类号 S667.9;S432.4 文献标识码 A
Abstract Morphological characteristics observation and rDNA-ITS sequencing and EF-1α sequencing were performed using dragon fruit Fusarium rot pathogens. Furthermore, the paper made a preliminary study of the biological characteristics of pathogen. The results showed that one of the pathogens was identified as Fusarium dimerum Penzig in Saccardo and it was the first report in China. For mycelial growth of F. dimerum, the suitable temperature ranged from 25 ℃ to 35 ℃ and the optimum temperature was 30 ℃. For sporulation, the suitable temperature ranged from 25 ℃ to 35 ℃ and the optimum temperature ranged from 30 ℃to 35 ℃. The fatal temperature for mycelial growth was 75 ℃ for 10 min. For mycelial growth, the suitable pH value ranged from 5 to 9, and the optimum pH value was 7. The optimum pH value for sporulation was 4. Continuous illumination, D-fructose and beef extract and peptone as carbon and nitrogen sources were conducive to mycelial growth; Darkness, galactose and carbamide as carbon and nitrogen sources were propitious to sporulation. It showed that F. dimerum had excellent heat resistance, and abundant sunlight, weakly acidic, rich in organic nutrition were conducive to the growth and reproduction of F. dimerum.
Key words Dragon fruit;Fruit Rot;Fusarium dimerum;Identification;Biological characteristic
doi 10.3969/j.issn.1000-2561.2016.01.027
火龍果(Hylocereus spp.),又名红龙果,为仙人掌科、量天尺属植物,典型的热带水果[1]。近年来在我国海南、广东、广西、福建、云南、贵州、台湾等地区均有栽培[2]。火龙果果实外形独特、营养丰富、绿色保健,含有丰富的植物性蛋白、甜菜色素、水溶性膳食纤维、各种酶、不饱和脂肪酸、抗氧化物质及钙、磷、铁等矿物质[3-5],对人体健康有特殊的功效,倍受消费者青睐。但随着我国火龙果种植面积的不断扩大,其采后病害有逐渐加重的趋势[6]。据报道,能引起火龙果果腐病的真菌主要有镰刀菌(Fusarium spp.)[7-9]、炭疽菌(Colletotrichum spp.)[10-11]、双间柱顶孢(Scytalidium dimidiatum)[8,12]、 桃吉尔霉(Gilbertella persicaria)[13-14]、仙人掌平脐蠕孢(Bipolaris cactivora)[15-16]等。笔者在对海南省火龙果采后病害初步分离中发现一株镰刀菌,该菌具有较强的致病性,鉴于此,认为对该病原菌进一步研究是必要的。本研究采用形态学特征、rDNA-ITS区序列、EF-1α序列和系统发育树分析的方法进行种类鉴定,并首次对该菌生物学特性进行研究,以期为火龙果镰刀菌果腐病的防治提供理论依据。
1 材料与方法
1.1 材料
发病火龙果果实,从海南陵水火龙果基地采收的果实,贮藏发病的果实。
健康火龙果果实,购买于海南省海口市南北水果市场,新鲜、无损伤及无病害症状。
1.2 方法
1.2.1 病原菌的分离纯化 采用组织分离法。沿病果病健交界处取大小约3 mm×3 mm的小块果皮组织,用0.1%的升汞酒精消毒约30 s,无菌水冲洗3次后,将组织块置于PDA平板上,待菌落长出后挑取边缘菌丝进行纯化,获得纯化菌株于试管中4 ℃保存,备用。
1.2.2 病原菌致病性测定 采用刺伤接种法。将菌饼(ф=5 mm)接种于健康火龙果果实上,每个果实接种2点,每处理接种3个果实,以接种无菌PDA块为对照,置于保鲜盒中保湿。试验重复3次。
1.2.3 病原菌形态学鉴定 将纯化后的菌株,转接到新PDA平板上,置于28 ℃恒温培养,每日观察,记录菌落培养特征、菌丝体形态、产孢结构、厚垣孢子的有无和产生方式及分生孢子形态、颜色、大小等特征。参考文献资料[17-18]对病原菌的形态进行鉴定。
1.2.4 病原菌分子生物学鉴定 (1)病原菌基因组DNA提取。将供试菌株接种于PDA平板上,28 ℃培养4 d后,用接种针轻轻刮取约100 mg菌丝,用TIANGEN公司的植物基因组DNA提取试剂盒提取病原菌基因组DNA。
(2)rDNA-ITS和EF-1α序列扩增。参照White等[19]设计真菌rDNA-ITS通用引物ITS1和ITS4进行PCR扩增,引物序列ITS1: 5′-TCCGTAGGTGAA
CCTGCGG-3′;ITS4: 5′-TCCTCCGCTTATTGATATG
C-3′。PCR反应体系(50 μL):1.0 μL病原菌gDNA,2.0 μL 10 μmol/L ITS1,2.0 μL 10 μmol/L ITS4,25 μL 2×(HS)Taq-Mixture,20 μL ddH2O。PCR扩增程序:94 ℃ 5 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 10 s,35个循环;72 ℃延伸10 min。
参照Carbone[20]等利用EF-1α基因序列EF1-728F/EF1-986R进行PCR扩增,引物序列为:EF1-728F:5′-CATCGAGAAGTTCGAGAAGG-3′;EF1-986R:5′-TACTTGAAGGAACCC TTACC-3′。PCR反應体系及扩增程序同上。
(3)病原菌rDNA-ITS和EF-1α序列克隆与测序。使用Invitrogen公司的TA Cloning试剂盒将目的片段连接转化大肠杆菌DH5α感受态细胞。将菌体悬浮液PCR检测为阳性的克隆送北京诺赛基因组研究中心有限公司测序,将获得的序列与NCBI中核酸数据库进行同源性比对。
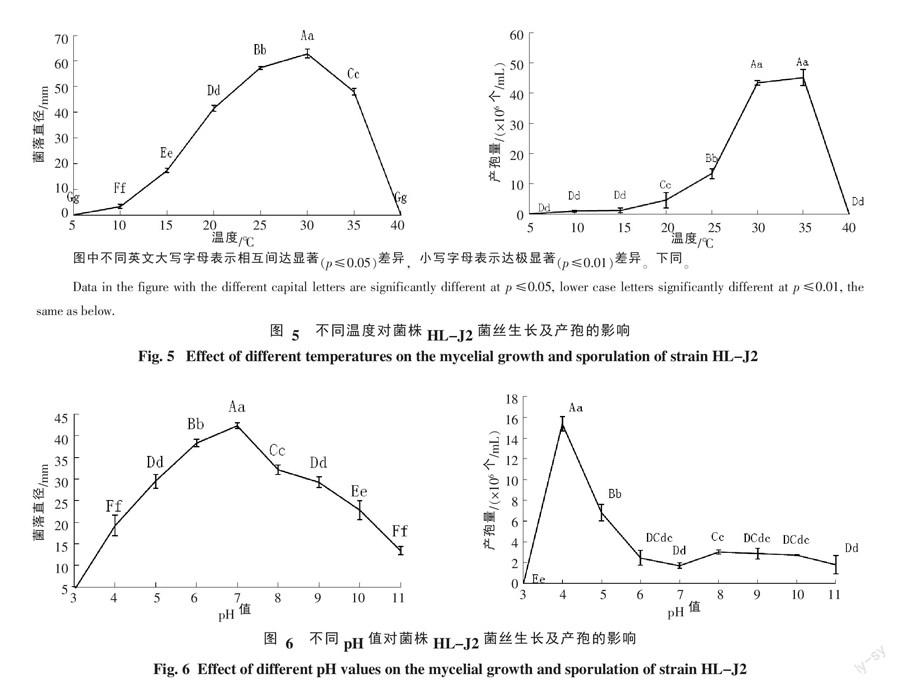
1.2.5 病原菌的生物学特性研究 (1)不同温度对菌丝生长及产孢量的影响。挑取菌龄一致的病原菌菌块(ф=5 mm)于PDA平板(d=90 mm)中央,分别置于5、10、15、20、25、28、30、35和40 ℃的共9种温度下培养,每处理3个皿,试验重复3次,6 d后,采用十字交叉法测量菌落直径,10 d后,用5 mL无菌水洗下孢子,采用血细胞计数板测定产孢量。
(2)不同pH值对菌丝生长及产孢量的影响。用0.1 mol/L的HCl和0.1 mol/L的NaOH调节灭菌后的PDA培养基,制成pH值分别为3、4、5、6、7、8、9、10和11的培养基,其余同1.2.5.1。
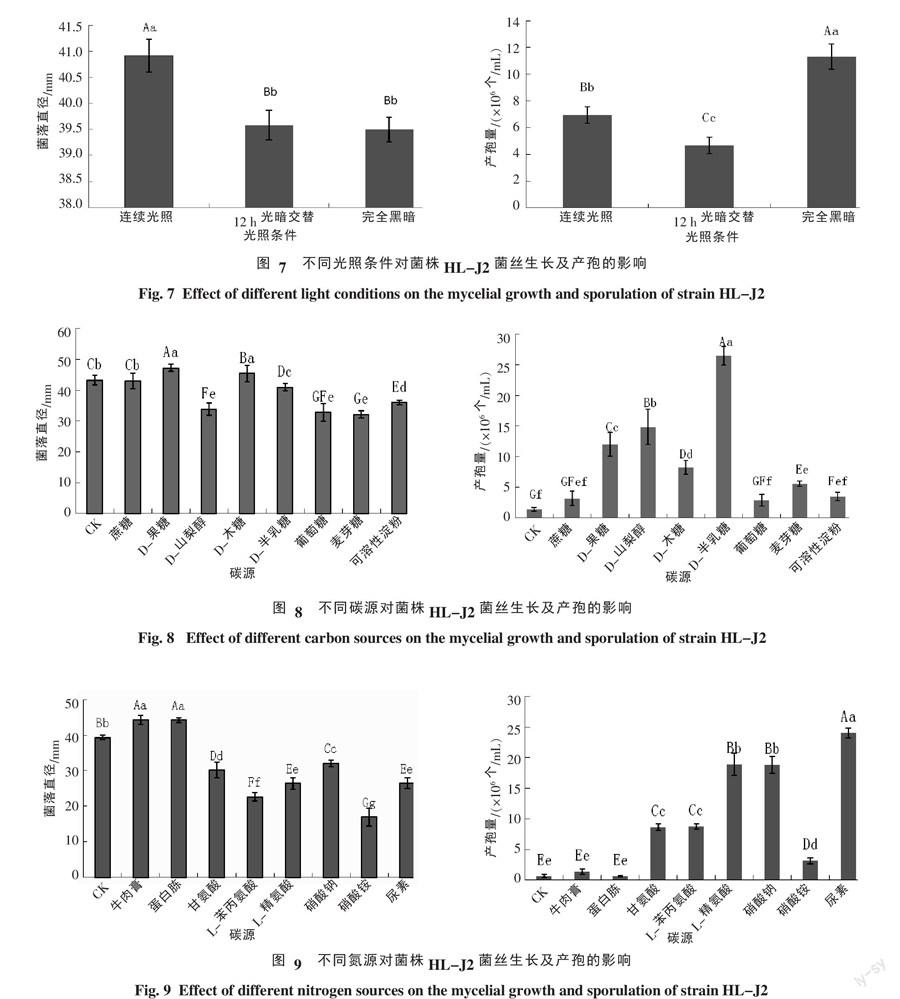
(3)光照对菌丝生长及产孢量的影响。将菌饼(ф=5 mm)接种于PDA平板上,分别在完全黑暗、12 h光暗交替和连续光照的条件下,28 ℃恒温倒置培养,其余方法同(1)。
(4)不同碳源对菌丝生长及产孢量的影响。以査氏固体培养基[21]为基础培养基,将蔗糖分别用等摩尔C量D-果糖、山梨醇、D-半乳糖、麦芽糖、葡萄糖、蔗糖、可溶性淀粉、L-木糖代替,制成不同碳源培养基,以无碳源培养基作对照,其余方法同(1)。
(5)不同氮源对菌丝生长及产孢量的影响。以査氏固体培养基[20]为基础培养基,将硝酸钠分别用等摩尔N量牛肉膏、蛋白胨、甘氨酸、精氨酸、苯丙氨酸、硝酸铵、硝酸钠、尿素代替,制成不同氮源培养基,以无氮源培养基作为对照,其余方法同(1)。
(6)致死温度和时间测定。D-将菌饼(ф=5 mm)加入含5 mL无菌水的离心管中,分别置于50、55、60、65、70、75、80 ℃的恒温水浴锅中水浴10 min,待迅速冷却后,将菌饼接种于PDA平板上,每天观察菌丝生长情况。每处理3皿,重复4次。
1.2.6 数据分析 利用SAS 8.1软件进行分析和检验,采用Duncan多重比较法进行差异性分析。
2 结果与分析
2.1 病害症状及病原菌的形态学鉴定
自然发病症状:该菌可为害火龙果果实,在果实、果蒂及其鳞片上形成圆形、暗黄色、水渍状病斑,病斑部位有白色绒状物,随后病斑扩大,与其他病斑愈合形成更大病斑(图1)。
从自然发病的火龙果果实上共分离出7株真菌,将分离得到的病原菌依照柯赫氏法则回接鉴定证明,其中1株不具致病性,6株不同程度地导致火龙果采后腐烂,经形态学初步鉴定,分别属于镰刀菌(Fusarium)、炭疽菌(Colletotrichum)和平脐蠕孢(Bipolaris)等3个属的真菌。其中镰刀菌致病性较强,接种于果实上,3 d后病斑直径达到36.8 mm。该菌可导致火龙果果实表面形成圆形、暗黄色、水渍状病斑、病斑凹陷且边缘清晰,随后病部褐变软腐,与自然发病火龙果的症状相符合(图1)。
该菌在PDA培养基上培养6 d,菌落达到55 mm,圆形,气生菌丝体初为白色后橘黄色,绒状,PDA基物背面为米黄色。大型分生孢子短,中等偏窄,两端稍尖,顶细胞弯曲,多数单个隔膜,小孢子椭圆形、新月形,无色透明,有的孢子中央有油滴,分生孢子大小7.0~22.0 μm×2.5~3.5 μm,产孢方式为单瓶梗式;厚垣孢子球形,在菌丝间串生,表面光滑,直径8~12 μm(图2)。
2.2 病原菌分子鉴定
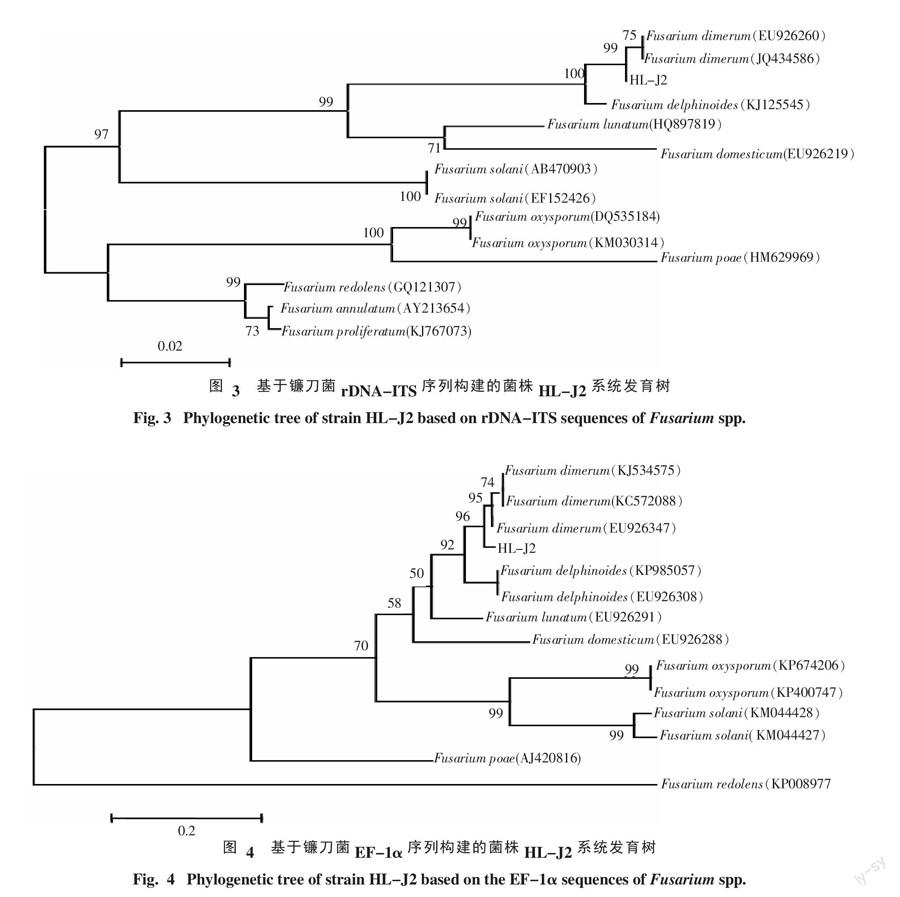
2.2.1 病原菌rDNA-ITS序列及系统发育树分析 经测序,菌株HL-J2的rDNA-ITS序列为564 bp(登录号:KR139925)。将该序列在NCBI上进行BLAST比对发现,该病原菌的rDNA-ITS序列与单隔镰刀菌(登录号:JQ434586、EU92620)的同源性均达到99%,用Neighbor-Joining构建系统发育树(图3),另外选取13株同源性高低不同的菌株进行多重序列比较,并做系统发育学分析。结果表明:病原菌与单隔镰刀菌(Fusarium dimerum)遗传距离最小,聚为一类,支持率为99%。
2.2.2 病原菌EF-1α序列及系统发育树分析 经测序,菌株HL-J2的EF-1α序列为291 bp(登录号:KT439328)。将该序列在NCBI上进行BLAST比对发现,该病原菌的EF-1α序列与单隔镰刀菌(登录号:KJ534575、KC572088、EU926347)的同源性均达到96%,用Neighbor-Joining构建系统发育树(图4),另外选取13株同源性高低不同的菌株进行多重序列比较,并做系统发育学分析。结果表明:病原菌与单隔镰刀菌(F. dimerum)遗传距离最小,聚为一类,支持率为96%。
结合菌株HL-J2的形态学特征、rDNA-ITS序列、EF-1α序列比对和系统发育树分析,确定该病原菌为单隔镰刀菌(Fusarium dimerum Penzig in Saccardo)。
2.3 病原菌生物学特性分析
2.3.1 温度对菌丝生长及产孢量的影响 该菌在10~35 ℃范围内均能生长,生长适宜温度25~35 ℃,最适温度30 ℃时,菌落直径极显著大于其他处理的菌落直径,10、15 ℃生长缓慢,5、40 ℃停止生长,将5、40 ℃的菌块恢复到常温时,5 ℃条件下的菌丝呈现缓慢生长现象,而40 ℃条件下的菌丝停止生长。说明,低温对菌丝无致死作用,只能抑制菌丝生长,恢复常温后仍具生长能力,而高温则可使菌丝丧失生活力(图5)。此外,35 ℃条件下培养的菌落出现明显的轮纹。该菌在15~35 ℃范围均能产孢,在30~35 ℃时,产孢量最大,极显著高于其他温度的产孢量,温度低于10 ℃或者达到40 ℃都不能产孢。故该菌最适宜产孢温度为30~35 ℃(图5)。
2.3.2 pH值对菌丝生长及产孢量的影响 该菌在pH3~11时菌丝均能生长,pH3时,菌丝生长缓慢,pH4~8时,菌丝生长速率增快,在pH7时,菌落直径极显著高于其他pH值的菌落直径,随后菌落直径逐渐减小。由此表明,该菌适宜生长pH为5~9,最适pH为7(图6)。pH为3时,该菌不产孢,pH4时,产孢量最大,为1.71×106个/mL,极显著高于其他pH值的产孢量,pH在5~11范围内产孢量下降。故该菌产孢最适pH为4(图6)。
2.3.3 光照对菌丝生长及产孢量影响 菌株HL-J2在连续光照、12 h光暗交替、完全黑暗3种光照条件下均能生长,其中连续光照的菌落直径极显著高于12 h光暗交替和完全黑暗的菌落直径(图7)。完全黑暗有利于产孢,产孢量为0.95×106个/mL,极显著高于其他两个处理的产孢量(图7)。
2.3.4 不同碳源对菌丝生长及产孢量影响 菌株HL-J2在供试的9种碳源培养基上均能生长,其中,以D-果糖的利用率最高,培养6 d后菌落直径为47.21 mm,极显著高于其他碳源的菌落直径。以葡萄糖和果糖为碳源时,该菌生长缓慢,菌落直径极显著小于无碳源的菌落直径,但菌丝生长旺盛,而无碳源的培养基菌丝虽然生长快,但菌丝稀疏,难观察(图8)。D-半乳糖有利于该菌产孢,产孢量最大,为26.43×106个/mL,极显著高于其他碳源的产孢量,而葡萄糖不利于该菌产孢(图8)。
2.3.5 不同氮源对菌丝生长及产孢量影响 菌株HL-J2在供试的9种氮源培养基上均能生长,以牛肉膏和蛋白胨利用率最高,培养6 d的菌落直径分别为44.2和44.1 mm,极显著高于其他氮源的菌落直径。以硝酸铵为氮源时,菌丝生长最慢,菌落直径显著小于无氮源的菌落直径,但菌丝生长旺盛,而无氮源虽然生长较快,但菌丝稀薄(图9)。尿素有利于该菌产孢,产孢量最大为24.02×106个/mL,极显著高于其他氮源的产孢量,其次是L-精氨酸和硝酸钠,在蛋白胨、牛肉膏和无氮源的培养基上产孢量极显著低于其他氮源的产孢量(图9)。
2.3.6 致死温度测定 经50~70 ℃处理10 min后,发现菌株HL-J2在PDA上均能生长。但75 ℃及以上温度处理,菌丝不再生长,则表明该菌菌丝的致死温度是75 ℃,10 min。
3 討论与结论
单隔镰刀菌又称双胞镰孢(Fusarium dimerum),属半知菌亚门、从梗孢目、瘤座孢科、镰刀菌属真菌。Penzig[22]首次对该菌进行描述,认为其分生孢子只具有单隔膜,但Wollenweber & Reinking[23]和 Schroers H J[24]进一步研究中发现,该菌分生孢子除具有单隔外,还有0~3隔。本研究在实验中发现该菌大型分生孢子多为单隔,小型孢子无隔。因此,通过对该菌大、小型分生孢子的产生情况及其形态大小,厚垣孢子的有无和产生方式等,同时结合rDNA-ITS序列、EF-1α序列比对分析和系统发育树,认为引起火龙果镰刀菌果腐的病原菌之一为F. dimerum。
Domsch等[25]认为该菌广泛分布在土壤和植物,寄主范围广。目前已报道,该菌可引起香蕉轴腐病[26],甘草[27]、豌豆[28]、蚕豆[29]根腐病,马铃薯叶斑病[30]等。此外,研究还发现该菌也可危害人体,引起人类角膜溃疡病[31],同时也可以降低人体免疫力[32]等。马腾飞等[33]认为镰刀菌(Fusarium spp.)是上海市售进口火龙果主要病害之一,但尚未确定到种。崔志婧等[9]认为尖孢镰刀菌(F. oxysporum)和单隔镰刀菌(F. dimerum)是上海进口火龙果致病真菌,其中,F. oxysporum为进口火龙果最主要病原真菌。卢琨等[7]研究认为砖红镰刀菌(F. lateritium Nees)可引起火龙果采后贮藏病害。笔者等对海南生产的火龙果采后病害研究发现单隔镰刀菌对火龙果致病性较强,可引起火龙果果实大量腐烂,这与崔志婧[9]等对上海进口火龙果软腐病病害分析的结果一致,且该菌引起国内火龙果果腐病为首次报道。
虽然该菌在香蕉、甘草、蚕豆、豌豆等作物上有报道,但均未对其生物学特性进行研究。鉴于此,开展单隔镰刀菌(F. dimerum)生物学特性研究对指导该病的防治更加必要和有意义。研究发现该菌菌丝生长的适宜温度25~35 ℃,最适温度30 ℃,最适产孢30~35 ℃;适宜pH值5~9,最适宜pH值7,最适产孢pH4。连续光照有利该菌生长,完全黑暗虽然不利于该菌生长但有利于该菌产孢;此外,该菌以D-果糖为碳源和以蛋白胨、牛肉膏为氮源时,菌丝生长最快,以D-半乳糖为碳源和尿素为氮源时,有利于该菌产孢。该菌致死温度达75 ℃,10 min。综合分析认为该菌耐高温,光照充足、弱酸和富含有机营养的环境有利于该菌的生长和繁殖。因此,在对该病害防治中要尽量避免其生长和产孢有利条件。本研究结果为今后火龙果镰刀菌果腐病综合防治以及其致病原理提供参考价值。
参考文献
[1] 郑良永. 海南岛火龙果丰产栽培技术[J]. 热带农业科学, 2004, 24(4): 36-41.
[2] 邓仁菊, 范建新, 蔡永强. 国内外火龙果研究进展及产业发展现状[J]. 贵州农业科学, 2011, 39(6): 188-192.
[3] 陈 杰, 庞江琳, 李尚德. 火龙果的微量元素含量分析[J]. 广东微量元素科学, 2004, II(5): 56-57.
[4] 杨巧云, 邹 琼. 水果新秀—火龙果[J]. 河南农业, 2003(11): 21.
[5] 王生有, 陈于陇, 徐玉娟, 等. 火龙果采后生理和保鲜技术的研究进展[J]. 食品工业科技, 2014(13): 396-399.
[6] 胡美姣, 李 敏, 高兆银, 等. 热带亚热带水果采后病害及防治[M]. 北京: 中国农业出版社, 2010.
[7] 卢 琨. 火龙果采后的保鲜贮运技术[J]. 世界热带农业信息, 2006(7): 24-25.
[8] 李 敏, 胡美姣, 高兆银, 等. 海南火龙果采后病害调查及防治技术研究[J]. 中国热带农业, 2012(6): 43-44.
[9] 崔志婧, 王奕文, 于 岳. 上海市进口火龙果软腐病病害分析[J]. 微生物学通报, 2011, 38(10): 1 499-1 506.
[10] Guo L W, Wu Y X, Ho H H, et al. First report of dragon fruit (Hylocereus undatus)anthracnose caused by Colletotrichum truncatum in China[J]. Journal of Phytopathology, 2014, 162(4): 272-275.
[11] 郑 伟, 王 彬. 火龙果炭疽病病原鉴定与 ITS序列分析[J]. 西南农业学报, 2014, 27(5): 1 970-1 973.
[12] 李 敏, 胡美姣, 高兆银, 等. 一种火龙果腐烂病病原菌鉴定及生物学特性研究[J]. 热带作物学报, 2012, 33(11): 2 044-2 048.
[13] 郭力维, 吴毅歆, 何汉兴. 云南省火龙果采后果腐病研究[J]. 果树学报, 2014, 31(1): 111-114.
[14] 朱迎迎, 胡美姣, 陈 亮. 火龙果采后病害与防控技术研究进展[J]. 中国热带农业, 2014(4): 55-58.
[15] Ben-Zeev I S, Assouline I, Levy E, et al. First report of Bipolaris cactivora causing fruit blotch and stem rot of dragon fruit(pitaya)in Israel[J]. Phytoparasitica, 2011, 39(2): 195-197.
[16] 李 敏, 胡美姣, 高兆银, 等. 火龙果黑斑病菌[Bipolaris cactivora(Petrak)Alcorn]生物学特性研究[J]. 热带作物学报, 2013, 34(9): 1 770-1 775.
[17] 邵力平, 沈瑞祥, 张素轩, 等. 真菌分类学[M]. 北京: 中国林业出版社, 1984: 250-300.
[18] 張中义, 冷怀琼, 张志铭, 等. 植物病原真菌学[M]. 成都: 四川科学技术出版社, 1988: 400-460.
[19] White T J, Bruns T, Lee S, et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics[M]//Innis M A, Gelfand D H,Sninsky J J.(eds.)PCR Protocols: A Guide to Methods and Applications, New York, Academic Press, 1990: 315-322.
[20] Carbone I, Kohn L M. A method for designing primer sets for speciation studies in filamentous ascomycetes[J]. Mycologia, 1999: 91(3): 553-556.
[21] 沈 萍, 陈向东. 微生物学实验[M]. 北京: 高等教育出版社, 2007.
[22] Penzig A G O. Funghi agrumicoli. Contribuzione allo studio dei funghi parassiti degli agrumi[J]. Michelia, 1882(2): 385-508.
[23] Wollenweber, Reinking. Fusaria autographice delineata[M]. Berlin: Selbstverlag, 1930.
[24] Schroers H J, Donnell K O. Taxonomy and phylogeny of the Fusarium dimerum species group[J]. Mycologia, 2009, 101(1): 44-70.
[25] Domsch K H, Gams W, Anderson T. Compendium of soil fungi[M]. 2nd ed. Eching, Germany: IHW-Verlag. 2007, 672.
[26] 桑利伟, 郑服丛. 我国香蕉的主要病害及防治[J]. 安徽农业科学, 2006, 34(9): 1 841-1 845.
[27] 曹雪梅. 甘草根腐病病原学研究及室内药剂筛选[D]. 扬凌: 西北农林科技大学, 2013.
[28] 候思雯. 甘肃高寒阴湿地区蚕豆苗期根腐病的研究[D]. 兰州:甘肃农业大学, 2011.
[29] 刘小娟. 甘肃高寒阴湿地区豌豆根腐病病原鉴定及品种抗性的评价[D]. 兰州: 甘肃农业大学, 2012
[30] Eken C, Hasenekolub I. First report of Fusarium dimerum on Solanum tuberosum in Turkey[J]. Plant Pathology, 2008, 57: 378.
[31] Hennequin C, Abachin E, Symoens F, et al. Identification of Fusarium species involved in human infections[J]. Clinic Microbiol, 1999, 37: 3 586-3 589.
[32] Summerbell R C. Pathogenic Fungi in Humans and Animals 2nded[M]. New York: Marcel Dekker Press. 2003: 237-498.
[33] Ma T F, Yang B, Yu Y, et al. Market disease pathogens detection of imported fruits in Shanghai[J]. Agricultural Sciences in China, 2009, 8(9): 1 087-1 096.
責任编辑:凌青根
