高考图像题解答方法攻略
2016-05-30雷范军吴惠华
雷范军 吴惠华
高考化学图像题能将深奥的化学理论知识巧妙地融入其中,每年所设计的图像新颖、情境陌生,常出现在选择、填空、简答、实验、计算等题型之中,且区分度良好。由于所涉及知识的覆盖面广、综合性强,学生往往有所畏惧,不擅长回答此类型题。对于高考化学图像题的解答,学生普遍感到困惑,得分较低。下面以近年高考化学图像题为例,梳理其主要类型及解题方法和技巧,以帮助同学们复习备考。
一、化学反应能量变化图像
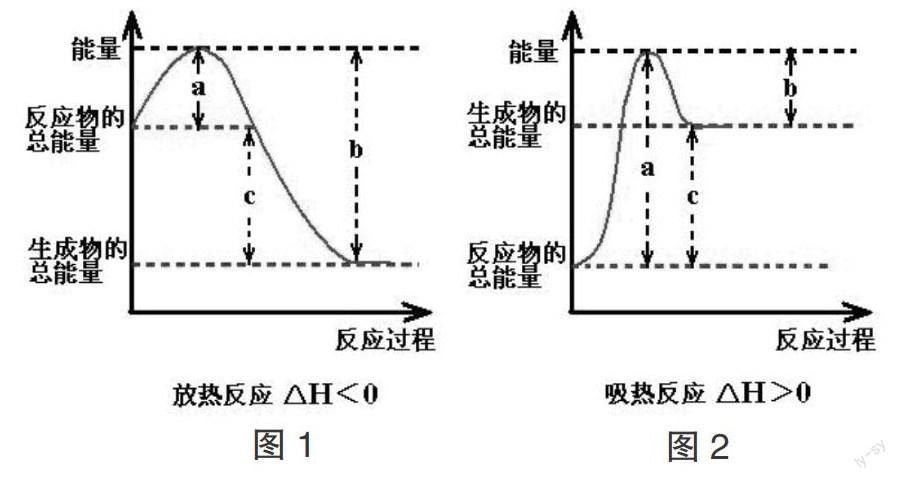
根据化学反应的过渡态理论可知,放热反应和吸热反应过程中体系能量变化的一般规律如下图:
① a=过渡态物质的能量-反应物的总能量,表示断裂旧化学键吸收的热量,也可以表示(正)反应的活化能;② b=过渡态物质的能量-生成物的总能量,表示新化学键生成放出的热量,也可以表示活化分子变为生成物所释放的能量或逆反应的活化能;③ 图中c表示反应的反应热,可通过计算焓变值求得反应热:a.从物质所具有的焓角度分析,焓变(ΔH)为生成物的焓与反应物的焓之差:ΔH=H(生成物)-H(反应物);b.从化学键角度分析,焓变为反应物的总键能与生成物的总键能之差:ΔH=E(反应物)-E(生成物)=a-b(用图中符号填空);c.从正逆反应的活化能角度分析,焓变为正反应的活化能与逆反应之差:ΔH=E(正反应)-E(逆反应)=[H(过渡态物质)-H(反应物)]-[H(过渡态物质)-H(生成物)]。
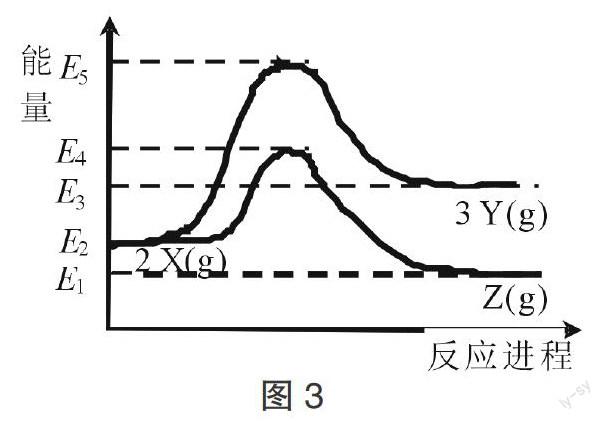
【例1】(2016·海南,11)由反应物X转化为Y和Z的能量变化如图3所示。下列说法正确的是( )
A. 由X→Y反应的ΔH=E5-E2
B. 由X→Z反应的ΔH < 0
C. 降低压强有利于提高Y的产率
D. 升高温度有利于提高Z的产率
解析:根据反应体系能量变化示意图、活化能、反应物总能量、生成物总能量、焓变可知,X→Y反应的ΔH=H(反应产物)-H(反应物)=E3-E2,X→Y反应的活化能=E5-E2,故A错误;读图可知,E5 > E4 > E3 > E2 > E1 > 0,则X→Z[或2 X(g)?Z(g)]反应的ΔH=H(反应产物)-H(反应物)=E1-E2 < 0,故B正确;由题意可知,2 X(g)?3 Y(g)的正反应是气体体积增大的方向,由勒夏特列原理可知,其它条件不变时,降低压强能使2 X(g)?3 Y(g)的化学平衡正向移动,因此能提高生成物Y的产率,故C正确;2 X(g)?Z(g)的正反应是ΔH < 0的放热反应,由勒夏特列原理可知,其它条件不变时,升高温度能使2 X(g)?Z(g)的化学平衡逆向移动,因此能降低生成物Z的产率,故D错误。
答案:BC
点拨:解答此类试题,关键是了解化学反应过渡态理论模型、活化能、焓变等基本概念和基本理论。反应物的能量若高于生成物的能量就是放热反应,生成物的能量若高于反应物的能量就是吸热反应。看清反应物、生成物的能量的高低,掌握反应的热效应的含义及反应原理,是解决本题的关键。
二、同一反应体系中某(或各)物质量的变化图像
该类图像题往往涉及化学反应速率、化学平衡的有关问题。体系中某(或各)种物质量的变化关系通过曲线给出,解决该类试题的关键是分析曲线中的特殊点,如起点、突变和渐变的先后、平衡点等变化数据之间的关系以及了解化学平衡建立的过程。
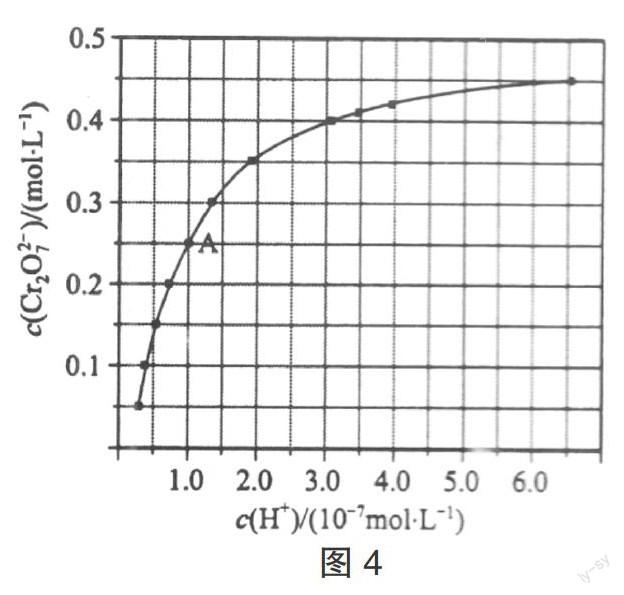
【例2】(2016·全国课标I,27(2))CrO42-和Cr2O72-在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图4所示。
① 用离子方程式表示Na2CrO4溶液中的转化反应 。
② 由图可知,溶液酸性增大,CrO42-的平衡转化率 (填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为 。
③ 升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH (填“大于”“小于”或“等于”)。
解析:① Na2CrO4溶液中的转化反应不涉及化合价升降,不属于氧化还原反应,可以根据电荷守恒、原子个数守恒或设Cr2O72-的系数为1法配平,则2 CrO42- + 2 H+ ? Cr2O72- + H2O;② 读图可知,随着横坐标所代表的c(H+)逐渐增大,溶液的酸性增强,纵坐标所代表的c(Cr2O72-)逐渐增大,说明2 CrO42- + 2 H+ ? Cr2O72- + H2O的化学平衡右移,因此使CrO42-的平衡转化率增大;A点的横、纵坐标的数值为1.0×10-7、0.25,CrO42-的初始浓度为1.0 mol·L-1,根据三行数据法推断如下:
③由勒夏特列原理可知,升温能使化学平衡向吸热反应方向移动,由溶液中CrO42-的平衡转化率减小可知,2 CrO42- + 2 H+ ? Cr2O72- + H2O的化学平衡向逆反应方向移动,由上述结论可知,逆反应是吸热反应,进而推断正反应是放热反应,因此该反应的ΔH小于0。
答案:① 2 CrO42- + 2 H+ ? Cr2O72- + H2O ② 增大 1.0×1014 ③ 小于
点评:本题属于只有一个自变量和一个因变量的图像题,随着一个变量的变化,根据曲线的走势可以判断化学平衡移动的方向,因此确定平衡转化率的变化。根据起始浓度及曲线中某点的横纵坐标的值,利用三行数据法可以计算有关组分的平衡浓度,进而计算该指定条件下的平衡常数。基本步骤为:书写(写出有关化学平衡的化学反应方程式)→列变量(列出各物质的起始、变化、平衡量)→计算(根据已知条件列方程式计算)。
三、多变量化学平衡图像
多条件变量图像是指某一变量或某些变量在不同条件下的变化关系,这类图像往往表现为多条曲线并存,解题时关键是分析这些曲线变化的相同点和不同点,根据条件的不同,结合化学原理,作出解答。
【例3】(2016·全国课标II,27(2)(3))丙烯腈(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。主要副产物有丙烯醛(CH2=CHCHO)和乙氰(CH3CN)和副产物丙烯醛(C3H4O)的热化学方程式如下:
(1)图5为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。低于460℃时,丙烯腈的产率
(填“是”或“不是”)对应温度下的平衡转化率,判断理由是 ;高于460℃时,丙烯腈产率降低的可能原因是 (双选,填标号)。
A. 催化剂活性降低 B. 平衡常数变大
C. 副反应增多 D. 反应活化能增大
(2)丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图6所示。由图可知,最佳n(氨)/n(丙烯)约为 ,理由是 。进料气氨、空气、丙烯的理论体积比约为 。
解析:(1)反应①的正反应是气体体积增大的放热反应,如果已经达到化学平衡状态,当投料比、压强、浓度等变量不变时,升温能使平衡逆向移动,丙烯晴的产率会减小,读图可知,低于460℃时,丙烯腈的产率不是对应温度下的平衡产率;温度高于460℃,催化剂活性可能降低,导致丙烯晴产率降低,A项正确;反应①的正反应是放热反应,升温使平衡逆向移动,平衡常数逐渐变小,B项错误;温度高于460℃,反应②或副反应进行程度可能增多,反应①进行程度减少,导致丙烯晴产率降低,C项正确;反应活化能与催化剂有关,与温度、压强、浓度等改变无关,升温,反应活化能不变,D项错误;(2)读图可知,最佳n(氨)/n(丙烯)约为1.0,因为该比例下丙烯晴产率最高,而副产物丙烯醛产率最低;由反应①的热化学方程式、阿伏加德罗定律的推论可知,进料气中氨、氧气、丙烯气体的理论体积之比等于方程式中对应的化学计量系数之比,即1 ∶ 1.5 ∶ 1,空气中氧气的体积分数约为1/5(氮气约占4/5),则进料气氨、空气、丙烯的理论体积比约为1 ∶ [][-][1.5] ∶ 1=1 ∶ 7.5 ∶ 1 。
答案:(1)不是 该反应为放热反应,平衡转化率随温度升高而降低 AC
(2)1 该比例下丙烯晴产率最高,而副产物丙烯醛产率最低 1 ∶ 7.5 ∶ 1
点评:有关化学平衡图像的试题涉及知识面广、灵活性大,大多注重对学生的知识综合应用能力和分析判断能力的考查,其将数学知识和化学平衡理论融为一体,体现新课改的要求。本题涉及热化学方程式、速率和平衡图像、外界条件(投料比、浓度、温度、压强、催化剂等)对化学反应速率和化学平衡的影响,侧重考查学生对知识的理解及综合运用能力。
四、溶液导电性图像
溶液的导电性与溶液中离子浓度大小和所带的电荷数有关。只有温度、浓度相同的强、弱电解质溶液的导电能力才有可比性。浓度不同时,难溶的强电解质在水溶液中的导电能力甚至弱于弱电解质。相同浓度的强电解质的导电性明显强于弱电解质,弱酸(碱)与弱碱(酸)反应生成了强电解质,溶液的导电性增强。
【例4】(2016·北京,11)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图7所示。下列分析不正确的是( )
A. ①代表滴加H2SO4溶液的变化曲线
B. b点,溶液中大量存在的离子是Na+、OH-
C. c点,两溶液中含有相同量的OH-
D. a、d两点对应的溶液均显中性
解析:由酸、碱、盐的性质可知,两份溶液中反应式分别为H2SO4 + Ba(OH)2=BaSO4↓ + 2H2O、NaHSO4 + Ba(OH)2=BaSO4↓ + H2O + NaOH和NaHSO4 + NaOH=Na2SO4 + H2O,当H2SO4和Ba(OH)2 恰好中和完全时,由于生成的硫酸钡难溶、水难电离,则溶液的导电性降低程度最大(几乎为0),而NaHSO4和Ba(OH)2中和时,生成的NaOH或Na2SO4易溶且易电离,溶液的导电性降低且会呈现两个拐点(一定大于0),则①代表滴加H2 SO4溶液的变化曲线,②代表滴加NaHSO4溶液的变化曲线,故A正确;b点,只发生反应NaHSO4 + Ba(OH)2=BaSO4↓ + H2O + NaOH,且NaHSO4和Ba(OH)2 均无剩余,所得溶液含有NaOH,故B正确;c点,曲线①代表过量的硫酸溶液(呈酸性),曲线②则发生反应NaHSO4 + NaOH=Na2SO4 + H2O且NaOH过量,所得溶液呈碱性,则前者所含OH-少于或者,故C错误;a、d两点的溶质分别是BaSO4、Na2SO4,分别是难溶、易溶的强酸强碱盐,均不能水解,因此溶液均呈中性,故D正确。
答案:C
点评:本题属于两线图像题,涉及强碱溶液与强酸、强酸酸式盐溶液混合过程中溶液导电性的对照实验。根据题目所给信息和图像信息,提取“起点”“折点”“终点”的纵、横坐标数据,结合相关的化学反应原理,写出可能发生反应的化学方程式或离子方程式,根据反应中生成的水和沉淀的量,探究化学反应的本质。“折点”越多,表示分步发生的化学反应越多,每个“折点”代表不同的含义。②中第一个“折点”表示第一个反应已经完成,第二个反应开始发生。而①中只含一个“折点”,说明只发生一个复分解反应。
五、酸碱中和滴定曲线
向一定体积一定浓度的酸(或碱)溶液中滴人一定体积碱(或酸)溶液时的pH变化曲线也是高考的热点之一,解题的关键在于能准确分析坐标曲线图中所标点的化学含义。坐标图上的曲线是满足一定条件的点的集合,其中有些特殊点(如曲线的起点、顶点、转折点、交叉点等)隐含着某些限制条件或某些特殊的化学含义,明确它们的含义,有助于快速、准确地提取有效信息,再经过分析判断,得出相应的结论。
【例5】(2016·天津,6)室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol·L-1的三种酸(HA、HB和HD)溶液,滴定的曲线如图8所示,下列判断错误的是( )
A. 三种酸的电离常数关系:KHA > KHB > KHD
B. 滴定至P点时,溶液中:c(B-) > c(Na+) > c(HB)> c(H+)> c(OH-)
C. pH=7时,三种溶液中:c(A-)=c(B-)=c(D-)
D. 当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)
解析:当中和百分数为0时,0.1mol·L-1的三种酸(HA、HB和HD)溶液的pH:1 < HA < HB < HD,说明酸性或电离程度:HA > HB > HD,则电离常数:KHA > KHB > KHD,且KHB=≈10-5,KHD=≈10-7,故A正确;NaOH滴定HB至P点时,HB一半被消耗,一半未被消耗,溶液中溶质为NaB、HB,且NaB、HB的浓度相等,由于HB的电离常数KHB=≈10-5,而NaB的水解常数Kh==10-9,则NaB的水解程度小于HB的电离常数,因此溶液中:c(B-) > c(Na+) > c(HB) > c(H+) > c(OH-),故B正确;当加入等体积等浓度NaOH溶液时,中和百分数达100%,所得溶质分别为NaA、NaB、NaD,由于酸性:HA > HB > HD,则三种盐的水解程度:NaA < NaB < NaD,溶液的pH:7 < NaA < NaB < NaD,由此推断,当pH=7时,加入的NaOH的量:HA > HB > HD,则所得盐的量:NaA > NaB > NaD,则c(Na+) 不相等,由电荷守恒原理可知,c(A-)、c(B-)、c(D-)不相等,故C错误;由质子守恒原理可知,c(H+) + c(HA)+c(HB)+c(HD)=c(OH-),故D正确。
答案:C
点评:离子浓度的大小比较问题是中学化学中的难点问题。这类问题一般有两种考查方式:离子浓度大小排序和离子浓度守恒关系。其中解答离子浓度大小排序问题时要遵守以下三个原则:①弱电解质的电离、盐类的水解(除双水解反应外)的程度微弱(通常在10%以内);②多元弱酸分步电离,且逐级减弱;③多元弱酸根也分步水解,且逐级减弱。解答离子浓度守恒关系问题也有三种思路:①电荷守恒(溶液电中性原理);②质子守恒;③原子守恒(物料守恒)。
六、溶液中部分微粒的物质的量浓度随pH的变化曲线
溶液中部分微粒的物质的量浓度随pH的变化曲线是比较复杂的化学图像题之一,解答时需要弄清坐标系中横坐标、纵坐标的含义,认识几种粒子浓度与溶液pH的关系。
【例6】(2016·江苏,14)H2C2O4为二元弱酸。20℃时,配制一组c(H2C2O4) + c(HC2O4-) + c(C2O42-)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图9所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( )
答案:BD
点评:比较离子浓度的大小关系时,经常要用到物料守恒、电荷守恒、质子守恒三大守恒关系。
七、热重曲线
热重曲线也是高考中的常考题型之一,常以综合题的形式出现。解答这类试题时,应灵活使用质量守恒定律,根据质量变化确定剩余固体的成分,由此推断有关反应的方程式。
【例7】(2014·新课标II,27(4))铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。PbO2在加热过程发生分解的失重曲线如图10所示,已知失重曲线上的a点为样品失重的4.0%(即样品起始质量-a点固体质量/样品起始质量×100%)的残留固体。若a点固体组成表示为PbOx或
mPbO2 ·nPbO,列式计算x值和m∶n值 。
解析:根据PbO2[△][=] PbOx+O2↑,1 mol PbO2受热分解失去的重量为mol×32g·mol-1=1mol ×239g·mol-1×4.0%,解得:x=2-=1.4;根据mPbO2 ·nPbO的组成可知, n(O): n(Pb)=(2m+n):(m+n)=1.4,解得:==。
答案:设起始时PbO2为1 mol ,根据PbO2 [△][=] PbOx + O2↑可知其受热分解失去的重量为mol×32g·mol-1=1mol ×239g·mol-1×4.0%,解得:x=2- =1.4;根据mPbO2 ·nPbO的组成可知, n(O):n(Pb)=(2m+n):(m+n)=1.4,解得:==。
点评:不管是哪种类型的图像,分析问题时都应该注意以下三个关键点:一是读图,明确图像含义,通过观察弄清横坐标、纵坐标的含义及单位,搞清特殊点的意义,分析曲线的变化趋势等,将图像和具体化学反应等联系起来。二是识图,进行信息提取,挖掘隐含信息,排除干扰信息,提炼有用信息,在统摄信息的基础上进行逻辑推理或运用数据计算。三是用图,联系化学原理最终解决问题。
八、沉淀的变化图像
解析:由最高正价=主族序数和图中信息可知,x、e分别是第IA族的氢、钠;由最低负价+8=主族序数和图中信息可知,d、g分别是第VIA族的氧、硫;由同周期主族元素原子半径由大到小的顺序推断,y、z分别是第二周期的碳、氮,f、h分别是铝、氯,则R为NH4Al(SO4)2,该盐在水中完全电离:NH4Al(SO4)2=NH4+ + Al3+ + 2 SO42-,碱性:NH3·H2O > Al(OH)3,则水解程度:Al3+ > NH4+,则平衡时该溶液中离子浓度由大到小的顺序是:c(SO42-) > c(NH4+) > c(Al3+) > c(H+) > c(OH-);由于水解程度:Al3+ > NH4+,则Al3+ 优先与滴入的NaOH溶液反应,当Al3+完全变为沉淀后,NH4+才能与继续滴入的NaOH溶液反应,生成一水合氨;当NH4+也完全反应之后,继续滴入的NaOH溶液才能逐渐溶解之前生成白色沉淀;图中NaOH溶液体积在0~30 mL时,反应为Al3+ + 3OH-=Al(OH)3↓;NaOH溶液体积在30~40 mL时,反应为NH4+ + OH-=NH3·H2O;NaOH溶液体积在40~50 mL时,反应为Al(OH)3 + OH-=AlO2- + 2H2O;由c·V可知,n[NH4Al(SO4)2]=0.01 mol,n[Ba(OH)2]=0.024 mol,由NH4Al(SO4)2=NH4+ + Al3+ + 2 SO42-可知,NH4+ 、Al3+、SO42-分别为0.01 mol、0.01 mol、0.02 mol,由Ba(OH)2=Ba2+ + 2 OH-可知,Ba2+、OH-分别为0.024 mol、0.048 mol;由Al3+ + 3OH-=Al(OH)3↓、NH4+ + OH-=NH3·H2O、Al(OH)3 + OH-=AlO2- + 2H2O可知,0.01 mol Al3+完全转化为0.01 mol Al(OH)3沉淀需消耗0.03 mol OH-,0.01 molNH4+完全转化为0.01 mol NH3·H2O需消耗0.01 mol OH-,因此只有0.048 mol -0.03 mol - 0.01 mol=0.008 mol OH-能溶解0.008 mol Al(OH)3,还有0.01mol-0.008mol=0.002 mol Al(OH)3过量,除了阳离子之外,由SO42- + Ba2+=BaSO4↓可知,还有0.02 mol SO42-与0.02 mol Ba2+反应生成0.02 mol BaSO4沉淀,还有0.024 mol–0.02 mol=0.004 mol Ba2+过量;因此,最终沉淀为0.02 mol BaSO4和 0.002 mol Al(OH)3,共0.022 mol沉淀。
答案: ① c(SO42-)> c(NH4+) > c(Al3+)> c(H+) > c(OH-)
② NH4+ + OH-=NH3·H2O ③ 0.022
点评:这类题型常以物质的化学性质,特别是化学特性为基点进行命题。如 Al(OH)3等铝的化合物的两性,不同价态铁之间的转化关系等。解答这类试题的关键是:(1)根据溶液中离子的种类确定反应的先后顺序,判断何时产生沉淀,何时沉淀溶解,找到沉淀生成和溶解的关键点,然后将化学反应和图像进行比对,由此确定答案;(2)要掌握物质的化学性质(或特性),注意不同物质化学性质的差异,根据相关量的关系进行分析讨论。
责任编辑 李平安
