一株产聚-β-羟基脂肪酸酯嗜盐菌的筛选与鉴定1)
2016-05-30王海飙刘长莉刘润泽常乐王珺
王海飙 刘长莉 刘润泽 常乐 王珺
(东北林业大学,哈尔滨,150040)
一株产聚-β-羟基脂肪酸酯嗜盐菌的筛选与鉴定1)
王海飙刘长莉刘润泽常乐王珺
(东北林业大学,哈尔滨,150040)
摘要以大庆地区盐碱土壤为样品经苏丹黑B染色、尼罗蓝染色分离出6株具有聚-β-羟基脂肪酸酯(PHA)合成能力的菌株,选取产量较高的DQ-4进行鉴定,通过细菌形态学鉴定、16S rRNA分析并结合其生理生化特性,将菌株DQ-4鉴定为嗜盐单胞菌(Halomonas sp.)。GC-MS分析表明,菌株DQ-4合成的聚合物具有与PHA标样相似的峰值。FT-IR分析显示,菌株DQ-4合成的聚合物在1 726、2 980、2 934、2 876 cm-1处出现了PHA的特征性吸收峰。因此,将其产物确定为PHA类化合物。菌株DQ-4的最适生长条件,温度38 ℃、pH值=9、转速160 r·min-1、500 mL锥形瓶的装液量为100 mL,此条件下菌株DQ-4的PHA产量可达5.88 g·L-1。
关键词聚-β-羟基脂肪酸酯;嗜盐菌;红外光谱
分类号Q939.99
Isolation and Identification of A PHA-accumulating Halophilic Bacterium and Its Growth Characteristics//
Wang Haibiao, Liu Changli, Liu Runze, Chang Le, Wang Jun
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2016,44(5):97-100,107.
Six PHA-accumulating strains were isolated with the usage of Sudan black stain, Nile blue staining from saline soil in the region of Daqing, China. Impressing on bacteria morphology salinity resistance, combined with the analysis of the 16S rRNA, a higher strain named DQ-4 was identified asHalomonassp.. The product of strain DQ-4 was similar with PHA standard by GC-MS. The FT-IR spectra of strain DQ-4 had a characteristic sharp absorption band around 1 726, 2 980, 2 934 and 2 876 cm-1. The optimal growth conditions for strains of DQ-4 are 38 ℃ temperature, pH value of 9, the speed of 160 r·min-1, and the fluid volume of 100/500 mL in flask with the PHA synthesis of 5.88 g·L-1.
KeywordsPHA; Halomonas; FT-IR
随着人类社会的快速发展,以石油等化石能源为原料的塑料制品被大量使用,带来了巨大的环境问题,同时化石燃料的不断枯竭,寻找一种环境友好的、可降解的新型塑料成为科研热点。聚-β-羟基脂肪酸酯(PHA)是一种能够自然降解的环境友好型生物塑料高分子化合物,近年来发展迅速并被重点关注。同时,PHA也是微生物体内的碳源和能源贮藏物质[1],其某些热力学性质与传统的热塑性材料如聚丙烯等极其相似[2],又因其可以通过糖、脂肪酸等可再生资源进行合成,因此又被称为“21世纪的绿色材料”。
目前已经验证可以合成PHA及其系列化和物的菌株主要有:真养产碱杆菌、重组大肠杆菌[3]、巨大芽孢杆菌[4]、拜氏固氮菌[5]、嗜盐菌[6]等数十种微生物。在实际工业生产中,为了降低生产成本,筛选出低成本的PHA合成菌株成为研究的主要方向。
嗜盐菌是一类常见的嗜极微生物,能够适应较高的渗透压,即在盐质量浓度>3.5 g·L-1的超盐质量浓度下生活[7]。而且在较高的盐质量浓度下,其他微生物难以生长,因此可以利用嗜盐菌的嗜盐特性抑制其他微生物生长。采用嗜盐菌作为聚-β-羟基脂肪酸酯的生产平台能够省去灭菌环节,进而大幅降低生产成本。
1材料与方法
1.1土壤样品
土样采集自黑龙江省大庆市红岗区杏四排路北的盐碱地。
1.2培养基
初筛培养基(PCS培养基):羧甲基纤维素钠5.0 g,牛肉膏5.0 g,蛋白胨10.0 g,酵母粉1.0 g,NaCl 60.0 g·L-1,琼脂20.0 g。
发酵培养基:选用矿物盐培养基[3],葡萄糖60.0 g·L-1,NaCl 60.0 g·L-1,以NaOH调节pH值为9。
1.3产PHAs嗜盐菌株的筛选与鉴定
初筛。将稀释后的土壤样品涂布于初筛培养基上,将获得的菌株进行尼罗蓝染色和苏丹黑B染色观察。
复筛。分别将初筛的菌株挑入发酵培养基中进行培养,37 ℃、170 r·min-1震荡培养48 h,用次氯酸钠/氯仿法[8]提取PHAs,并进行产量测定。
菌株形态及生理生化特征鉴定。对菌株进行革兰氏染色、芽孢染色和鞭毛染色。利用细菌微量生化反应管对菌株进行硝酸盐培养基生长、糖发酵产酸、淀粉水解、柠檬酸盐利用、硝酸盐还原等生理生化试验,依据《常见细菌系统鉴定手册》[9]和《伯杰氏细菌鉴定手册(第9版)》[10]进行常规生理生化鉴定。
细菌16S rRNA基因序列分析和系统发育树的构建。菌株基因组采用细菌DNA提取试剂盒提取(北京庄盟试剂公司),以细菌总DNA为模板,利用细菌通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTGTTACGT-3’)进行PCR扩增。反应体系及条件参照说明书。用1%琼脂糖凝胶电泳检测扩增产物的大小和特异性。PCR产物纯化后,用胶回收试剂盒回收目的片段,并与pMD18-T连接,转化E.coliJM109,然后在含有氨苄霉素(AMP)的培养基中挑取白色单菌落(阳性转化子)进行PCR扩增。将阳性克隆子送至北京金唯智公司进行测序,测序所获序列信息提交GenBank,利用BLAST程序进行比对,选择高同源性序列,采用MEGA5.2软件进行系统发育分析,并构建系统进化树。进化树分支稳定性用Bootstrap分析,重复1 000次。
1.4菌株DQ-4的发酵条件优化
培养温度对DQ-4生长的影响。分别在26、28、30、32、34、36、38、40 ℃条件下利用发酵培养基(pH=7)摇瓶发酵DQ-4,摇床转速为160 r·min-1,装液量为100 mL(500 mL锥形瓶中)。培养60 h后测得菌体干质量及PHA合成量。
初始pH值对DQ-4生长的影响。设置pH梯度为7、8、9、10,在36 ℃,摇床转速为160 r·min-1的条件下,按装液量为100 mL(500 mL锥形瓶中)进行发酵试验。培养60 h后测定菌体干质量及PHA合成量。
摇床转速对DQ-4生长的影响。在菌株DQ-4发酵过程中选用不同转速(100、120、140、160、180 r·min-1)进行发酵培养,培养温度为36 ℃,培养基pH值为9。培养60 h测定菌体干质量及PHA合成量。
装液量对DQ-4生长的影响。分别于500 mL锥形瓶中加入50、100、150、200 mL培养基,pH值为9,转速160 r·min-1,培养60 h后测定菌体干质量及PHA合成量。
对上述数据采用SPSS 21.0软件进行统计学分析,通过描述统计以及方差分析对数据进行处理,采用Duncan检验进行多重比较。
1.5菌株DQ-4的产物分析
GC-MS分析。分别称取一定量PHA标准物(Sigma)和提取出的聚合物于酯化管中,加入2 mL体积分数为15%的浓硫酸的甲醇溶液和2 mL氯仿(含0.5 g·L-1苯甲酸甲酯),100 ℃加盖密封反应3 h。反应结束冷却后,加入1 mL去离子水,振荡均匀,离心分层(3 500 r·min-1、10 min)。取下层氯仿相进行气质联机分析。
进样量为1 μL;气化室温度为260 ℃,检测器温度为300 ℃;初始柱温80 ℃,停留1.5 min后,以30 ℃·min-1的速度升温至240 ℃,停留2 min;载气为高纯氦气,流速为30 mL·min-1,分流比为30∶1。
FT-IR分析。参照文献[11],取提纯的聚合物样品,以KBr压片,利用美国PerkinElmer公司的Spectrum100型傅立叶红外光谱仪测定红外吸收光谱(FT-IR)。
2结果与分析
2.1产PHAs菌株筛选
初筛。将从土壤样品中分离的菌落接入初筛培养基,经苏丹黑染色,在光学显微镜下,以视野内黑色颗粒聚集多寡为标准进行筛选。选取细胞中黑色颗粒大、数量多的菌株移入尼罗蓝培养基培养,在紫外灯下挑取具有荧光的单菌落,获得6株具有PHAs合成能力的菌株。
复筛。将上述6株菌株接入发酵培养基中,48 h后测定PHAs干质量比,结果见表1。经过比较后,选取菌株DQ-4进行进一步研究。

表1 产PHAs菌株的复筛结果
2.2菌株鉴定
2.2.1菌株的形态学及生理生化鉴定
菌株DQ-4在光学显微镜下可见杆状,在PCS固体培养基上可见菌落呈乳白色,边缘整齐,细菌革兰氏染色为阴性。利用电镜对菌株进行观察,菌株DQ-4呈杆状、无鞭毛,长约500 nm。菌株DQ-4能够利用葡萄糖、果糖、蔗糖、麦芽糖、甘露糖,还可利用酵母抽提物以及羧甲基纤维素钠(CMC),证明其有一定的纤维素分解能力。菌株DQ-4的丙二酸盐、西蒙氏枸缘酸盐试验呈阳性,不能还原硝酸盐、不能产生H2S,不能液化明胶,嗜盐性试验阳性。以上特征与嗜盐菌相符。
2.2.2菌株DQ-4的分子生物学鉴定
对菌株DQ-4进行16S rDNA鉴定,获得了1条1 354 bp的序列,将测序所获序列信息提交GenBank,获取登录号为KT961118。利用BLAST程序进行比对,选择高同源性序列,采用MEGA5.2软件进行系统发育分析,并构建系统进化树。进化树分支稳定性用Bootstrap分析,重复1 000次。获得进化树(图1)。由图1可以看出,菌株DQ-4与Halomonaselongata处在同一分支,结合生理生化分析、细菌形态将菌株DQ-4鉴定为嗜盐单胞菌(Halomonassp.)。

图1 菌株DQ-4的系统发育树
2.3菌株DQ-4的生长特性
2.3.1培养温度对DQ-4生长的影响
如表2所示,菌株DQ-4在26~40 ℃均可生长。在26~38 ℃,随培养温度的升高菌株DQ-4的生长及PHA的积累量均有所升高。方差分析表明,温度对PHA的合成量有极显著影响(F=89.674,显著性p<0.001)。Duncan检验表明,在38 ℃时,PHA的合成量显著高于其余温度水平,此时PHA合成量占菌体干质量的60.46%,随温度的继续上升,细菌的生长量及PHA积累量开始下降。
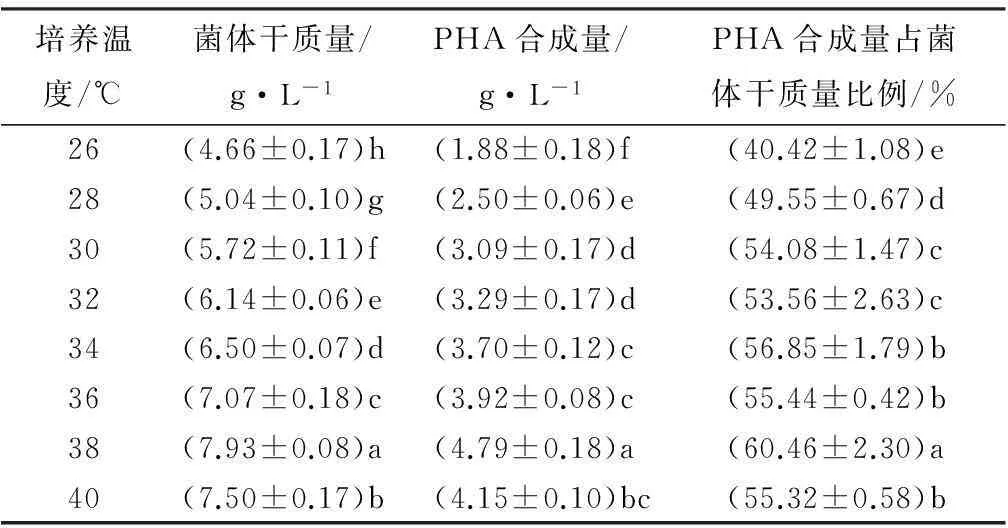
表2 培养温度对菌株DQ-4的生长及PHA积累的影响
注:表中数据为平均值±标准差;同列数字后不同字母表示差异显著(p<0.05)。
2.3.2pH值对DQ-4生长的影响
嗜盐菌一般具有耐碱性,在试验范围内,如表3所示,菌株最高可在pH为11时生长,但是菌株生长情况欠佳且PHA积累量极低,说明过高的pH值抑制了菌株对PHA的积累。方差分析表明,pH值对PHA合成量的影响差异极显著(F=436.568,p<0.001)。经过Duncan检验可知,在pH值为9时,最适于PHA的合成,此时细菌生长量和PHA积累量同步达到最大。
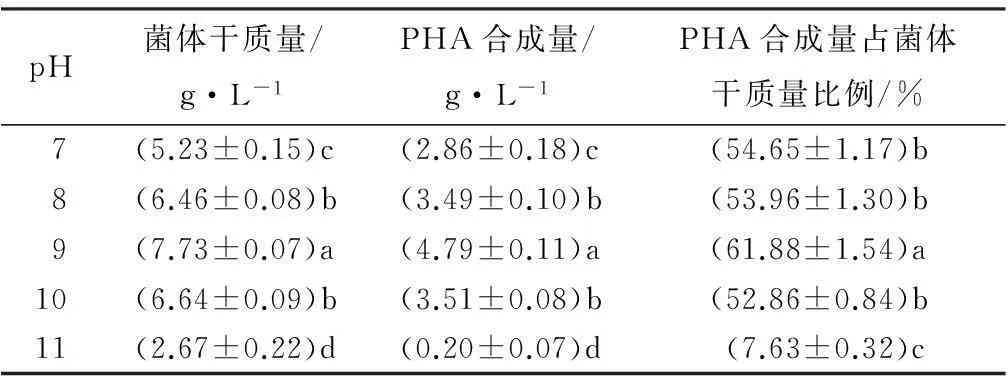
表3 初始pH值对菌株DQ-4的生长及PHA积累的影响
注:表中数据为平均值±标准差;同列数字后不同字母表示差异显著(p<0.05)。
2.3.3转速对DQ-4生长的影响
由表4所示,在100~180 r·min-1,摇床转速的升高可以促进菌株生长。方差分析表明,摇床转速对PHA合成量有极显著影响(F=160.204,p<0.001)。经过Duncan检验可知,转速为160 r·min-1时PHA的积累差异性最明显,此时PHA的积累量为4.71 g·L-1,占菌体干质量的70.6%,较转速为100 r·min-1时提高了34.92%。
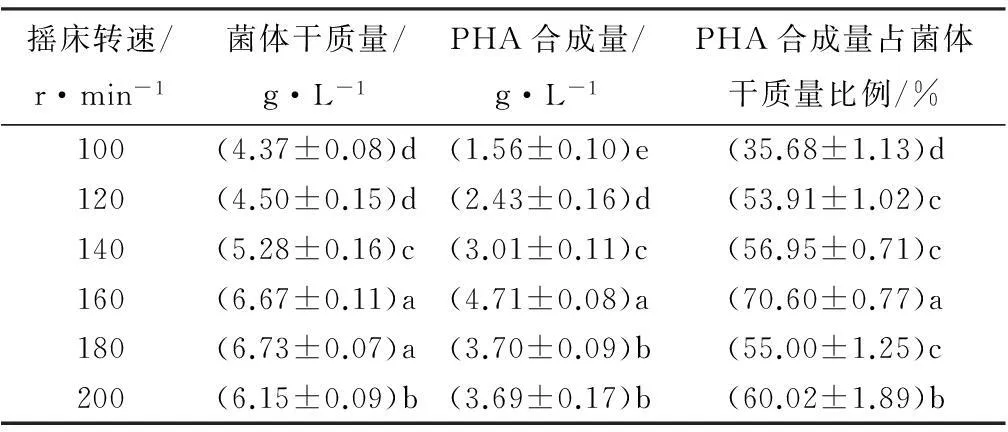
表4 摇床转速对菌株DQ-4的生长及PHA积累的影响
注:表中数据为平均值±标准差;同列数字后不同字母表示差异显著(p<0.05)。
2.3.4装液量对DQ-4生长的影响
如表5所示,随装液量的升高菌株的生长量逐渐降低。较低的装液量有利于氧气的供应,这表明了菌株DQ-4的好氧性。但过低的装液量导致菌株徒长而不利于PHA的积累。方差分析表明,装液量对PHA合成量的影响差异极显著(F=72.708,p<0.001)。经过Duncan检验可知,在100 mL(500 mL锥形瓶中)进行发酵时PHA的值显著高于其余装液量水平的值。此时菌体的PHA积累量达4.30 g·L-1,占菌体干质量的58.12%。
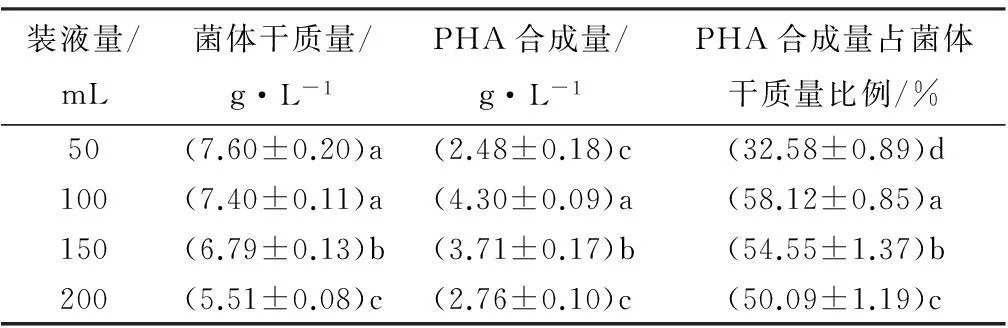
表5 不同装液量下菌株DQ-4的生长及PHA积累情况
注:表中数据为平均值±标准差;同列数字后不同字母表示差异显著(p<0.05);装液量指500 mL锥形瓶中的液体体积。
2.3.5优化发酵条件下菌株DQ-4的生长曲线及PHA合成特征
按上述试验结果,调整培养基初始pH为9,装液量为100 mL(500 mL锥形瓶中),在38 ℃、160 r·min-1的条件下培养DQ-4,获得如图2所示的菌株生长曲线及PHA合成量变化情况。菌株DQ-4在接种后的6 h处于延滞期,16 h后进入对数生长期,同时开始积累PHA,在48 h后处于稳定生长期,细菌到达稳定生长期后,PHA合成能力仍进一步上升,至60 h处PHA积累量达到最大,达5.88 g·L-1,随后PHA积累量有小幅下降,可能与细菌大量生长,培养基中营养物质不足而分解PHA有关。

图2 菌株DQ-4的生长及PHA积累曲线
2.4FT-IR分析
傅立叶红外光谱结果(图3)显示,菌株DQ-4合成的聚合物在1 726 cm-1处强吸收峰,此处出现的峰值代表了聚酯的羰基(CO)特征性吸收峰,在2 980、2 934、2 876 cm-1出现的吸收峰代表了甲基和次甲基的C—H伸缩振动,Hong K et al.[11]证明了这2个基团是PHAs类物质的特征基团。在1 050~1 350 cm-1出现了大量的吸收峰,这与C—O—C的对称和不对称振动有关。FT-IR结果显示,菌株DQ-4合成的聚合物具有PHA类化合物的特征,结合与PHA样品比对,基本确定菌株DQ-4合成的化合物为PHA。
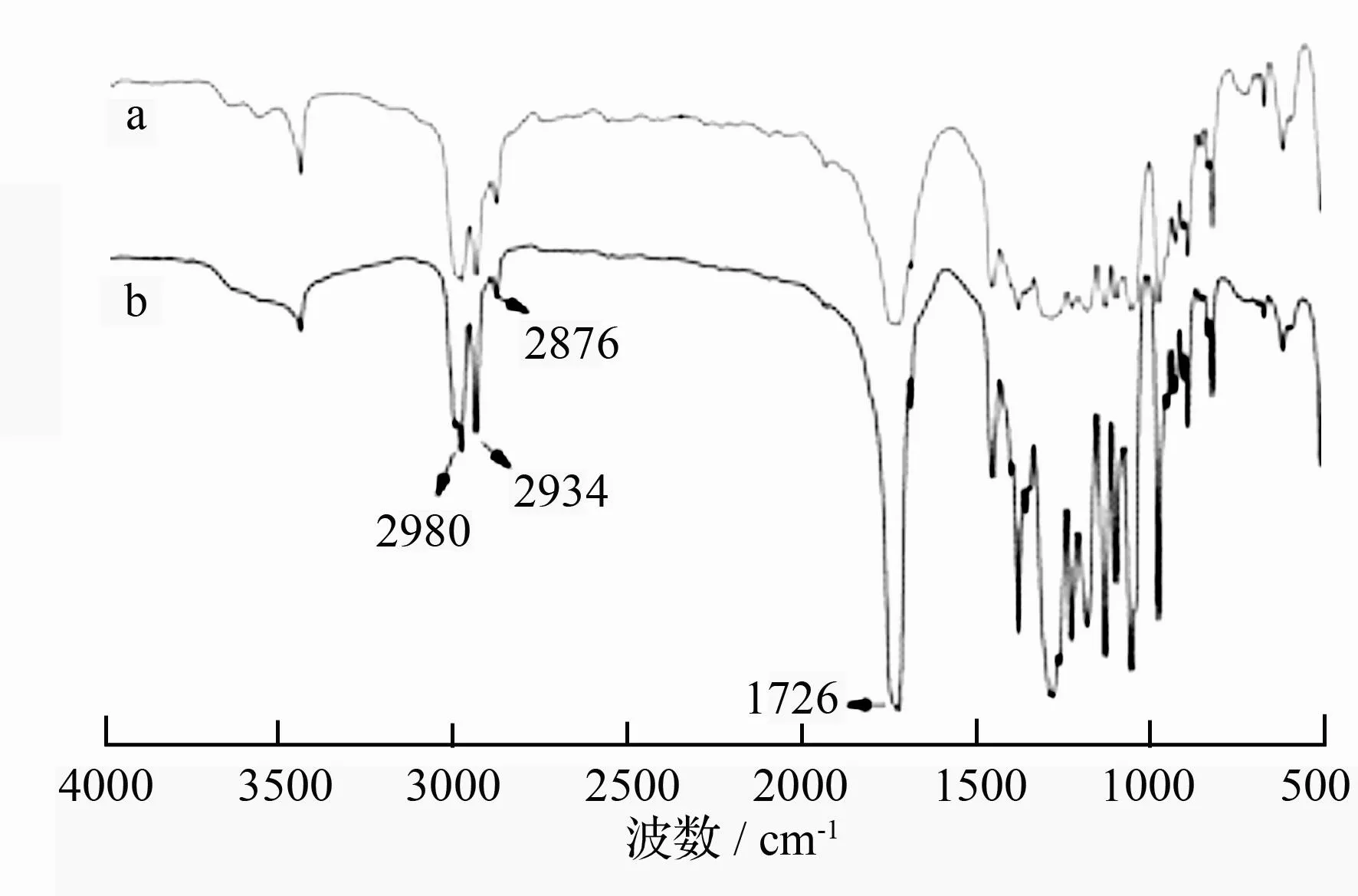
图3PHA标样(a)及菌株DQ-4合成的聚合物(b)的红外光谱
3结论与讨论
以大庆地区盐碱地土壤为样品,分离筛选得到1株合成PHA能力较强的菌株,对菌株进行生理生化分析及16S rRNA序列比对,确定菌株为嗜盐单胞菌,命名为HalomonasDQ-4。菌株经尼罗蓝染色在紫外灯下呈荧光,菌株合成产物经GC-MS分析具有PHA相似结构,傅立叶红外光谱扫描显示其产物在1 726 cm-1处有较强吸收峰,而此处为PHA系列化合物的特征峰。综合以上,确认该菌株具有PHA合成能力。利用矿物盐培养基进行摇瓶发酵特性探究,菌株DQ-4在培养基初始pH为9,按装液量为100 mL(500 mL锥形瓶中),在38 ℃、160 r·min-1的条件下发酵,菌株DQ-4的PHA积累能力最强。在上述条件下,HalomonasDQ-4在48 h处达到生长最大值,在60 h菌株合成PHA量达到最大,产量可达5.88 g·L-1。
嗜盐菌作为常见的嗜极微生物,因其具有多方向的PHA合成能力而受到人们的广泛研究。Guzmánetal.[12]利用Halomonasboliviensis菌株同步合成了PHB和四氢甲基嘧啶羧酸;Kawataetal.[13]利用Halomonassp.KM-1菌株合成P3HB量达15.2g·L-1;Tanetal.[14]利用筛选出的HalomonasTD-01菌株采取“饥饿-丰盛”培养模式使PHB合成量达到64.00g·L-1。以上研究说明,嗜盐菌经进一步驯化、开发可以作为高产PHA生产平台而被广泛应用,同时嗜盐菌能够发挥高盐高碱条件下的耐受性而抑制其他微生物生长,据此可省去灭菌环节,实现开放培养,进而大幅降低生产成本。此外,在本研究中筛选的菌株还具有纤维素分解能力,其利用纤维素合成PHA的能力值得后续深入研究。
参考文献
[1]ANDERSON A J, DAWES E A. Occurrence, metabolism, metabolicrole, and industrial uses of bacterial polyhydroxyalkanoates[J]. Microbiological Reviews,1990,54(4):450-472.
[2]LEE S Y. Bacterial polyhydroxyalkanoates[J]. Biotech Bioeng,1996,49:1.
[3]高雪.大肠杆菌中聚羟基脂肪酸酯合成基因的优化和染色体表达[D].北京:清华大学,2013.
[4]LEMOIGNE M. Products of dehydration and of polymerization ofβ-hydroxybutyricacid[J]. Bull Soc Chem Biol,1926,8:770-782.
[5]DURNER R, ZINN M, WITHOLT B, et al. Accumulation of poly [(R)-3-hydroxyalkanoates] inPseudomonasoleovoransduring growth in batch and chemostat culture with different carbon sources[J]. Biotechnology and Bioengineering,2001,72(3):278-288.
[6]VAN-THUOC D, HUU-PHONG T, MINH-KHUONG D, et al. Poly(3-Hydroxybutyrate-co-3-Hydroxyvale-rate) production by a moderate HalophileYangiasp. ND199 using glycerol as a carbon source[J]. Applied Biochemistry and Biotechnology,2015,175(6):3120-3132.
[7]KUSHNER D J. Life in high salt and solute concentrations: halophilic bacteria[M]//KUSHNER D J. Microbial life in extreme environments. London: Academic Press,1978:317-368.
[8]陈银广,陈坚,堵国成,等.聚-β-羟基丁酸酯提取方法的比较[J].无锡轻工大学学报,1998,17(3):5-9.
[9]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[10]布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[J].9版.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984.
[11]HONG K, SUN S, TIAN W, et al. A rapid method for detecting bacterial polyhydroxyalkanoates in intact cells by Fourier transform infrared spectroscopy[J]. Applied Microbiology and Biotechnology,1999,51(4):523-526.
[13]KAWATA Y, KAWASAKI K, SHIGERI Y. Efficient secreted production of (R)-3-hydroxybutyric acid from livingHalomonassp. KM-1 under successive aerobic and microaerobic conditions[J]. Applied Microbiology and Biotechnology,2012,96(4):913-920.
[14]TAN D, XUE Y S, AIBAIDULA G, et al. Unsterile and continuous production of polyhydroxybutyrate byHalomonasTD01[J]. Bioresource Technology,2011,102(17):8130-8136.
收稿日期:2016年1月13日。
第一作者简介:王海飙,男,1992年1月生,东北林业大学生命科学学院,硕士研究生。E-mail:wanghaibiao@yeah.net。通信作者:刘长莉,东北林业大学生命科学学院,副教授。E-mail:609849343@qq.com。
1)国家自然科学基金资助(J1210053)。
责任编辑:程红。
