小麦L699叶片受白粉菌胁迫后蛋白质的差异表达
2016-05-27梁银萍常小丽龚国淑祁小波罗丽雅胡玉亭
梁银萍,常小丽,张 敏,龚国淑,雷 雨,祁小波,罗丽雅,胡玉亭
(四川农业大学农学院,四川成都 611130)
小麦L699叶片受白粉菌胁迫后蛋白质的差异表达
梁银萍,常小丽,张 敏,龚国淑,雷 雨,祁小波,罗丽雅,胡玉亭
(四川农业大学农学院,四川成都 611130)
摘要:为从蛋白组学角度认识小麦抗白粉病机制,以含有抗白粉病新基因 Pm40的小麦品系L699为材料,采用蛋白质双向电泳和质谱技术(MALDI-TOF-MS)检测小麦叶片接种白粉菌 24 h后的差异蛋白。结果表明,经PDQuest软件分析,接种白粉菌后小麦叶片中有18个蛋白质斑点表达量上调,38个蛋白质斑点表达量下调。对表达量上调的蛋白质斑点进行质谱分析和数据库检索,共鉴定出15种蛋白质,其中13种参与防御反应、碳水化合物代谢和蛋白质周转。这些差异蛋白与抗病途径、植株生理过程密切相关,在小麦抗白粉病过程中起很重要的作用。
关键词:小麦;白粉菌; Pm40;蛋白质;双向电泳
小麦白粉病是由布氏白粉菌小麦专化型(Blumeriagraminisf. sp.tritici)引起的真菌性病害,是小麦生产中普遍发生且危害严重的病害之一。近年来,我国小麦白粉病发生面积在500万hm2以上,给我国小麦生产造成了严重的损失[1]。目前,农业生产上采取以推广抗病品种为主,辅以减少菌源、合理栽培和喷施药剂的综合措施来防治小麦白粉病[2]。迄今为止,在普通小麦中已有77个与抗白粉病相关的基因被定位在小麦染色体49个位点上[3]。然而小麦白粉菌生理小种进化较快,导致许多抗病品种在种植过程中出现了抗性丧失。国内外对于小麦抗白粉病基因定位、转录水平调控已有较多的研究[4],但对于小麦抗白粉病机制的认识目前尚不十分透彻,仍需要大量的研究。由于生物体最终功能的执行者是蛋白质,因此从蛋白质组水平分析基因表达产物有助于揭示小麦抗白粉病机制。近年来,在小麦黑胚病、白粉病、锈病等小麦病害的研究中,均有应用蛋白质双向电泳及质谱技术对感病或抗病材料在接种或不接种条件下进行蛋白质差异表达分析[5-9],且发现一些蛋白质与小麦抗病性有关。 Pm40是四川农业大学发现的一个小麦抗白粉病新基因,来源于小麦近缘种中间偃麦草(Elytrigiaintermedium),被定位在小麦7B染色体的短臂上,代表品种是GRY19[10]。目前, 有关 Pm40抗白粉病的机制尚不清楚。本试验拟以遗传性稳定、对白粉病免疫或高抗的GRY自交高代品系L699为材料,利用蛋白质组学技术对其接种白粉菌后叶片蛋白质的差异表达及差异蛋白质种类、生理功能进行分析,以期揭示小麦抗白粉病机制,为L699在生产和育种中的应用奠定基础。
1材料与方法
1.1试验材料
以小麦白粉病抗性新品系L699为材料。供试白粉菌采自四川省成都市温江区小麦自然发病区,并接种于感病品种川农26上繁殖,置于光照培养箱中培养,保菌。
1.2试验方法
1.2.1幼苗培养和病菌接种
L699种子经75%乙醇表面消毒3 min,无菌水冲洗3次,放置于带有湿润滤纸的培养皿中室温下催芽24 h。然后将萌动种子移入花盆中,置于光照培养箱中培养,参数设定相对湿度95%、温度18 ℃、光照周期12 h光照/12 h黑暗。小麦三叶期时,将其分为接种组和对照组,用塑料隔离培养。采用密集抖落接种法接种白粉菌。接种24 h后,对接种组和对照组进行取样。
1.2.2小麦叶片全蛋白的提取
称取叶片1 g,用去离子水洗净,滤纸吸干,液氮研磨成细粉,分装入1.5 mL离心管中。蛋白质采用TCA-丙酮法[11]提取。用裂解液[7 mol·L-1尿素,2 mol·L-1硫脲,4% CHAPS,50 mmol·L-1DTT,0.5% Ampholine(pH 3~10),1%PMSF]对其进行裂解,用改良Bradford方法测蛋白质浓度[12-13]。
1.2.3蛋白质双向电泳
蛋白质双向电泳采用17 cm pH 4~7的线性胶条和12%聚丙烯酰胺凝胶,具体操作参考Bio-Rad蛋白质组双向电泳实验操作手册进行。采用胶体考马斯亮蓝染色方法对凝胶进行染色,保鲜膜包裹后4 ℃保存。
1.2.4图像采集与分析
采用GS800色谱扫描仪扫描得到双向电泳胶凝胶图谱,用PDQuest软件进行斑点检测、匹配和差异斑点鉴别,设定差异表达比为2,确定处理组和对照组之间差异的蛋白质斑点。
1.2.5差异表达点的质谱分析
从制备凝胶上切下经鉴定有差异的蛋白点,用50%乙腈(ACN)、50 mmol·L-1碳酸氢氨溶液脱色两次,然后用100%ACN干燥两次,在冰冷的消化液(12.5 ng·μL-1的胰蛋白酶液,含25 mmol·L-1碳酸氢氨)中消化20 min后,转移到37 ℃恒温箱中过夜。用60 μL提取液(5%甲酸和50%ACN)抽提两次后,收集上层的蛋白多肽,在氮气下干燥。将多肽溶解于0.8 μL的基质溶液中,利用AB SCIEX 5800型生物质谱仪进行MALDI-TOF-MS分析,波长设为355 nm,紫外光重复频率设置为400 Hz,加速电压20 kV,质谱最大分辨率设为1 600 Da,并用经胰蛋白酶消化过的肌红蛋白作为内参,进行校正。最后通过MASCOT软件,在NCBI数据库进行查询。
2结果与分析
2.1白粉菌侵染后小麦叶片蛋白质的差异表达
分析结果(图1)表明,每块胶上共约500 多个蛋白质点。在接种24 h后,L699叶片蛋白质出现56个差异表达点,其中38个蛋白质点表达量下调(Spots 1~38)(图1a),18个蛋白质点表达量上调(Spots 39~56)(图1b)。
2.2差异蛋白质的鉴定
对L699接种后表达量上调的18个蛋白质点进行质谱分析,去除杂质峰值,用Mascot软件搜索NCBInr数据库,最后鉴定出15种蛋白质(表1),其他3 个蛋白点得分不够,未能得到鉴定。鉴定出的蛋白质中,有12种功能已知,其中丙氨酰转移RNA合成酶(Spot 39)、Clp蛋白酶(Spot 40)、赖氨酰转移RNA合成酶(Spot 41)、线粒体加工肽酶(Spot 44)、腺苷高半胱氨酸酶(Spot 45)、半胱氨酸合成酶(Spot 48)、核糖体再循环因子(Spot 52)与蛋白质周转有关;葡萄糖磷酸变位酶(Spot 42、43)、六磷酸葡萄糖脱氢酶(Spot 46)、三磷酸甘油酸激酶(Spot 47)与碳水化合物代谢相关,类萌素蛋白(Spot 53)与抗性有关。
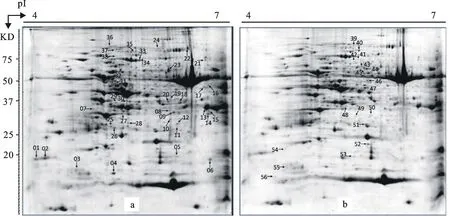
a:对照组,24 h;b:处理组,24 h a:Control,24 h;b:Treatment,24 h
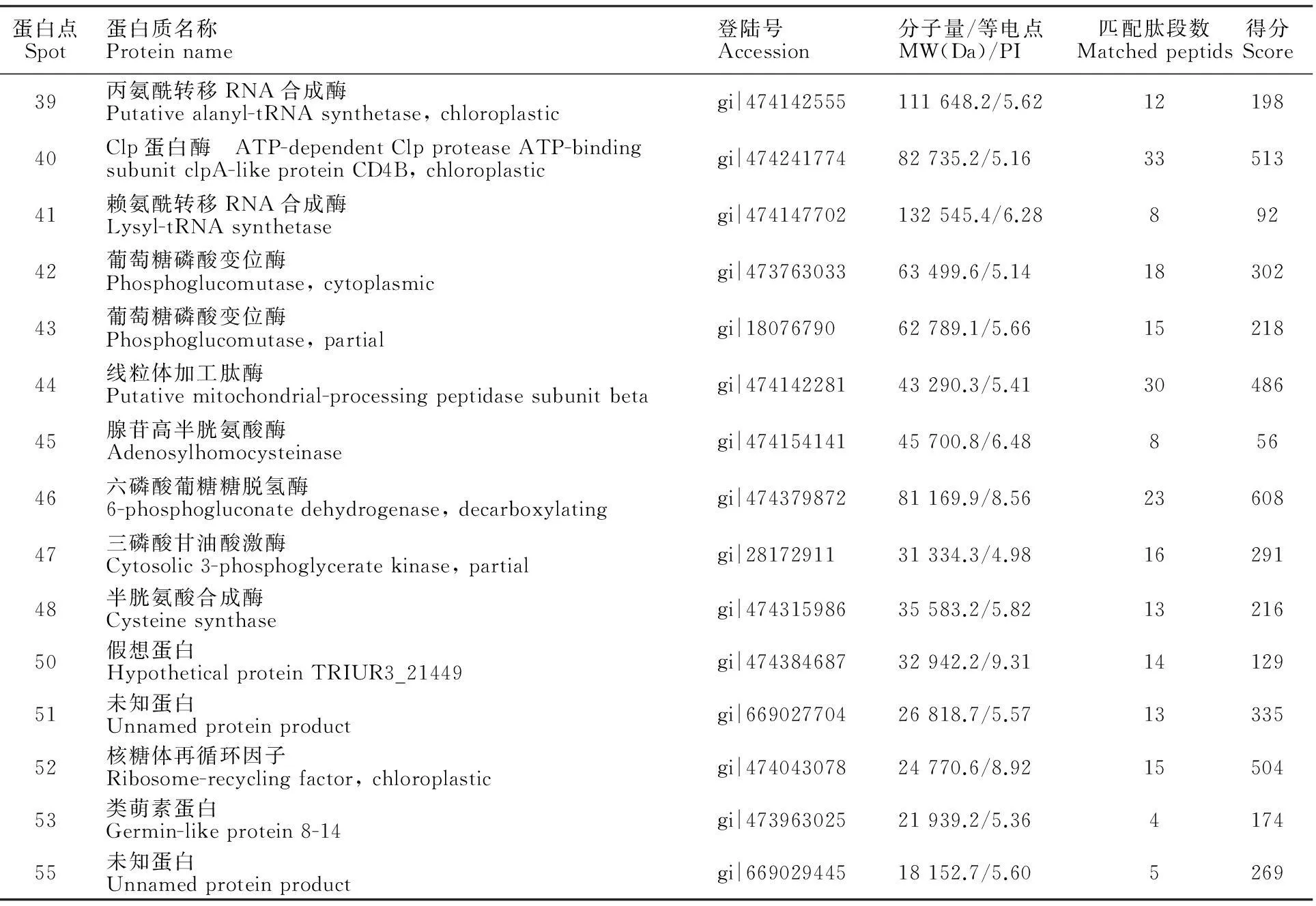
蛋白点Spot蛋白质名称Proteinname登陆号Accession分子量/等电点MW(Da)/PI匹配肽段数Matchedpeptids得分Score39丙氨酰转移RNA合成酶Putativealanyl-tRNAsynthetase,chloroplasticgi|474142555111648.2/5.621219840Clp蛋白酶 ATP-dependentClpproteaseATP-bindingsubunitclpA-likeproteinCD4B,chloroplasticgi|47424177482735.2/5.163351341赖氨酰转移RNA合成酶Lysyl-tRNAsynthetasegi|474147702132545.4/6.2889242葡萄糖磷酸变位酶Phosphoglucomutase,cytoplasmicgi|47376303363499.6/5.141830243葡萄糖磷酸变位酶Phosphoglucomutase,partialgi|1807679062789.1/5.661521844线粒体加工肽酶Putativemitochondrial-processingpeptidasesubunitbetagi|47414228143290.3/5.413048645腺苷高半胱氨酸酶Adenosylhomocysteinasegi|47415414145700.8/6.4885646六磷酸葡糖糖脱氢酶6-phosphogluconatedehydrogenase,decarboxylatinggi|47437987281169.9/8.562360847三磷酸甘油酸激酶Cytosolic3-phosphoglyceratekinase,partialgi|2817291131334.3/4.981629148半胱氨酸合成酶Cysteinesynthasegi|47431598635583.2/5.821321650假想蛋白HypotheticalproteinTRIUR3_21449gi|47438468732942.2/9.311412951未知蛋白Unnamedproteinproductgi|66902770426818.7/5.571333552核糖体再循环因子Ribosome-recyclingfactor,chloroplasticgi|47404307824770.6/8.921550453类萌素蛋白Germin-likeprotein8-14gi|47396302521939.2/5.36417455未知蛋白Unnamedproteinproductgi|66902944518152.7/5.605269
3讨 论
本研究携带抗白粉病基因 Pm40的小麦品系L699在接种白粉菌24 h后,叶片中既没有蛋白质消失,也无新蛋白质产生,但有53种蛋白质的表达量发生变化,表明其与L699对白粉菌的抗性有关。对接种白粉菌24 h后表达量上调的蛋白质斑点做了质谱分析,鉴定出15种蛋白质,其中7种与蛋白质周转相关,占总蛋白质数量的47%,表明蛋白质的稳定对植物生命活动至关重要。遗传信息流动的每一步都具有高度的忠实性,所以差错率很低[14]。尽管如此,蛋白质在合成过程仍会有一定的差错率,其中氨酰转移RNA合成酶在这一过程中扮演了重要的角色[15-16],其不仅参与蛋白质的合成,而且还在转录及翻译水平、 剪接RNA、传导信号与免疫应答等方面起重要作用[17]。白粉菌侵染小麦后,丙氨酰转移RNA合成酶、赖氨酰转移RNA合成酶的表达量都明显提高,推测它们对小麦抗白粉菌侵染可能有重要的意义。
线粒体加工肽酶(Mitochondrial-processing peptidase,MPP),是由细胞核编码在细胞质中形成,然后被转运至线粒体并经已形成的MPP催化加工而成[18]。MPP在线粒体中的主要作用是加工进入线粒体的前体蛋白质[19-21]。此外,植物体MPP也是呼吸链bc1复合体的重要组成[22]。本试验中,小麦L699受白粉菌侵染后,MPP表达上调,表明MPP的表达与小麦白粉菌抗性有关。
在植物体中,Clp蛋白酶位于线粒体或叶绿体中参与多种生理活动[23]。叶绿体Clp蛋白酶可协助清除错误剪切的胞质前体蛋白质和降解错误折叠的蛋白质[24-25]。Clp蛋白酶与多种生物的抗逆性有关,可以清除生物体在逆境条件产生的损伤蛋白质或者多肽,从而保证生物体的正常代谢[26-27]。小麦L699在接种白粉菌后,Clp蛋白酶表达量上调,推测Clp蛋白酶在小麦L699抗白粉菌的过程中起重要的作用。
核糖体循环因子(Ribosome recycling factor,RFF)的主要功能是在蛋白质翻译结束后,将核糖体从mRNA上释放,使其循环再利用[28]。核糖体的数量影响mRNA的转录,是蛋白质正常代谢的必要条件[29]。因此,蛋白质的正常代谢是小麦抗白粉病的有力保障。白粉菌侵染小麦后,葡萄糖磷酸变位酶、六磷酸葡萄糖脱氢酶、三磷酸甘油酸激酶的表达量都明显提高,表明它们对小麦抗白粉菌侵染也有重要的意义。
类萌发素蛋白(Germin-like proteins,GLPs)是植物响应胁迫的一类重要蛋白质。在植物被真菌、细菌或病毒等病原物入侵时,GLPs的基因表达明显上调, 可以催化产生H2O2。产生的H2O2能够选择性参加信号级联途径,从而使植物产生自我防卫反应,H2O2也能够利用与纤维素发生交联作用,从而加强植物细胞壁的结构,这对植物抵御氧化胁迫非常重要[30]。本试验中,L699被白粉菌侵染后,类萌发素蛋白表达上调,表明其参与了小麦L699抗白粉菌过程。
综上所述,小麦受白粉菌侵染后,不仅有与抗性密切相关的蛋白质如类萌蛋白参与了抗病过程,一些与植物生理代谢相关的蛋白质在小麦抗白粉菌的过程中也起很重要的作用。
参考文献:
[1]邢淑莲,周益林,段霞瑜,等.小麦白粉菌 HSP70基因的克隆及高温胁迫对其表达的影响 [J].植物病理学报,2013,43(2):205-210.
Xing S L,Zhou Y L,Duan X Y,etal.Cloning of heat shock protein gene, HSP70,inBlumeriagraminisf.sp.triticiand its expression under high temperature stress [J].ActaPhytopathologicaSinica,2013,43(2):205-210.
[2]侯明生,黄俊斌.农业植物病理学[M].北京:科学出版社,2006:65.
Hou M S,Huang J B.Agricultural Phytopathology [M].Beijing:Science Press,2006:65.
[3]Hao Y F,Parks R,Cowger C,etal.Molecular characterization of a new powdery mildew resistance gene HSP70 in soft red winter wheat [J].TheoreticalandAppliedGenetics,2015,128(3):1-12.
[4]王友红,张鹏飞,陈建群.植物抗病基因及其作用机理[J].植物学通报,2005,22(1):92-99.
Wang Y H,Zhang P F,Chen J Q.Disease resistance genes and mechanisms in plants [J].ChineseBulletinofBotany,2005,22(1):92-99.
[5]李跃建,姬红丽,彭 云,等.应用双向电泳技术研究条锈菌侵染后小麦蛋白质的改变[J].四川大学学报:工程科学版,2005,37(2):80-85.
Li Y J,Ji H L,Peng Y,etal.The change of proteins in wheat infected by wheat disease:PucciniiaStriiformisusing 2-dimentional electrophoresitic technology [J].JournalofSichuanUniversity:EngineeringScienceEdition,2005,37(2):80-85.
[6]Mak Y,Willows R D,Roberts T H,etal.Black point is associated with reduced levels of stress,disease-and defence-related proteins in wheat grain [J].MolecularPlantPathology,2006,7(3):177-189.
[7]于 振,李 倩,赵建叶,等.栽培小麦Brock和京411感染白粉菌后蛋白质组的变化[J].作物学报,2009,35(11):2064-2072.
Yu Z,Li Q,Zhao J Y,etal.Proteome changes in wheat varieties brock and Jing 411 after inoculatingBlumeniagraminis[J].ActaAgronomicaSinica,2009,35(11):2064-2072.
[8]李 强,张卫东,田纪春.小麦抗白粉病基因 Pm21抗病差异的蛋白质组学研究 [J].中国农业科学,2009,42(8):2778-2783.
Li Q,Zhang W D,Tian J C.Differential proteomics analysis of the responses of resistant gene Pm21 to wheat powdery mildew [J].ScientiaAgriculturaSinica,2009,42(8):2778-2783.
[9]Mandal M S,Fu Y,Zhang S,etal.Proteomic analysis of the defense response of wheat to the powdery mildew fungus,Blumeriagraminisf.sp.tritici[J].TheProteinJournal,2014,33(6):513-524.
[10]Luo P G,Luo H Y,Chang Z J,etal.Characterization and chromosomal location of Pm40 in common wheat:a new gene for resistance to powdery mildew derived fromElytrigiaintermedium[J].TheoreticalandAppliedGenetics,2009,118(6):1059-1064.
[11]金 艳,许海霞,徐圆圆,等.几种不同提取方法对小麦叶片总蛋白双向电泳的影响[J].麦类作物学报,2009,29(6):1083-1087.
Jin Y,Xu H X,Xu Y Y,etal.Effect of different extraction protein methods on two-dimensional electrophoresis of wheat leaf protein [J].JournalofTriticeaeCrops,2009,29(6):1083-1087.
[12]Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding [J].AnalyticalBiochemistry,1976,72(1):248-254.
[13]刘 斌.二倍体和四倍体玉米与四倍体多年生大刍草及其杂种的蛋白质组学分析[D].雅安:四川农业大学,2014.
Liu B.Proteomics Analysis of Different Ploidy Corn with Tetraploid Perennial Corn and Its Hybrid [D].Yaan:Sichuan Agricultural University,2014.
[14]谢兆辉.氨酰-tRNA合成酶维持翻译忠实性的机制[J].中国生物化学与分子生物学报,2011,27(2):110-116.
Xie Y H.Translational fidelity mechanism of aminoacyl-tRNA synthetases [J].ChineseJournalofBiochemistryandMolecularBiology,2011,27(2):110-116.
[15]Ling J Q,So B R,Yadavalli S S,etal.Resampling and editing of mischarged tRNA prior to translation elongation [J].MolecularCell,2009,33(5):654-660.
[16]Zaher H S,Green R.Quality control by the ribosome following peptide bond formation [J].Nature,2009,457(7226):161-166.
[17]贾 捷,金由辛.氨酰tRNA合成酶的分子网络和功能[J].生物化学与生物物理进展,2004,31(4):291-295.
Jia J,Jin Y X.Macromolecular network and new function of aminoacyl-tRNA synthetases[J].ProgressinBiochemistryandBiophysics,2004,31(4):291-295.
[18]Schulte U,Arretz M,Schneider H,etal.A family of mitochondrial proteins involved in bioenergetics and biogenesis [J].Nature,1989,339(6220):147-149.
[19]Braun H P,Schmitz U K.The mitochondrial processing peptidase [J].TheInternationalJournalofBiochemistry&CellBiology,1997,29(8):1043-1045.
[20]Glaser E,Eriksson A C,Sjoling S.Bifunctional role of the bc1 complex in plants mitochondrial bc1 complex catalyses both electron transport and protein processing [J].FEBSLetters,1994,346(1):83-87.
[21]Glaser E,Sjoling S,Szigyarto C,etal.Plant mitochondrial protein import:precursor processing is catalysed by the integrated mitochondrial processing peptidase (MPP)/bc 1 complex and degradation by the ATP-dependent proteinase [J].BiochimicaetBiophysicaActa:Bioenergetics,1996,1275(1):33-37.
[22]Braun H P,Schmitz U K.The bifunctional cytochromec reductase/processing peptidase complex from plant mitochondria [J].JournalofBioenergeticsandBiomembranes,1995,27(4):423-436.
[23]Clarke A K,Macdonald T M,Sjogren L L.The ATP-dependent Clp protease in chloroplasts of higher plants [J].PhysiologiaPlantarum,2005,123(4):406-412.
[24]Sjögren L L,Stanne T M,Zheng B,etal.Structural and functional insights into the chloroplast ATP-dependent Clp protease inArabidopsis[J].ThePlantCell,2006,18(10):2635-2649.
[25]Simpson S D,Nakashima K,Narusaka Y,etal.Two different novel cis-acting elements of erd1,a clpA homologousArabidopsisgene function in induction by dehydration stress and dark-induced senescence [J].ThePlantJournal,2003,33(2):259-270.
[26]王振海,孙野青.Clp蛋白酶研究进展[J].药物生物技术,2005,12(6):412-415.
Wang Z H,Sun Y Q.Progress in study on Clp protease [J].PharmaceuticalBiotechnology,2005,12(6):412-415.
[27]Clarke A K.The chloroplast ATP-dependent Clp protease in vascular plants-new dimensions and future challenges [J].PhysiologiaPantarum,2011,145(1):235-244.
[28]Ma Z,Tao L,Bechthold A,etal.Overexpression of ribosome recycling factor is responsible for improvement of nucleotide antibiotic-toyocamycin inStreptomycesdiastatochromogenes 1628 [J].AppliedMicrobiologyandBiotechnology,2014,98(11):5051-5058.
[29]Wang L Y,Ou Y M,Li Q N,etal.TheArabidopsischloroplast ribosome recycling factor is essential for embryogenesis and chloroplast biogenesis [J].PlantMolecularBiology,2010,74(1-2):47-59.
[30]李红丽,刘迪秋,何 华,等.类萌发素蛋白在植物防卫反应中的作用[J].植物生理学报,2013,49(4):331-336.
Li H L,Liu D Q,He H,etal.The role of germin-like protein in plant defense responses [J].PlantPhysiologyCommunications,2013,49(4):331-336.
Differential Proteomics Analysis of Wheat Line L699 Induced byBlumeriagraminis
LIANG Yinping,CHANG Xiaoli,ZHANG Min,GONG Guoshu,LEI Yu,QI Xiaobo,LUO Liya,HU Yuting
(Agronomy College,Sichuan Agricultural University,Chengdu, Sichuan 611130, China)
Abstract:The aim of this study was to investigate the defense-related proteins of wheat line L699 against Blumeria graminis and to provide some basis for the resistance mechanism of wheat-Blumeria graminis through proteomic analysis. Proteins were extracted from the wheat leaf at 24 h after inoculation and analyzed by two dimensional electrophoresis and MALDI-TOF-MS. Results demonstrated that as compared to non-inoculated plants, expression of 18 proteins spots significantly increased after Blumeria graminis inoculation on the gel stained with coomassie brilliant blue G250, whereas 38 proteins spots decreased. Furthermore, 15 up-regulated proteins were identified by MALDI-TOF-MS and analyzed using the NCBInr database of Triticum and these identified proteins were predicted to be associated with defense response, carbohydrate metabolism, and protein turnover. It is suggested that the proteins are not only involved in disease defense response but also in other physiology-related pathway in the process that wheat resists to the Bgt.
Key words:Wheat; Blumeria graminis; Pm40; Protein; Two-dimensional electrophoresis
中图分类号:S512.1;S312
文献标识码:A
文章编号:1009-1041(2016)04-0460-05
通讯作者:张 敏(E-mail:yalanmin@126.com)
基金项目:国家公益性行业(农业)科研专项(201303016)
收稿日期:2015-10-22修回日期:2015-11-19
网络出版时间:2016-04-01
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160401.1533.022.html
第一作者E-mail:104660993@qq.com
