不同浓度铅胁迫对向日葵幼苗蛋白质结构和表达的影响
2016-06-03王聿双张晓倩刘海学
吕 潇,王聿双,张晓倩,刘海学
(天津农学院 农学与资源环境学院,天津 300384)
不同浓度铅胁迫对向日葵幼苗蛋白质结构和表达的影响
吕潇,王聿双,张晓倩,刘海学
(天津农学院 农学与资源环境学院,天津300384)
摘要:为揭示向日葵抗铅胁迫的分子机理,采用傅立叶红外光谱分析法和双向电泳法探讨向日葵试材HA89的幼苗在不同浓度(0,400,800 mg/L)铅胁迫条件下蛋白质水平发生的变化。结果表明:向日葵幼苗根、茎、叶的蛋白质二级结构中的β-折叠结构和无规则卷曲结构对铅胁迫最为敏感,同时,根据1 655 cm-1/1 637 cm-1比值可看出向日葵幼苗蛋白在铅胁迫浓度为400 mg/L时蛋白质二级结构较为稳定,超过这一浓度到800 mg/L时,蛋白二级结构则趋于松散;试验采用Tris酚提取法提取试验材料全蛋白,经双向电泳分析后发现差异蛋白点9个。经双向电泳分析后匹配完全相同蛋白点数65对,差异倍数为2倍以上的9个,根据蛋白点的等电点和分子量对照蛋白库对比后,推测变化较为显著的蛋白是与感应有关的激酶。
关键词:向日葵幼苗;铅胁迫;傅立叶红外光谱;SDS-PAGE电泳;双向电泳
重金属污染系环境污染的类型之一,其污染源能够引起植物在生长过程中出现一系列问题,如减少生物产量,诱发植物疾病,以及一些形态上和生理上的改变[1]。植物体本身含有金属离子,除了从根部摄取或者迁移到根部的金属离子,还有一些存在于植物的细胞壁中,这些金属离子属于植物矿质营养,是植株生长发育的基本条件。然而,近些年来由于人类过度开发(如工业、采矿业等),造成环境中的无机元素迅速增长,从而出现了重金属污染这一严重问题,影响到植株生长发育。铅(Pb)是重金属元素中较为常见的种类之一,铅元素容易被植物吸收,滞留时间长而且较为稳定[2]。向日葵(HelianthusannuusL.)作为世界第五大油料作物,在正常生长情况下可以在其根部和芽部累积高含量的金属离子,同时,向日葵的自我修复能力很强,还可将土壤中过多的金属离子迁移或回收再利用[3],但过多的铅离子会造成向日葵出现缺水、萎蔫等代谢负担过重症状。另外,向日葵在受到铅胁迫时也会产生一些抵御机制,这种抵御机制可以使向日葵在一定浓度的铅胁迫下正常生长。蛋白质是较为敏感的结构,植物在生长期间的蛋白质组会发生变化,已经有人对这方面进行研究[4]。在不同逆境条件下(干旱、盐胁迫、重金属胁迫等),蛋白质组也会发生变化,如肖清铁等[5]对镉胁迫后水稻叶片的蛋白质组进行研究,检测到差异表达蛋白点31个,并且利用MALDI-TOF/MS分析鉴定差异蛋白。Jerusa等[6]对多种重金属胁迫后的向日葵叶片蛋白质组学进行研究,发现23个差异显著蛋白点,12个被成功鉴定,其中6种蛋白以前在向日葵蛋白库中未发现,而2种蛋白在蛋白库里表现为新序列。
红外光谱是一种用来检测高分子化合物等物质结构的仪器,尤其是本试验采用的傅立叶红外光谱仪更是以灵敏度高、检测数值准确、高效快速等优点而广泛应用于蛋白结构解析方面的研究。关于傅立叶红外光谱法检测蛋白结构方面,已经有不少研究予以应用,赵昕等[7]采用傅立叶红外光谱法对NaCl胁迫后的盐芥和拟南芥的蛋白结构的变化进行了研究,发现在高浓度盐胁迫下盐芥的蛋白质结构较拟南芥的蛋白结构更为稳定[7];另外,胡瑞省等[8]用红外光谱法对不同温度下的酵母蛋白二级结构进行分析,进一步证明酵母蛋白中的β-折叠结构热不稳定性。
蛋白结构的变化导致其功能也随之改变,这种调节方式是蛋白质中普遍存在的功能调节方式。所以,任何导致蛋白质分子结构细微变化,都将导致该蛋白质的生理功能发生相应的改变[9]。本试验结合红外光谱法和双向电泳法对铅胁迫下的向日葵幼苗蛋白质进行研究,从向日葵幼苗的蛋白二级结构变化到蛋白质表达及功能上的变化,可充分得出向日葵幼苗在响应铅胁迫后产生的分子机理。双向电泳是研究蛋白质组的主要技术之一,在目前蛋白质组学研究中,多采用双向电泳技术用于分析蛋白的混合物,或者对经过特殊处理后的组织、细胞发生的变化进行研究。本试验结合这2种技术来分析铅胁迫处理后的向日葵蛋白质组发生的变化,旨在为进一步研究向日葵抗逆境胁迫的分子生理机制及向日葵蛋白质组学奠定可靠基础。
1材料和方法
1.1试验材料
试验采用的向日葵品种为HA89,由天津农学院农业分析实验教学示范中心提供。
1.2试验方法
1.2.1植株培养将向日葵种子培养在20 cm×20 cm的发芽盒中,每盒放入40粒种子,发芽前用纯水浸泡8 h进行催芽,然后采用3种不同方式进行处理,第1种是对照处理即只浇水,第2,3种处理分别浇含Pb+浓度400,800 mg/L的溶液,所有处理每天浇3 mL溶液,每种处理3次重复。所有向日葵种子的发芽和生长都在环境温度约25 ℃的恒温培养箱中培养,每天日照8 h。1.2.2向日葵幼苗傅立叶红外光谱采集试验采用IR200傅立叶红外光谱仪对不同浓度铅胁迫下30 d的向日葵幼苗进行红外光谱采集,分别检测铅胁迫浓度为0,400,800 mg/L的向日葵幼苗及其根、茎、叶3个部分的蛋白二级结构变化。为避免植株中水分对红外光谱的干扰,采集前用60 ℃烘箱将样品烘干约10 h,每种样品测3次重复,扫描次数累积为27次。由于蛋白为聚酰胺化合物,所以检测蛋白结构变化主要包括3段酰胺区的吸收峰值,分别为:酰胺Ⅰ区为1 600~1 700 cm-1,酰胺Ⅱ区为1 600~1 500 cm-1,酰胺Ⅲ区为1 300~1 200 cm-1[10]。其中酰胺Ⅰ区对蛋白二级结构的特征峰值最为敏感,所以本试验主要研究蛋白在酰胺Ⅰ区的变化特点,基本可以反映出铅胁迫后向日葵幼苗的蛋白结构变化[11]。
1.2.3蛋白样品制备参照卢丞文等[12]的Tris饱和酚提取法提取试验材料全蛋白。
1.2.4蛋白定量参照张云贵等[13]的生物化学实验指导中Bradford定量法,测定3次取平均值。1.2.5双向电泳采用pH值3~10,长度为11 cm的IPG胶条,一向IEF聚焦时间约6.5 h,上样量2 mg左右,水化12 h,最高电压6 000 V;第二向电泳采用浓度为12.5%,厚度为1 mm的聚丙烯酰胺凝胶,电泳设30 mA/100 V,时间约4 h,考马斯亮蓝G-250染色约10 h后用去离子水脱色,直到背景透明。
2结果与分析
2.1不同浓度铅胁迫下向日葵幼苗的全蛋白二级结构变化
试验采用Origin Pro 9.0程序对样品原始红外光谱图进行Gaussian方程拟合处理,确定样品在酰胺I区主要可分成1 637,1 646,1 655,1 664 cm-1几个主要波峰,分别相当于蛋白二级结构中的β-折叠、无规则卷曲、α螺旋和β转角结构(图1)。

图1 原始红外光谱图在Origin Pro 9.0软件上经
铅胁迫后向日葵幼苗蛋白二级结构组成变化的4个波峰构成见图2-A、B、C,由图2看出,植株的根茎叶之间变化不大,但能明显看出同一处理下根在1 637 cm-1波数下的子峰占总面积比值最高,说明同一处理中根部含有α-螺旋的数量较茎、叶多;随着铅胁迫浓度增加,所有根部的蛋白二级结构变化趋势相似,但变化的比值有所差异,向日葵幼苗根受400 mg/L铅胁迫处理后在1 646 cm-1波数下变化最大,与对照处理的向日葵幼苗根相比增加了67.6%,而胁迫浓度达到800 mg/L的向日葵幼苗根则增加了278.0%,因此,向日葵幼苗根部无规则卷曲结构的数量随着铅胁迫浓度的增加而增加;经不同浓度铅胁迫处理的向日葵幼苗茎部和叶部含有的无规则卷曲结构的数量变化也较为明显,随着铅胁迫浓度的增加,向日葵幼苗茎部无规则卷曲结构的数量先下降后上升,与对照茎相比上升了118.0%;而向日葵幼苗叶部的无规则卷曲结构的数量则随着铅胁迫浓度增加而增加,与对照叶相比上升了140.9%。因此,向日葵幼苗根、茎、叶的蛋白二级结构中β-折叠结构和无规则卷曲结构对铅胁迫最为敏感。
另外,2个主要波峰面积的相对比值能更好地反映蛋白质结构的变化趋势,所以,采取2个主要波峰面积的相对比值,即通过1 655 cm-1/1 637 cm-1比值的变化来研究受铅胁迫处理后向日葵幼苗蛋白二级结构的整体变化,图3为向日葵幼苗的根、茎、叶分别在不同浓度铅胁迫下的蛋白二级结构2个主要波峰面积的相对比值,比值越低,则维持蛋白二级结构稳定性的H键数量越低,说明蛋白结构越松散;相反,比值越高,则维持蛋白质二级结构稳定性的H键数量越高,说明蛋白结构越稳定[14]。由图3看出,经过铅胁迫处理后向日葵幼苗根部的1 655 cm-1/1 637 cm-1的比值总体呈上升趋势,而茎和叶部的比值总体呈下降趋势;而从整个植株的比值来看,对照处理到400 mg/L再到800 mg/L铅胁迫处理的向日葵幼苗的1 655 cm-1/1 637 cm-1比值则呈先上升后下降的趋势,说明向日葵幼苗蛋白在铅胁迫浓度为400 mg/L时蛋白质二级结构较为稳定,当铅胁迫处理浓度达800 mg/L时,蛋白二级结构趋于松散。

图2 向日葵幼苗受不同浓度铅胁迫处理

图3 向日葵幼苗分别在0,400,800 mg/L铅溶液
2.2蛋白定量
由于此方法采用紫外分光光度计测定,蛋白样品中一些试剂(如尿素、Chaps等)会影响结果,出现误差,故试验采取测定3次取平均值的方法,基本可以得到可靠结果。蛋白浓度如表1所示。从表1可以看出,经过不同浓度铅胁迫处理后,向日葵幼苗的蛋白含量出现变化,总体表现先上升后下降的趋势,具体变化还要经双向电泳分离蛋白后分析得出结果。

表1 不同浓度铅胁迫后向日葵幼苗蛋白定量
2.3不同浓度铅胁迫对向日葵幼苗蛋白影响的双向电泳分析
试验采用ImagemasterTM2D Platinum软件检测分析双向电泳图谱,半自动检测蛋白点,即人工对自动检测的蛋白点校对和剔除。试验重复3次双向电泳,经软件分析结果相似,得到较为可靠的结果。软件检测到对照处理的向日葵幼苗全蛋白双向电泳图谱中蛋白点为148个,铅胁迫400 mg/L的向日葵幼苗蛋白点为135个,铅胁迫800 mg/L的向日葵幼苗蛋白点为137个;匹配完全相同蛋白点数65对,差异蛋白点占总蛋白点比率分别为:56%,51.9%,52.6%,差异倍数为2倍以上的9个。本试验针对差异倍数2倍以上的蛋白点进行分析,蛋白点1、2均在图4-A中有表达,在图4-B、C中未见表达;蛋白点3、4在图4-B、C中表达量明显高于A中的表达量;蛋白点5在图4-C中表达量明显低于在A、B中的表达量;蛋白点6在图4-B、C中的表达量明显低于在A中的表达量;蛋白点7、8在图4-C中有表达,在A、B中未见表达。对这些蛋白点的等电点范围和分子量范围进行分析,与http://www.arabidopsis.org/蛋白数据库查询对比蛋白点的基本功能后[15],初步推测部分蛋白点结果见表2,其中变化最为显著的蛋白点8推测为与感应蛋白有关的激酶[16]。
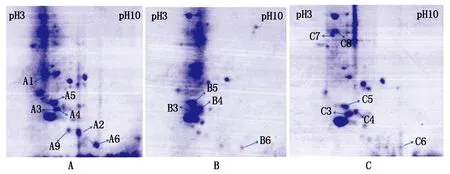
A、B、C 分别为铅胁迫浓度0,400,800 mg/L向日葵幼苗全蛋白的双向电泳。

蛋白点编号ProteinspotsNo.蛋白描述Proteindescription分子量/kDaMass1核糖体蛋白RibosomalproteinS8(chloroplast)15.6783MGMT家族蛋白MGMTfamilyprotein(Pseudomonassyringaepv.helianthi)12.7346过氧化物酶Peroxidase,partial(Helianthusannuus)10.3377假定叶绿体RF1HypotheticalchloroplastRF1(chloroplast)(Helianthusannuus)20.4588双组分管理系统(感应蛋白)Two-componentsystemregulatoryprotein(Pseudomonassyringaepv.he-lianthi)21.197
3讨论
3.1不同浓度铅胁迫对向日葵幼苗蛋白二级结构的影响
本试验采用傅立叶红外光谱法检测了不同浓度铅胁迫后向日葵幼苗根、茎、叶蛋白二级结构,试验结果发现,向日葵幼苗根、茎、叶的蛋白二级结构中无规则卷曲结构对铅胁迫最为敏感,变化比率较大;由整个植株的比值可看出,从对照处理到400 mg/L再到800 mg/L铅胁迫处理的向日葵幼苗的 1 655 cm-1/1 637 cm-1比值总体呈先上升后下降的趋势,表明一定浓度的铅胁迫处理可以使向日葵幼苗的H键数增加,蛋白二级结构更加稳定,而铅胁迫超过一定程度后,向日葵幼苗的蛋白二级结构由于受损伤程度较为严重致使蛋白二级结构趋于松散。因此,由红外光谱检测说明了在浓度为400 mg/L的铅胁迫以内可以使向日葵幼苗的蛋白二级结构更趋于稳定。这一结果为研究向日葵抵御逆境胁迫提供新途径。
3.2不同浓度铅胁迫对向日葵幼苗蛋白表达的影响
本试验综合前人经验[16-19],通过对不同浓度铅胁迫处理的向日葵幼苗全蛋白进行双向电泳分析,经过ImagemasterTM2D Platinum软件匹配差异蛋白点后,针对其中差异显著的9个差异蛋白点进行研究。根据蛋白点的等电点范围和分子量范围进行分析,与蛋白数据库查询对比蛋白点的基本功能后,初步推测出部分蛋白点的结果,其中变化较为显著的蛋白点推测为感应蛋白相关的激酶,蛋白激酶是基于环境条件改变后,生物体受到刺激发生相应的改变而产生的联合机制,主要由感应蛋白和转录激活蛋白组成,这种蛋白可以使生物体在受到逆境环境,如干旱、高/低温、盐胁迫、重金属胁迫后,做出相应的保护反应[20]。其他蛋白点还需要进一步深入研究,例如通过质谱分析或对氨基酸序列分析,可以对这些蛋白点的生理生化功能有更加具体的了解。
参考文献:
[1]包曙光,刘海学,亓娜,等.铅胁迫对向日葵幼苗矿质元素吸收和积累的影响[J],水土保持学报,2013,27(1):107-110.
[2]Silva M A O da,Gargia J S,Souza G H M F de,et al.Evaluation of sample preparation protocols for proteomic analysis of sunflower leaves[J].Talanta,2010(80):1545-1551.
[3]Jerusa Simone G,Priscila Lupino G,Ricardo Antunes A,et al.Metal contamination effects on sunflower(HelianthusannuusL.)growth and protein expressin in leaves during development[J].Journal of Agricultural and Food Chemistry,2006,54(22):8623-8630.
[4]刘宝祥,朴永哲,翟明昌,等.大麦发芽过程中蛋白质组的变化研究[J].食品工业科技,2013(11):108-110.
[5]肖清铁,戎红,周丽英,等.水稻叶片对镉胁迫响应的蛋白质差异表达[J].应用生态学报,2011,22(4):1013-1019.
[6]Jerusa S G,Gustavo H M F S,Marcos N E,et al.Evaluation of metal-ion stress in sunflower(HelianthusannuusL.)leaves through proteomic changes[J].The Royal Society of Chemistry Metallomics,2009(1):107-113.
[7]赵昕,盛芬玲,赵敏桂,等.NaCl胁迫下盐芥和拟南芥化合物含量与蛋白质结构变化比较-傅立叶红外光谱法[J].应用与环境生物学报,2008(14):371-377.
[8]胡瑞省,张宝华,周冉.红外光谱法分析酵母蛋白质的二级结构[J].理化检验-化学分册,2015,51(3):277-280.
[9]徐国恒.蛋白质分子的结构与功能[J].生物学通报,2010,45(3):24-25.
[10]Jose L R,Arrondo,Arturo M.Quantitative studies of the structure of proteins in solution by fourier-transform infrared spectroscopy[J].Pro Biophys Molec Biol,1993,59(1):23-56.
[11]Witold K S,Henry H M,Dennis C.Determination of protein secondary structure by fourier transform infrared spectroscopy:a critical assessment[J].Biochemistry,1993,32(2):389-394.
[12]卢丞文,潘晓琪,田慧琴.番茄果实中蛋白质的提取和双向电泳条件的优化[J].食品科技,2011,35(10):196-200.
[13]张云贵,刘祥云,李天俊,等.生物化学实验指导[M].第4版.北京:中国农业出版社,2007:57-60,74-77.
[14]卢雁,张玮玮,王公珂.FTIR用于变性蛋白质二级结构的研究进展[J].光谱学与光谱分析,2008,28(1):88-93.
[15]王洪预.向日葵CMS比较蛋白质组学分析[D].长春:吉林大学,2008.
[16]董贵俊,张卫东,刘公社.向日葵种子蛋白质的微量提取和双向电泳技术研究[J].中国油料作物学报,2004,26(1):22-25.
[17]谢宗铭,陈福隆,孙宝启.种子蛋白乳酸尿素聚丙烯酰胺凝胶电泳技术及其对向日葵自交系和杂交种的鉴定[J].中国油料作物学报,1999,21(3):30.
[18]刘宇新,靳力争,张仲国.向日葵使用蛋白质的提取和SDS-PAGE电泳技术研究[J].天津农业科学,2012,18(2):8-10.
[19]Herbert de S B,Daiane L Q de S,Hector H F K.Sample preparation focusing on plant proteomics:extraction,evaluation and identification of proteins from sunflower seeds[J].Anal Methods,2013,5(1):116-123.
[20]Stock A M,Robinson V L,Goudreau P N.Two-component signal transduction[J].Annu Rev Biochem,2000,69 (1):183-215.
Effects of Lead Stress on Structure and Expression of Sunflower Seedlings Proteins
LÜ Xiao,WANG Yushuang,ZHANG Xiaoqian,LIU Haixue
(College of Agronomy & Resources and Environment,Tianjin Agricultural University,Tianjin300384,China)
Abstract:In order to explore the molecular mechanism of plumbum tolerance in sunflower,the alterations of sunflower seedlings in protein level under different concentrations of lead stress (0,400,800 mg/L),had been analyzed by FTIR infrared spectrometry and two-dimensional electrophoresis.The results showed that the irregular structurs structure in proteins from the roots,stems,and leaves of sunflower seedlings was significantly sensitive to lead stress compared with other structures.Measurements on the ratio of 1 655 cm-1/1 637 cm-1under lead stress indicated that secondary structures of proteins were relatively stable under 400 mg/L of lead solution,while the structures were loosely organized under 800 mg/L.The total proteins of materials mentioned above were extracted by Tris-phenol extraction method.Then 65 same protein spots were found by two-dimensional electrophoresis analysis in comparison with control treatment,more than 9 spots were differences in two times multiples.According to the protein isoelectric and molecular mass to protein databank,speculated that change is more significant with kinase.
Key words:Sunflower seedlings;Lead stress;FTIR;SDS-PAGE electrophoresis;Two-dimensional electrophoresis
doi:10.7668/hbnxb.2016.02.011
中图分类号:S565.03
文献标识码:A
文章编号:1000-7091(2016)02-0060-05
作者简介:吕潇(1988-),女,黑龙江大庆人,在读硕士,主要从事生物化学与分子生物学研究。通讯作者:刘海学(1965-),男,内蒙古通辽人,研究员,博士,主要从事生物化学与分子生物学研究。
基金项目:天津市大型科学仪器协同开放共享平台建设项目
收稿日期:2016-02-28
