miRNA-17对UVA诱导的皮肤成纤维细胞光老化的调节作用
2016-05-25宋健文张景华宋建驷西安市儿童医院皮肤科西安7000西安市儿童医院预检科陕西科技大学体育部通讯作者mailjianssongcom
宋健文, 张景华, 宋建驷(西安市儿童医院皮肤科,西安 7000; 西安市儿童医院预检科; 陕西科技大学体育部; 通讯作者,E-mail: jian-ssong@6.com)
miRNA-17对UVA诱导的皮肤成纤维细胞光老化的调节作用
宋健文1, 张景华2, 宋建驷3*(1西安市儿童医院皮肤科,西安710003;2西安市儿童医院预检科;3陕西科技大学体育部;*通讯作者,E-mail: jian-ssong@126.com)
摘要:目的检测miR-17在长波紫外线(UVA)诱导的光老化中的调节作用。方法分离人皮肤成纤维细胞(HDFs),用0 J/cm2(对照组),2.5,5.0,7.5 J/cm2剂量的UVA辐射诱导光老化模型,用实时定量PCR和Western blot分别检测miR-17和基质金属蛋白酶3(MMP3)的表达水平。对HDFs细胞分别转染miR-17的功能模拟物、miR-17阴性对照物、miR-17的功能抑制物和miR对照的功能抑制物,转染24 h后UVA辐射诱导光老化模型,检测MMP3蛋白表达水平。 结果经不同剂量UVA辐射后,HDFs中MMP3表达与对照组相比显著升高(P<0.01),且miR-17表达与对照组相比显著降低(P<0.01),其中2.5 J/cm2组的MMP3蛋白表达水平和miR-17表达显著低于5.0 J/cm2组和7.5 J/cm2组(P<0.05)。miR-17转染HDFs后再用UVA辐射,miR-17转染组的MMP3的蛋白水平显著低于miR对照组(P<0.05),而miR-17抑制物转染组MMP3的蛋白水平与miR对照组相比无显著的改变。 结论人皮肤成纤维细胞光老化模型中UVA可导致miR-17表达的下降,从而负性调节MMP3的表达。
关键词:光老化;人皮肤成纤维细胞;长波紫外线;miR-17;基质金属蛋白酶-3
miRNA是近年来发现的一类长20-22核苷酸的小的非编码RNA,它们可与靶基因的mRNA 3′端非翻译区结合,导致mRNA降解或阻断mRNA翻译[1,2]。目前已经清楚知道miRNA通过调节基因的表达参与细胞的增殖、分化、发育、代谢、凋亡等多种生理活动的调节[3]。因此,研究miRNA在特定病理过程中的作用可为该疾病临床预防和治疗提供重要思路。
皮肤的光老化是指长波紫外线(ultraviolet A,UVA)照射引起的皮肤松弛、皱纹增多且粗大、皮肤增厚、粗糙、色素沉着、毛细血管扩张等改变[4]。皮肤的光老化不仅有损人的容颜,更重要的是与皮肤癌的发生密切相关。因此阐明光老化的病理生理机制,寻找更有效的预防与治疗措施受到越来越多的关注。
光老化主要由于日光中的长波紫外线引发的真皮结缔组织中胶原纤维的断裂和无序排列,以及异常弹性物质的堆积。多种基质金属蛋白酶(matrix metalloproteinases, MMPs)参与了皮肤光老化过程,其中长波紫外线可诱导皮肤成纤维细胞中MMP3的表达进而参与光老化过程[5]。研究光老化过程中MMP3表达的调节机制,对于深入理解光老化的分子病理机制具有重要意义。
有研究表明MMP3的表达可在转录水平和翻译水平进行调节,而miRNA发挥了重要的调节作用[6,7]。根据Lin等报道,miR-17可调节MMP3的表达[8]。本研究探讨了紫外线诱导的皮肤成纤维细胞光老化模型中MMP3和miR-17的表达水平及两者之间的相互关系。
1材料及方法
1.1细胞株、试剂及仪器
人皮肤成纤维细胞的原代培养:取成年男性的包皮组织,用含有青霉素100 U/ml、链霉素100 pg/ml的PBS 漂洗3次后,剪去皮下脂肪组织,并将皮肤组织剪成0.5 mm的组织块,用5 mg/ml胶原酶在37 ℃消化4 h,在1 000 r/min离心获得细胞沉淀,用含10% FBS高糖DMEM培养基悬浮细胞,在37 ℃,5%CO2无菌培养[9]。第3-6代细胞用于实验。
1.2紫外线照射细胞
按照5.0×105细胞/孔的密度把人皮肤成纤维细胞(HDFs)接种于6孔板中。在细胞融合度达80%-90%时,弃去培养基,用UV 181 AL unit水平台(Villingen-Schwenningen公司,德国)上进行紫外线照射。辐射波长320-400 nm,峰值在365 nm。共设4个组:对照组(0 J/cm2)、2.5 J/cm2、5.0 J/cm2和7.5 J/cm2组。四组的细胞接受照射剂量为0,2.5,5,7.5 J/cm2。照射后立即加入10% FBS的高糖DMEM培养基,继续培养2 h。收集细胞样本用于后续实验。对照组没有受到紫外照射。
1.3MMP3和miR-17 RNA水平的检测
用Trizol法提取细胞中的总RNA,在核酸蛋白定量仪上测定RNA样品的浓度。取2 μg总RNA,用MBI的反转录试剂盒反转录为cDNA。运用stem-loop RT-PCR法反转miRNAs。hsa-miR-17序列号为:AF480529.1,stem-loop引物序列如下:Has-miR-17 stem-loop:GTCGTATCCAGTGCAGGGTCCGAGGTATTC-GCACTGGATACGACACCTACAAGTGCC。实时定量PCR检测MMP3和miR-17的表达,反应体系为10 μl,引物浓度为10 pmol/μl。扩增条件:94 ℃ 变性30 s,58 ℃退火30 s ,72 ℃延伸30 s,40个循环,用sybergreen染料定量。PCR所需的引物序列见表1。
表1MMP3、miR-17及内参引物序列
Table 1The primers of MMP3, miR-17 and internal control primer

基因 序列 产物大小(bp)MMP3F5'-TTGGCCCATGCCTATGCCCC-3'156R5'-ACAGGCGGAACCGAGTCAGG-3'miR-17F5'-CAGTAAAGGTAAGGAGAGCTCAATCTG-3'R5'-CATACAACCACTAAGCTAAAGAATAATCTGA-3'U6F5'-CGCCTCAGCCTGTTGTTCTTC-3'R5'-CCGTAGCCGATGGTGGTCTC-3'humanGAPDHF5'-GGGAAACTGTGGCGGAT-3'302R5'-GAGGAGTGGGTGTCGCTGTTG-3'
1.4MMP3蛋白水平的检测
用RIPA裂解细胞提取蛋白质。用BCA试剂盒测定蛋白样品的浓度,在10%分离胶后电泳分离不同的蛋白,把蛋白质从凝胶中电转移到尼龙膜上,用10%的脱脂奶粉的封闭。用1000倍稀释的抗MMP3抗体作为一抗,用5000倍稀释的辣根过氧化物酶标记的羊抗兔IgG作为二抗,滴加ECL化学发光液发光,用成像系统成像。
1.5miR-17功能模拟实验
为了研究miR-17对HDFs细胞活性的影响,在细胞中上调或抑制miR-17的活性,观察细胞在紫外照射后的活力。miR-17的功能模拟物(miR-17 mimic)、miR-17 mimic的阴性对照物(miR-control)、miR-17的功能抑制物(anti-miR-17)及miR-control的功能抑制物(anti-miR-control)均购自上海吉玛制药技术有限公司。上述RNA-oligonucleotides的序列见表2。
按照2×104个/孔的密度把HDFs细胞接种于48孔板中,共设5个组:对照组、miR-control、miR-17 mimic、antimiR-17和anti-miR-control。用Lipofectam-ine2000把50 ng miR-17 mimic、miR-control,anti-miR-17或anti-miR-control瞬时转染入HDFs细胞。转染24 h后,用紫外照射细胞,收集样本检测MMP3表达。
表2小分子RNA的序列
Table 2The sequence of RNA-oligonucleotides
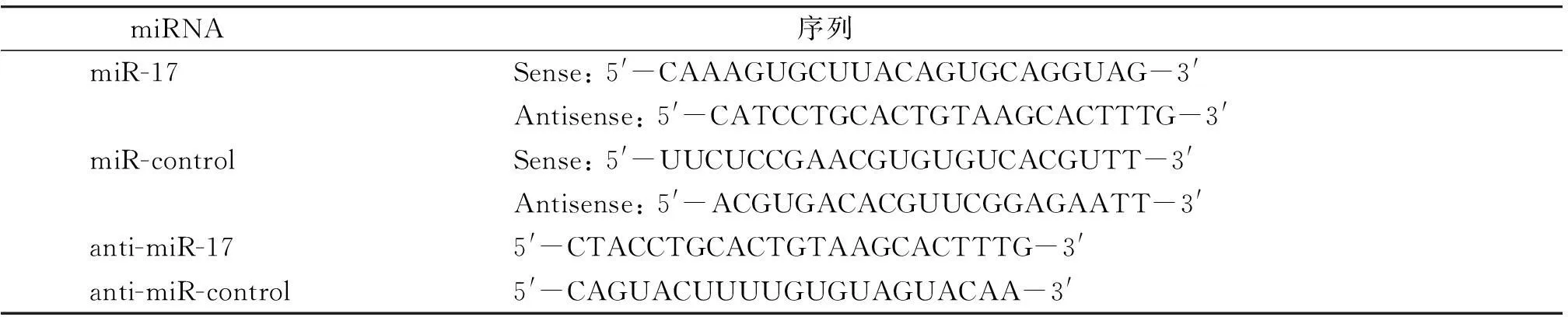
miRNA 序列 miR-17Sense:5'-CAAAGUGCUUACAGUGCAGGUAG-3'Antisense:5'-CATCCTGCACTGTAAGCACTTTG-3'miR-controlSense:5'-UUCUCCGAACGUGUGUCACGUTT-3'Antisense:5'-ACGUGACACGUUCGGAGAATT-3'anti-miR-175'-CTACCTGCACTGTAAGCACTTTG-3'anti-miR-control5'-CAGUACUUUUGUGUAGUACAA-3'
1.6统计学分析
2结果
2.1UVA照射人皮肤成纤维细胞上调MMP3的表达水平
为了检测MMP3 mRNA的表达水平,用real-time PCR检测了MMP3的表达水平。结果显示:人皮肤成纤维细胞在接受3种不同剂量(2.5,5.0,7.5 J/cm2)UVA照射后2 h均有MMP3 mRNA 升高,不同剂量组与对照组之间相比,差异有统计学意义(P<0.01,见图1)。其中2.5 J/cm2组MMP3 mRNA水平与5.0 J/cm2组和7.5 J/cm2组相比显著降低,而5.0 J/cm2组与7.5 J/cm2组之间没有统计学差异。
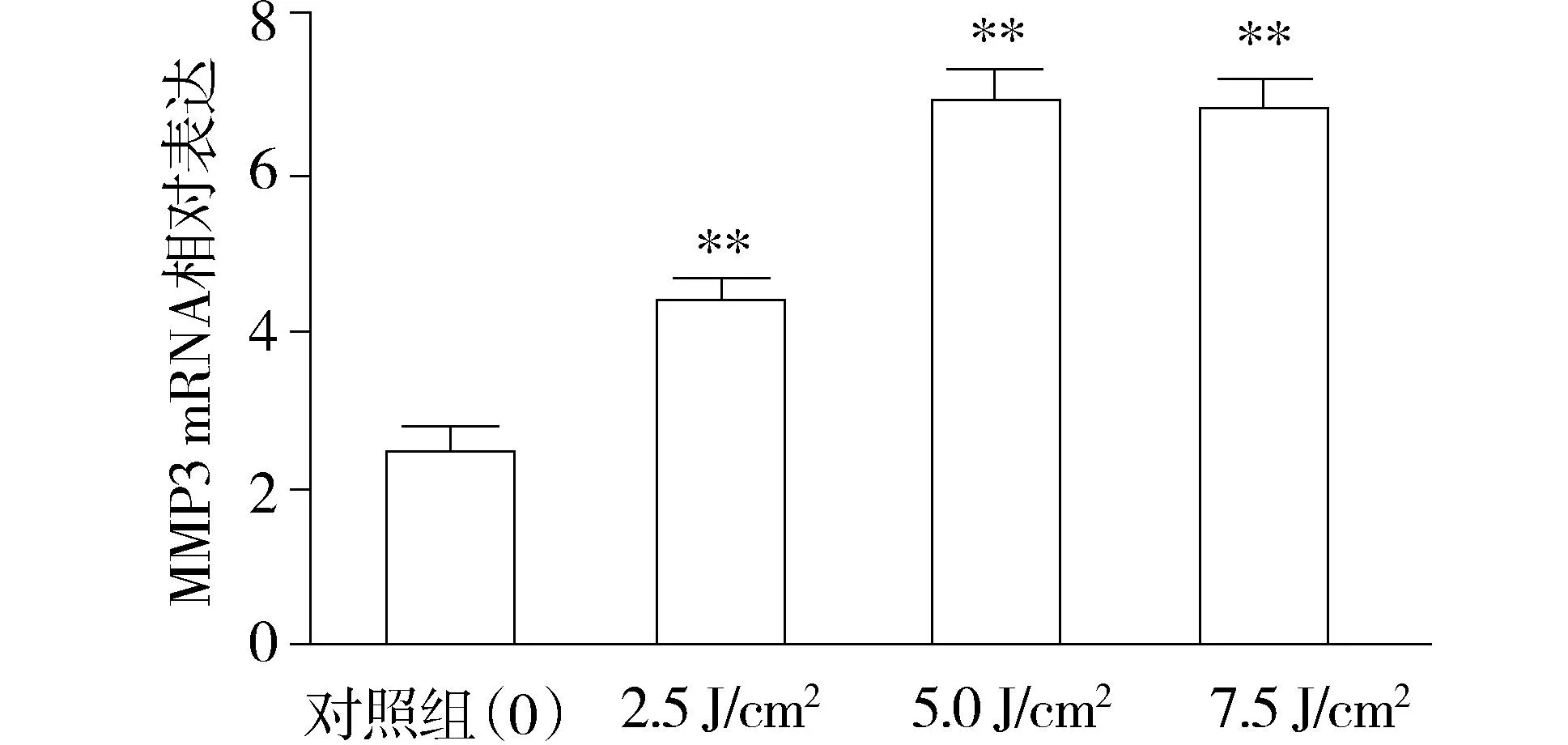
与对照组比较,**P<0.01图1 不同剂量UVA辐射后2 h人皮肤成纤维细胞MMP3 mRNA表达水平(n=3)Figure 1 The mRNA levels of MMP3 in HDFs after exposed to different doses of UVA for 2 h(n=3)
用Western blot检测了UVA照射人皮肤成纤维细胞MMP3蛋白的表达,灰度值分析结果显示:人皮肤成纤维细胞在接受3种不同剂量(2.5,5.0和7.5 J/cm2)UVA照射后2 h MMP3蛋白相对表达量分别为3.42±0.33,5.61±0.67和5.82±0.57,不同剂量组与对照组(0 J/cm2)之间相比,差异有统计学意义(P<0.01,见图2),MMP3蛋白表达随UVA辐射剂量增加升高。

图2 不同剂量UVA辐射后2 h对人皮肤成纤维细胞MMP3蛋白表达的影响Figure 2 Protein expression of MMP3 in HDFs after exposed to different doses of UVA for 2 h
2.2UVA照射人皮肤成纤维细胞下调了miR-17的表达水平
Real-time PCR检测UVA照射人皮肤成纤维细胞miR-17的表达水平显示:人皮肤成纤维细胞miR-17表达水平在2.5,5.0,7.5 J/cm2UVA辐射后2 h分别为0.25±0.02,0.72±0.04和0.77±0.03,不同剂量组与对照组之间相比差异有显著性(P<0.01),不同剂量组的miR-17表达水平较对照组有所降低(见图3)。
2.3miR-17对人成纤维细胞中MMP3表达的影响
我们用miR-17 mimic、miR-control、anti-miR-17及anti-miR-control分别转染HDFs细胞后,经5.0 J/cm2紫外照射,检测MMP3的蛋白水平,结果表明miR-17 mimic组MMP3的蛋白水平低于miR-control组,差异有统计学意义(P<0.05,见图4);而anti-miR-17对MMP3的蛋白水平无显著影响。
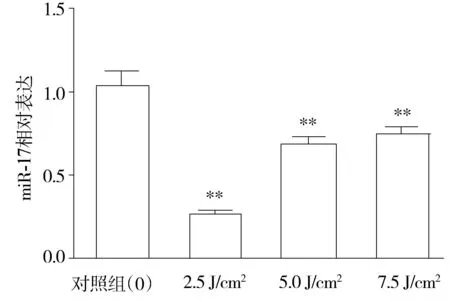
与对照组比较,**P<0.01图3 不同剂量UVA辐射后2 h人皮肤成纤维细胞miR-17表达水平(n=3)Figure 3 The levels of miR-17 in HDFs after exposed to different doses of UVA for 2 h(n=3)

图4 miR-17 mimic、miR-control、anti-miR-17及anti-miR-control分别转染人皮肤成纤维细胞对MMP3蛋白表达的影响(与对照组比较,*P<0.05)Figure 4 Protein expression of MMP3 in HDFs after transfected with miR-17 mimic, miR-control, anti-miR-17 and anti-miR-control(vs control group,*P<0.05)
3讨论
光老化是由于长期日光曝露引发的皮肤损伤,它表现为:皮肤松弛,皱纹增多且粗大,皮肤增厚,粗糙,色素沉着,毛细血管扩张,特别需要注意的是光老化易并发皮肤肿瘤。一般认为,光老化是由于紫外辐射影响到HDFs功能,导致胶原表达下降、基质金属蛋白酶分泌增强,引起皮肤结缔组织中胶原纤维损伤所致[10]。近年来有研究显示紫外辐射可以影响到miRNA的表达改变,因此miRNA在光老化过程中的作用受到重视。
miRNA广泛存在于多种真核生物中。虽然它们不编码任何蛋白,但它们可通过与mRNA的3′UTR区结合,引起mRNA的降解或是抑制翻译的进行。通过对基因组结构的分析,研究人员推测在人的基因组中存在1 000个以上的miRNA基因[11]。单个miRNA可调节200个以上的靶基因,目前已知1/3以上的调节增殖、分化、发育、代谢、凋亡及其他生理活动的基因受到miRNA的调节[3]。因此,miRNA表达的改变会影响特定病理或生理现象的发生、发展及迁延,阐明miRNA在特定疾病中的作用对于研究疾病的发病机制具有重要意义。
miR-17又被称为miRNA91,位于人染色体13q31.3,是目前研究较多的一种小RNA。大量研究表明miR-17是c-Myc信号网络的重要组成部分,它通过调节E2F1表达影响细胞周期[12];miR-17还可调节淋巴细胞归巢[13]、单核细胞生成[14]。miR-17还影响结缔组织的结构[15],并与内质网应激有关[16]。但是目前miR-17在皮肤的病理生理过程中的作用机制还不清楚,但本研究发现不同剂量UVA辐射HDFs后,MMP3的表达显著升高而miR-17的表达显著降低,且miR-17转染HDFs后再UVA辐射可使MMP3的蛋白水平显著降低。故人皮肤成纤维细胞光老化模型中UVA可导致miR-17表达的下降,从而负性调节MMP3的表达。
本研究结果表明,miR-17的表达可受到紫外辐射的影响,而生物信息学以及文献报道说明了MMP3是miR-17的靶基因,且体外验证了miR-17可以调控MMP3的表达[8]。MMPs参与正常细胞外基质降解的生理过程,包括组织重塑和器官发育过程,同时还调节炎症反应、促进肿瘤的转移和血管生成等[17,18]。其中MMP3作为基质金属蛋白酶家族成员,主要的作用是降解纤维结合素、层粘连蛋白、Ⅲ型胶原、Ⅳ型胶原、Ⅵ型胶原、Ⅹ型胶原以及软骨蛋白聚糖。早期的研究还表明MMP3可增加细胞的凋亡[19]。所以在本研究的人皮肤成纤维细胞光老化模型中UVA可导致miR-17表达的下降,从而负性调节MMP3的表达,进而可能造成皮肤成纤维细胞的凋亡以及降解细胞外基质。本研究结果为深入了解光老化的分子机制提供了新的视角,但是紫外辐射影响miR-17表达的机制,以及miR-17在光老化中具有什么样的作用,仍需进一步研究。
参考文献:
[1]Iwakawa HO,Tomari Y.The functions of microRNAs:mRNA decay and translational repression[J].Trends Cell Biol,2015,25(11):651-665.
[2]Carthew RW.Gene regulation by microRNAs[J].Curr Opin Genet Dev,2006,16(2):203-208.
[3]Lu M,Zhang Q,Deng M,etal.An analysis of human microRNA and disease associations[J].PLoS One,2008,3(10):e3420.
[4]Marionnet C,Pierrard C,Lejeune F,etal.Different oxidative stress response in keratinocytes and fibroblasts of reconstructed skin exposed to non extreme daily-ultraviolet radiation[J].PLoS One,2010,5(8):e12059.
[5]Hwang BM,Noh EM,Kim JS,etal.Curcumin inhibits UVB-induced matrix metalloproteinase-1/3 expression by suppressing the MAPK-p38/JNK pathways in human dermal fibroblasts[J].Exp Dermatol,2013,22(5):371-374.
[6]Jing W,Jiang W.MicroRNA-93 regulates collagen loss by targeting MMP3 in human nucleus pulposus cells[J].Cell Prolif,2015,48(3):284-292.
[7]Ai F,Zhang X,Li X,etal.Up-regulation of matrix metalloproteinases in a mouse model of chemically induced colitis-associated cancer:the role of microRNAs[J].Oncotarget,2015,6(7):5412-5425.
[8]Lin YH,Liao CJ,Huang YH,etal.Thyroid hormone receptor represses miR-17 expression to enhance tumor metastasis in human hepatoma cells[J].Oncogene,2013,32(38):4509-4518.
[9]王晓华,王扬,蒋涛,等.人皮肤成纤维细胞原代培养及生物学特性[J].中国医科大学学报,2010,12(39):1041-1044.
[10]Park M,Han J,Lee CS,etal.Carnosic acid,a phenolic diterpene from rosemary, prevents UV-induced expression of matrix metalloproteinases in human skin fibroblasts and keratinocytes[J].Exp Dermatol,2013,22(5):336-341.
[11]Sharma M,Juvvuna PK,Kukreti H,etal.Mega roles of microRNAs in regulation of skeletal muscle health and disease[J].Front Physiol,2014,5:239-248.
[12]Pickering MT,Stadler BM,Kowalik TF.miR-17 and miR-20a temper an E2F1-induced G1 checkpoint to regulate cell cycle progression[J].Oncogene,2009,28(1):140-145.
[13]Inomata M,Tagawa H,Guo YM,etal.MicroRNA-17-92 down-regulates expression of distinct targets in different B-cell lymphoma subtypes[J].Blood,2009,113(2):396-402.
[14]Iosue I,Quaranta R,Masciarelli S,etal.Argonaute 2 sustains the gene expression program driving human monocytic differentiation of acute myeloid leukemia cells[J].Cell Death Dis,2013,4:e926.
[15]Shan SW,Lee DY,Deng Z,etal.MicroRNA MiR-17 retards tissue growth and represses fibronectin expression[J].Nat Cell Biol,2009,11(8):1031-1038.
[16]Lerner AG,Upton JP,Praveen PV,etal.IRE1α induces thioredoxin-interacting protein to activate the NLRP3 inflammasome and promote programmed cell death under irremediable ER stress[J].Cell Metab,2012,16(2):250-264.
[17]Kessenbrock K,Plaks V,Werb Z.Matrix metalloproteinases:regulators of the tumor microenvironment[J].Cell,2010,141(1):52-67.
[18]Dufour A,Overall CM.Missing the target:matrix metalloproteinase antitargets in inflammation and cancer[J].Trends Pharmacol Sci,2013,34(4):233-242.
[19]Li CK,Pender SL,Pickard KM,etal.Impaired immunity to intestinal bacterial infection in stromelysin-1(matrix metalloproteinase-3)-deficient mice[J].J.Immunol,2004,173(8):5171-5179.
Regulation effect of miR-17 on ultraviolet A-induced photoageing of human dermal fibroblasts
SONG Jianwen1, ZHANG Jinghua2, SONG Jiansi3*
(1DepartmentofDermatology,Xi’anChildren’sHospital,Xi’an710003,China;2DepartmentofPre-examinationandTriage,Xi’anChildren’sHospital;3DepartmentofPhysicalEducation,ShaanxiUniversityofScienceandTechnology;*Correspondingauthor,E-mail:jian-ssong@126.com)
Abstract:ObjectiveTo investigate the effects of miR-17 on ultraviolet A(UVA)-induced skin photoageing.MethodsThe primary human dermal fibroblasts(HDFs) from human skin were isolated and cultured. After exposed to different doses of UVA (0, 2.5, 5.0,7.5 J/cm2), the mRNA and protein levels of metal matrix proteinase 3 (MMP3) in HDFs were detected by real-time PCR and Western blot respectively, and the level of miR-17 was detected by real-time PCR. MiR-17 mimic, miR mimic control, anti-miR-17 and anti-miR mimic control were respectively transfected into HDFs before UVA exposure, and then the protein level of MMP3 was detected.ResultsAfter exposed to UVA, the expression of MMP3 was significantly increased(P<0.01), while the level of miR-17 was significantly decreased(P<0.01). The expression of MMP3 and the level of miR-17 in 2.5 J/cm2 group were significantly lower than in 5.0 J/cm2 group and 7.5 J/cm2 group(P<0.05). When HDFs were exposed to UVA after transfected with miR-17 mimic, the protein level of MMP3 in miR-17 mimic group was significantly lower than in miR-control group(P<0.05), but there was no difference between anti-miR-17 group and its control group. ConclusionUVA could down-regulate the levels of miR-17 and miR-17 thus down-regulating the expression of MMP3 in HDFs photoageing model.
Key words:photoageing;human dermal fibroblasts;ultraviolet A;miR-17;metal matrix proteinase-3
[收稿日期:2015-10-20]
作者简介:宋健文,女,1971-09生,博士,副主任医师,E-mail:freedomsong@163.com.
中图分类号:R751
文献标志码:A
文章编号:1007-6611(2016)01-0046-05
DOI:10.13753/j.issn.1007-6611.2016.01.011
基金项目:陕西省自然科学基础研究计划基金资助项目(2013JM4060);陕西省科技厅社会攻关基金资助项目(2014k11-05-03)
