脂多糖对大鼠肝星状细胞caspase-1及IL-18表达的影响
2016-05-25潘良盈刘震雄李慧艳赵曙光第四医军大学唐都医院消化内科西安710038通讯作者mailzsg1203126com
潘良盈, 刘震雄, 张 哲, 赵 丽, 李慧艳, 赵曙光(第四医军大学唐都医院消化内科,西安 710038;通讯作者,E-mail:zsg1203@126.com)
脂多糖对大鼠肝星状细胞caspase-1及IL-18表达的影响
潘良盈, 刘震雄, 张哲, 赵丽, 李慧艳, 赵曙光*(第四医军大学唐都医院消化内科,西安710038;*通讯作者,E-mail:zsg1203@126.com)
摘要:目的观察脂多糖(LPS)诱导大鼠肝星状细胞NLRP3活化时caspase-1及IL-18表达的变化。方法常规培养大鼠肝星状细胞,用RT-PCR检测LPS诱导肝星状细胞2 h时NLRP3炎症小体及caspase-1,IL-18 mRNA的表达,荧光定量PCR检测不同浓度LPS(0,0.05,0.1,0.2 μg/ml)诱导肝星状细胞不同时间(30,60,120 min)时caspase-1及IL-18 mRNA的表达。结果LPS诱导肝星状细胞在30 min和60 min时,随着LPS浓度增加caspase-1和IL-18 mRNA表达增高,0.1和0.2 μg/ml组均显著高于0 μg/ml组(P<0.05);120 min时,随着LPS浓度增加caspase-1和IL-18 mRNA表达逐渐降低,其中0.05 μg/ml组较0 μg/ml组显著降低(P<0.05)。随LPS诱导时间延长,0.05 μg/ml组caspase-1 和IL-18 mRNA表达逐渐增加;在0.1 μg/ml和0.2 μg/ml组,caspase-1 mRNA 表达逐渐降低,其中120 min组较30 min组显著降低(P<0.05);IL-18 mRNA表达水平先升高后降低,均在60 min时达最高水平(P<0.01)。结论LPS能够促进肝星状细胞炎症小体NLRP3表达,激活NLRP3,诱导HSC-T6分泌caspase-1及IL-18。
关键词:脂多糖;非酒精性脂肪性肝炎;肝星状细胞;NLRP3炎症小体
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)发病机制尚不明确[1]。NASH动物模型及患者常有代谢性内毒素血症,脂多糖(lipopolysaccharide,LPS)经门静脉系统进入肝脏,诱导库普细胞(Kuppfer cell,KC)活化,产生炎症因子,触发肝脏胰岛素抵抗(insulin resistance,IR),在NASH发病中发挥重要作用[2-4]。同时,LPS作为Toll样受体4的配体,也能活化炎症小体NLRP3,产生具有酶活性半胱氨酸蛋白水解酶-1(caspase-1),介导IL-1β和IL-18等炎症因子由前体转化为活性形式并分泌到胞外,参与肝脏IR的发生[5]。已证实,NLRP3与NASH的发生密切相关,敲除NLRP3可以阻止高脂饮食导致的IR、肥胖和NASH的进展[6-9]。目前研究LPS诱导肝脏NLRP3活化多集中在Kuppfer细胞和肝细胞,有研究[10]表明肝星状细胞也表达NLRP3,LPS诱导肝星状细胞NLRP3炎症小体活化对caspase-1及其下游炎症因子表达如何影响,目前报道不多[11]。本研究利用大鼠肝星状细胞,观察LPS诱导NLRP3活化时caspase-1和IL-18表达的变化,对于进一步丰富LPS参与NASH发病的机制有重要意义。
1材料与方法
1.1细胞株与主要试剂
实验用大鼠肝脏星状细胞HSC-T6购自中国科学院上海生物细胞库。无抗生素的DMEM、0.5 g/L胰酶EDTA溶液购自美国Hyclone公司;胎牛血清(fetal calf serum,FBS)购自美国Gibco公司;LPS购自美国Sigma公司;RNA simple Total RNA Kit、DNA maker购自北京Tiangen公司;PrimeScript TMRT Master Mix、Premix TaqTM、SYBR®Premix Ex TaqTMⅡ购自日本TaKara 公司。
1.2LPS刺激细胞实验
常规培养大鼠肝星状细胞HSC-T6,使用含10% FBS的DMEM培养基,于37 ℃ 5%CO2饱和湿度培养箱中培养。取处于对数期的大鼠肝星状细胞HSC-T6,采用0.25%胰酶消化,将HSC-T6细胞按5×106/ml接种于6孔板(用含10%胎牛血清的DMEM稀释),培养24 h后,用含0.5%胎牛血清的DMEM饥饿16 h,加入不同终浓度的LPS(0,0.05,0.1,0.2 μg/ml),各组分别培养30,60,120 min。
1.3提取总RNA转录合成cDNA
应用离心柱型总RNA提取试剂盒,按试剂盒的说明书进行操作分别提取总RNA,并用超微量分光光度计测定其浓度和纯度,重复测定3次,计算总RNA的浓度,A260/A280在1.8-2.0之间。用PrimeScript TMRT Master Mix 试剂盒,按照试剂盒说明书进行操作,反转录RNA得到cDNA模板,反转录条件:37 ℃ 15 min,85 ℃ 5 s。
1.4反转录PCR(RT-PCR)、实时定量PCR(real time PCR)检测LPS诱导后HSC-T6中caspase-1、IL-18 mRNA表达
根据Genbank中公布的各待测基因的基因序列设计引物,NLRP3上游引物:5′-TGC ATG CCG TAT CTG GTT GT-3′,下游引物:5′-AGC TGA GCA AGC TAA AGG CT-3′,产物大小134 bp;caspase-1上游引物:5′-CCG AGT GGT TCC CTC AAG TT-3′,下游引物:5′-CCG ACT CTC CGA GAA AGA TG-3′,产物大小158 bp;IL-18上游引物:5′-TGG AAT CAG ACC ACT TTG GC-3′,下游引物:5′-GTC TGG TCT GGG ATT CGT TG-3′,产物大小150 bp;内参GAPDH上游引物:5′-TAC CCA CGG CAA GTT CAA CG-3′,下游引物:5′-CAC CAG CAT CAC CCC ATT TG-3′,产物大小122 bp。RT-PCR反应体系为:Premix Taq 25 μl,模板cDNA 2 μl,上游引物1 μl,下游引物1 μl,灭菌蒸馏水加至50 μl。反应条件为:98 ℃ 10 s,56-57 ℃30 s,72 ℃ 1 min,30个循环。real time PCR反应体系如下:SYBR®Premix Ex Taq 12.5 μl,上游引物(10 μmol/L)1.0 μl,下游引物(10 μmol/L)1.0 μl,模板cDNA 12 μl,加dH2O 至25.0 μl。反应条件如下:95 ℃预变性30 s,PCR反应95 ℃ 3 s,56 ℃ 30 s,40个循环。
1.5数据处理与统计学分析
RT-PCR 琼脂凝胶电泳经成像所得图像用Lane 1D分析软件分析处理,real time PCR所得数据采用2-ΔΔCt法进行相对定量分析。采用SPSS 13.0软件,结果用表示,采用方差分析或LSD-t检验。P<0.05表示差异有统计学意义。
2结果
2.1LPS诱导大鼠肝星状细胞表达caspase-1和IL-18 mRNA
用0,0.05,0.1,0.2 μg/ml LPS诱导大鼠肝星状细胞,检测30,60,120 min三个时间点caspase-1和IL-18 mRNA的表达。结果显示,三个不同浓度LPS在不同时间点均可诱导肝星状细胞表达caspase-1和IL-18 mRNA(见图1)。

M.Marker;1-4.分别为0,0.2,0.1,0.05 μg/ml LPS处理组; 5.GAPDH图1 LPS诱导大鼠肝星状细胞2 h时NLRP3、caspase-1和IL-18 mRNA的表达Figure 1 Expression of NLRP3,caspase-1 and IL-18 mRNA in rat hepatic stellate cells induced by LPS for 2 h
2.2不同浓度LPS诱导肝星状细胞对不同时间caspase-1 mRNA表达的影响
LPS诱导肝星状细胞在30 min和60 min时,随着LPS浓度增加caspase-1 mRNA表达增高,0.1 μg/ml和0.2 μg/ml组均显著高于0 μg/ml组(P<0.05),120 min时间点,随着LPS浓度增加caspase-1 mRNA表达逐渐降低,其中0.05 μg/ml组较0 μg/ml组显著降低(P<0.05)。随LPS诱导时间延长,0.05 μg/ml组caspase-1 mRNA表达逐渐增加(P>0.05);0.1 μg/ml组和0.2 μg/ml组表达逐渐降低,其中120 min时较30 min时显著降低(P<0.05,见表1)。



组别30min60min120min0μg/ml组1.00±0.001.00±0.001.00±0.00 0.05μg/ml组1.48±0.351.52±0.342.07±0.35*0.1μg/ml组2.22±0.38*1.76±0.16*1.60±0.48#0.2μg/ml组2.39±0.63*2.28±0.31*1.36±0.40#
与0 μg/ml相比,*P<0.05;与30 min相比,#P<0.05
2.3不同浓度LPS诱导肝星状细胞对不同时间IL-18 mRNA表达的影响
LPS诱导肝星状细胞在30 min和60 min时,随着LPS浓度增加IL-18 mRNA表达均显著高于0 μg/ml组(P<0.05);在120 min时间点,随着LPS浓度增加IL-18 mRNA表达逐渐降低,但各组间无统计学差异(P>0.05)。随LPS诱导时间延长,0.05 μg/ml组IL-18 mRNA表达增高,其中120 min时较30 min时显著增高(P<0.01);0.1 μg/ml和0.2 μg/ml组表达先增加后降低,60 min时表达最高,且显著高于其余两个时间点(P<0.05,见表2)。


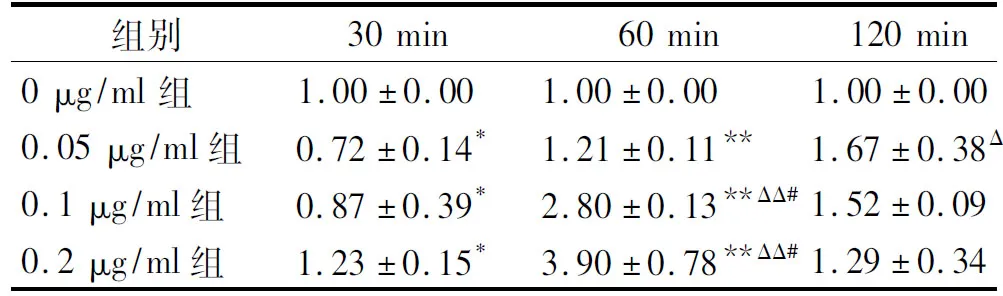
与0 μg/ml组相比,*P<0.05,**P<0.01;与30 min相比,ΔP<0.05,ΔΔP<0.01;与120 min组相比,#P<0.01
3讨论
近年NASH发病率明显上升,已成为慢性肝病及隐源性肝硬化的主要病因之一[1],但其发病机制尚未完全阐明。正常肠道菌群与高脂饮食相互作用产生代谢性内毒素血症,LPS水平增高,经门静脉系统进入肝脏诱导KC浸润、活化,合成多种炎症因子,触发肝脏IR,导致NASH发生。研究表明,这些肠道来源的LPS可以引起肝脏NLRP3活化,敲除NLRP3对NASH发病发挥保护作用[5,8,9,12]。新近研究发现[10],NLRP3表达水平与肝脏细胞种类有关,KC和肝窦内皮细胞高度表达,肝星状细胞中度表达,原代培养肝细胞几乎不表达。既往对LPS诱导肝脏NLRP3活化,研究对象多为肝细胞和Kuppfer细胞,而对肝星状细胞研究较少[8,10-12]。本研究表明,LPS能够诱导肝星状细胞NLRP3活化,且进一步诱导caspase-1及IL-18的表达,有可能通过此途径参与NASH的发病。
NLRP3与凋亡相关的斑点样蛋白(apoptosis-associated speck-like protein,ASC)和caspase-1相互结合形成炎症小体[13],NLRP3通过感受肥胖所导致的危险信号,促进肥胖导致的炎症和IR,参与NASH的发病。Csak等[12]发现NASH小鼠肝脏NLRP3、ASC、caspase-1表达高于对照组,提示NASH中存在炎症小体活化。分别缺失caspase-1、ASC及NLRP3的小鼠,高脂饮食诱导的肝细胞脂肪变性轻于对照组,且缺乏caspase-1的小鼠脂肪组织中巨噬细胞的数量下降。敲除NLRP3改善高脂饮食引起的小鼠肝脏和脂肪组织IR[8]。因此,caspase-1表达是LPS诱导细胞产生炎症因子的重要环节,本研究表明, LPS能够诱导肝星状细胞NLRP3活性升高,进而导致caspase-1 mRNA表达增加,且随LPS浓度增高而表达上调,随时间延长而表达减少,与以前研究[14]报道LPS导致肝脏NLRP3活化时caspase-1 mRNA表达特点并不一致,可能与该研究检测的是肝脏各种细胞受LPS刺激后caspase-1 mRNA的总和,而各种细胞受LPS刺激后caspase-1 mRNA表达的规律并不完全一致有关。
NLRP3炎症小体在被激活前处于自身抑制状态,NLRP3与配体结合后,形成成熟的caspase-1,剪切无活性的IL-1β和IL-18前体为成熟的活性形式,分泌到细胞外发挥生物学效应。缺乏caspase-1小鼠导致IL-1β和IL-18合成和分泌障碍。目前研究证实,IL-1β和IL-18与IR的发生关系密切[8,9,15]。清除NLRP3炎症小体能够降低IL-18水平,改善脂质细胞的代谢功能,并增强其胰岛素敏感性[8]。因此,caspase-1的表达对于其下游细胞因子的表达发挥非常重要的作用。本研究表明,LPS能够诱导肝星状细胞NLRP3活性升高,随后使caspase-1表达增加,促进IL-18的合成。IL-18 mRNA表达随LPS浓度增加而下降,随时间延长而表达增加,与在体观察到肝脏IL-18总的变化特点相一致[14]。
总之,本研究表明LPS能够诱导肝星状细胞NLRP3活化,进而导致caspase-1和IL-18表达上调,可能通过各种炎症因子相互作用,导致肝脏IR。由于肝星状细胞活化与肝脏纤维化的发生密切相关,观察NLRP3活化对肝纤维化的影响可能有助于进一步阐明星状细胞在NASH发病中的作用。
参考文献:
[1]Pascale A,Pais R,Ratziu V.An overview of nonalcoholic steatohepatitis:past,present and future directions[J].J Gastrointestin Liver Dis,2010,19(4):415-423.
[2]Kotzampassi K,Giamarellos-Bourboulis EJ,Stavrou G.Obesity as a consequence of gut bacteria and diet interactions[J].ISRN Obes,2014,2014:651895.
[3]Ding S,Chi MM,Scull BP,etal.High-fat diet:bacteria interactions promote intestinal inflammation which precedes and correlates with obesity and insulin resistance in mouse[J].PLoS One,2010,5(8):e12191.
[4]Escobedo G,Lopez-Ortiz E,Torres-Castro I.Gut microbiota as a key player in triggering obesity,systemic inflammation and insulin resistance[J].Rev Invest Clin,2014,66(5):450-459.
[5]Frazier TH,DiBaise JK,McClain CJ.Gut microbiota,intestinal permeability,obesity-induced inflammation,and liver injury[J].JPEN J Parenter Enteral Nutr,2011,35(5 Suppl):14S-20S.
[6]Hotamisligil GS,Erbay E.Nutrient sensing and inflammation in metabolic diseases[J].Nat Rev Immunol,2008,8(12):923-934.
[7]Henao-Mejia J,Elinav E,Jin C,etal.Inflammasome-mediated dysbiosis regulates progression of NAFLD and obesity[J].Nature,2012,482(7384):179-185.
[8]Stienstra R,van Diepen JA,Tack CJ,etal.Inflammasome is a central player in the induction of obesity and insulin resistance[J]. Proc Natl Acad Sci U S A, 2011, 108(37):15324-15329.
[9]Vandanmagsar B,Youm YH,Ravussin A,etal.The NLRP3 inflammasome instigates obesity-induced inflammation and insulin resistance[J].Nat Med,2011,17(2):179-188.
[10]Boaru SG,Borkham-Kamphorst E,Tihaa L,etal.Expression analysis of inflammasomes in experimental models of inflammatory and fibrotic liver disease[J].J Inflamm(Lond),2012,9(1):49.
[11]Boaru SG,Borkham-Kamphorst E,Van de Leur E,etal.NLRP3 inflammasome expression is driven by NF-kappaB in cultured hepatocytes[J].Biochem Biophys Res Commun,2015,458(3):700-706.
[12]Csak T,Ganz M,Pespisa J,etal.Fatty acid and endotoxin activate inflammasomes in mouse hepatocytes that release danger signals to stimulate immune cells[J].Hepatology,2011,54(1):133-144.
[13]Schroder K,Tschopp J.The inflammasomes[J].Cell,2010,140(6):821-832.
[14]Ganz M,Csak T,Nath B,etal.Lipopolysaccharide induces and activates the Nalp3 inflammasome in the liver[J].World J Gastroenterol,2011,17(43):4772-4778.
[15]Ghayur T,Banerjee S,Hugunin M,etal.Caspase-1 processes IFN-gamma-inducing factor and regulates LPS-induced IFN-gamma production[J].Nature,1997,386(6625):619-623.
Effects of lipopolysaccharide on caspase-1 and IL-18 expression in rat hepatic stellate cells
PAN Liangying, LIU Zhenxiong, ZHANG Zhe, ZHAO Li, LI Huiyan, ZHAO Shuguang*
(DepartmentofGastroenterology,TangduHospital,FourthMilitaryMedicalUniversity,Xi’an710038,China;*Correspondingauthor,E-mail:zsg1203@126.com)
Abstract:ObjectiveTo investigate the expression of caspase-1 and IL-18 in hepatic stellate cells when NLRP3 activation is induced by lipopolysaccharide(LPS). MethodsRat hepatic stellate cells were conventionally cultured. The expression levels of NLRP3, caspase-1 and IL-18 mRNA in hepatic stellate cells induced by LPS for 2 h were detected by RT-PCR, and the caspase-1 and IL-18 mRNA expression levels were detected by quantitative PCR at different time points(30,60,120 min) when stellate cells were induced by different doses of LPS(0,0.05,0.1,0.2 μg/ml).Results At 30 min and 60 min, the caspase-1 and IL-18 mRNA expression levels increased in a concentration-dependent manner, and they were significantly higher in 0.1 μg/ml and 0.2 μg/ml group than in 0 μg/ml group(P<0.05). At 120 min, the expression of caspase-1 and IL-18 mRNA was decreased in a concentration-dependent manner, and it was significantly lower in 0.05 μg/ml group than in 0 μg/ml group(P<0.05).With the enlargement of treatment, the caspase-1 and IL-18 mRNA expression was increased in 0.05 μg/ml group, while the caspase-1 mRNA expression decreased in 0.1 μg/ml and 0.2 μg/ml group, it was significantly lower at 120 min than at 30 min(P<0.05). The IL-18 mRNA expression was increased first and then reduced, and peaked at 60 min(P<0.01).ConclusionLPS can promote the inflammasome NLRP3 expression in hepatic stellate cells, activate the NLRP3, and thus induce the HSC-T6 secreting caspase-1 and IL-18.
Key words:LPS;nonalcoholic steatohepatitis;stellate cells;NLRP3 inflammasome
[收稿日期:2015-09-24]
作者简介:潘良盈,女,1987-08生,在读硕士,E-mail:panly1025@163.com.
中图分类号:R575
文献标志码:A
文章编号:1007-6611(2016)01-0010-04
DOI:10.13753/j.issn.1007-6611.2016.01.003
基金项目:国家自然基金资助项目(81170376,81270485)
