昆仑雪菊中黄酮类化合物的提取分离及抗氧化活性评价
2016-05-24宋烨威金红娜徐洁谢宏
宋烨威,金红娜,徐洁,谢宏*
1(沈阳农业大学 食品学院,辽宁 沈阳,110866) 2(苏州禾研生物技术有限公司,江苏 苏州,215600)
昆仑雪菊中黄酮类化合物的提取分离及抗氧化活性评价
宋烨威1,金红娜1,徐洁2,谢宏1*
1(沈阳农业大学 食品学院,辽宁 沈阳,110866) 2(苏州禾研生物技术有限公司,江苏 苏州,215600)
摘要通过正交试验优化提取条件,利用大孔树脂、反相硅胶等柱层析手段对昆仑雪菊的粗提液进行分离,并采用DPPH法对各分离部位进行抗氧化活性评价。结果表明:正交优化分析得到最优提取条件是料液比为1∶20(g∶mL),用体积分数70%的乙醇浸泡、提取昆仑雪菊2次,温度为80℃,时间为1 h,得到最佳昆仑雪菊总黄酮提取率为9.92%;从粗提物中分离得到1个单体化合物,采用核磁共振(NMR)和电喷雾质谱(ESI-MS)鉴定其化学结构为金鸡查尔酮;DPPH活性测定结果表明此化合物的抗氧化活性强于阳性对照芦丁,其IC50为10.21 μg/mL。
关键词昆仑雪菊;提取;分离鉴定;抗氧化活性
昆仑雪菊又名两色金鸡菊(CoreopsistinctoriaNutt.),是菊科(Compositae)金鸡菊属(Coreopsis)一年生草本植物,为新疆特有植物,是目前新疆唯一与雪莲齐名、具有独特功效的稀有高寒植物,主要分布在新疆和田地区海拔高度3 200 m左右的昆仑山区北麓,仅在每年8月绽放一次,花期短暂,且生长面积小,产量极低,因而弥足珍贵[1-2]。它是集养生、保健和药材为一身的天然植物,可治疗燥热烦渴、高血压、心慌、胃肠不适、食欲不振及疮疖肿毒。昆仑雪菊富含黄酮、挥发油、皂苷、氨基酸等生物活性成分[4],是具有广阔前景和研究价值的新品种[4-5]。目前,雪菊的研究多集中于黄酮类化合物的提取及含量测定,对分离纯化、结构鉴定等方面的研究相对较少。赵军等[6]采用大孔树脂、反相色谱柱等纯化,从雪菊中分离得到7个黄酮类化合物。TERESA DIAS[7]利用HPLC-UV、HPLC-MS、硅胶柱色谱等技术得到16种黄酮类化合物,体内大鼠活性实验鉴定结果表明,黄酮类化合物对其具有降血糖作用。
本研究采用正交试验优化昆仑雪菊总黄酮化合物的提取工艺,并以抗氧化活性为指标,采用活性追踪方法,对粗提物进行分离纯化得到单体化合物,采用NMR和ESI-MS鉴定其化学结构,采用1,1-二苯基-2-苦基肼自由基清除法(DPPH法)对化合物进行抗氧化活性评价。
1材料与方法
1.1材料与试剂
昆仑雪菊(北京林鸿茂茶叶有限公司);乙醇、NaOH、浓HCl、醋酸钾、Al(NO3)3、浓H2SO4均为分析纯;甲醇为色谱纯;1,1-二苯基-2-苦基肼(DPPH)、芦丁标准品购于Sigma公司;D101大孔树脂,反相硅胶C18。
1.2主要仪器与设备
电子天平(梅特勒-托利多仪器有限公司),UV-2700紫外分光光度计(岛津仪器有限公司),真空干燥箱(上海一恒科学仪器有限公司),旋转蒸发器、中压制备(BUCHI),恒温磁力搅拌水浴锅(常州迈科诺仪器有限公司),超纯水器(Millipore),离心机(eppendorf),高效液相色谱仪(Agilent 1260),液质联用(Agilent 6100),核磁共振仪(Bruker 400 MHz)。
1.3样品的提取
采用溶剂提取法提取昆仑雪菊中黄酮类化合物,考察乙醇浓度、料液比、提取温度、提取时间进行4因素3水平正交试验,确定总黄酮最佳的提取工艺,因素水平见表1。每组实验称取10 g干燥的昆仑雪菊,分别加入一定浓度、体积的乙醇溶剂,设置温度,提取2次,将提取液浓缩、干燥,备用。

表1 正交实验法优化样品的提取
1.4总黄酮含量测定
1.4.1芦丁标准曲线的绘制
精密吸取芦丁对照品储备液(0.2 mg/mL)1.0、2.0、3.0、4.0、5.0、6.0 mL,分别置于50 mL容量瓶中,分别依次加入100 g/L的Al(NO3)3、9.8 g/L的乙酸钾各1.0 mL,用70%乙醇定容至刻度,摇匀,静置1 h。以70%乙醇为空白,在415 nm下测定吸光值。以芦丁的质量浓度(μg/mL)为横坐标,吸光值A为纵坐标,绘制芦丁标准曲线。得到线性回归方程y=28.221x+0.036 7(R2=0.999 4),表明芦丁标准液的质量浓度在4.0~24.0 μg/mL内,吸光值与浓度的线性关系良好。
1.4.2粗提物中总黄酮含量的测定
精密称取适量的样品粗提物粉末,置于25 mL容量瓶中,用70%乙醇溶解并定容至刻度。作为样品试液。准确吸取1.0 mL样品溶液置于50 mL容量瓶,分别加入100 g/L的Al(NO3)3、9.8 g/L的乙酸钾各1.0 mL,用70%乙醇定容至刻度,摇匀,静置1 h,以空白试液作为参比,按1.4.1中方法测定吸光度,根据标准曲线计算得到粗提物中总黄酮的含量。

(1)
式中:c,根据芦丁标准曲线得质量浓度;V,样品配制的体积;D,样品稀释倍数;m,称量样品的质量;M1,样品提取物总质量;M2,提取用的样品雪菊的质量。
1.5黄酮类化合物分离纯化
1.5.1大孔树脂分离昆仑雪菊中黄酮类化合物
称取适量的昆仑雪菊,采取1.3中优化提取条件提取黄酮类化合物,浓缩得到提取液。将提取液过滤后用D101大孔树脂柱层析进行分离,分别采用30%、60%、90%乙醇溶液进行洗脱,根据液相在线检测结果合并洗脱液,浓缩并检测各部位DPPH抗氧化活性,根据其活性继续追踪分离。
1.5.2中压制备分离纯化昆仑雪菊中黄酮类化合物
对1.5.1中DPPH抗氧化活性最高的部位进行进一步的分离纯化。采用C18反相硅胶柱层析,用25%乙醇等度洗脱,液相在线检测,分离得到化合物,并检测化合物的DPPH抗氧化活性。
1.6DPPH抗氧化活性检测
DPPH溶液的配制:精确称取5.00mgDPPH置于100mL容量瓶中,用75%乙醇溶解并定容,得到浓度为0.05mg/mL的DPPH标准储备液,避光放置,备用。
样品溶液的配制:称取适量的样品置于100mL容量瓶中,用75%乙醇溶解并定容,得到样品溶液,避光放置,备用。
测定方法:精密吸取2.0mLDPPH溶液和2.0mL样品溶液于5mL离心管中,摇匀后避光静置30min,在517nm处测吸光值AI;精密吸取2.0mL样品和2.0mL75%乙醇,摇匀后避光静置30min,在517nm处测吸光值AJ;精密吸取2.0mLDPPH溶液和2.0mL75%乙醇,摇匀后避光静置30min,在517nm处测吸光值AC。每个样品重复3次实验,计算DPPH自由基清除率。采用Excel2007和SPSS16.0统计软件计算半抑制浓度IC50。

(2)
2结果与分析
2.1提取条件优化结果
正交试验结果见表2,4个影响因素对实验结果的影响顺序是:料液比(C)>提取温度(B)>乙醇浓度(A)>提取时间(D)。正交试验结果最佳组合为:C3B2A1D1,即:70%乙醇浸泡昆仑雪菊,料液比1∶30(g∶mL),提取温度为80 ℃,时间为1 h。但考虑经济成本,提取条件优化为:70%乙醇浸泡昆仑雪菊,料液比1∶20,提取温度为80 ℃,时间为1 h,提取2次,总黄酮含量为9.92%,采取此方法对提取昆仑雪菊中黄酮类化合物进行提取。

表2 昆仑雪菊的提取条件优化结果
2.2DPPH抗氧化活性检测
如表3所示,昆仑雪菊粗提物的清除自由基能力优于阳性对照芦丁,说明雪菊具有很好的抗氧化活性,值得深入研究。采用D101对粗提物进行梯度洗脱,并检测各洗脱部位的活性,实验结果显示,60%乙醇洗脱部位的活性明显优于其他部位,说明这个部位可能含有抗氧化活性较好的化合物。因此将此部位用中压继续分离,寻找活性单体。
中压分离得到1个单体化合物K1,液相谱图如图1所示,检测其DPPH活性,IC50为10.21 μg/mL,显著优于阳性对照芦丁,说明K1具有很强的抗氧化活性。液相检测可见60%洗脱部位有较多化合物,后续实验将继续分离,检测活性,分离更多活性较好的单体。
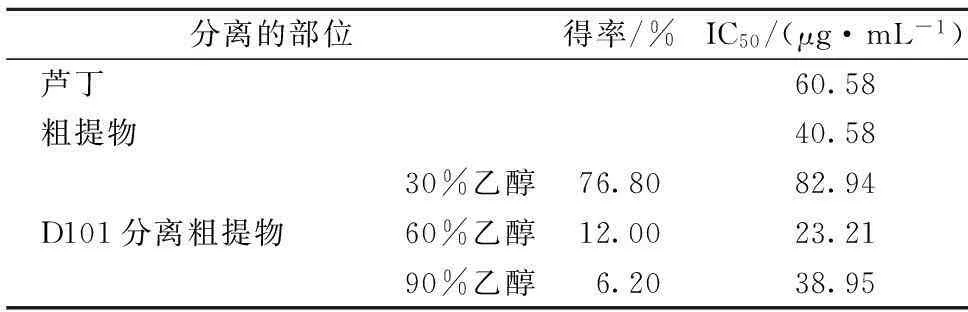
表3 昆仑雪菊各个分离部位的IC50
图1 K1的HPLC色谱图Fig.1 HPLC chromatogram of K1
2.3化合物的结构解析
K1化合物:橙红色粉末;易溶于甲醇;熔点186~189 ℃;10%浓硫酸乙醇显色为红色;ESI-MS m/z 2891H-NMR (CD3OD,400 MHz)δ:7.65(1H,d,J=20 Hz,H-β),7.67 (1H,d,J=8 Hz,H-6′),7.65(1H,d,J=20 Hz,H-α),7.27(1H,d,J=2 Hz,H-2),7.19(1H,dd,J=8,2 Hz,H-6),6.80(1H,d,J=8 Hz,H-5),6.42(1H,d,J=8 Hz,H-5′);13C-NMR(CD3OD,100 MHz)δ:191.97(C=O),153.51(C-2′),152.54(C-4′),148.84 (C-4),145.60(C-3),144.60 (C-β),132.42(C-3′),126.24 (C-1),122.25 (C-6),122.45 (C-6′),117.42 (C-α),113.36 (C-1′),115.75 (C-5),115.79 (C-2),107.64(C-5′)与文献[8]报道基本一致,因此鉴定该化合物为金鸡查尔酮(英文:Okanin)。NMR谱图见图2和图3,金鸡查尔酮的结构式如图4所示。

图2 K113C-NMR谱Fig.2 13C-NMR spectrum of K1
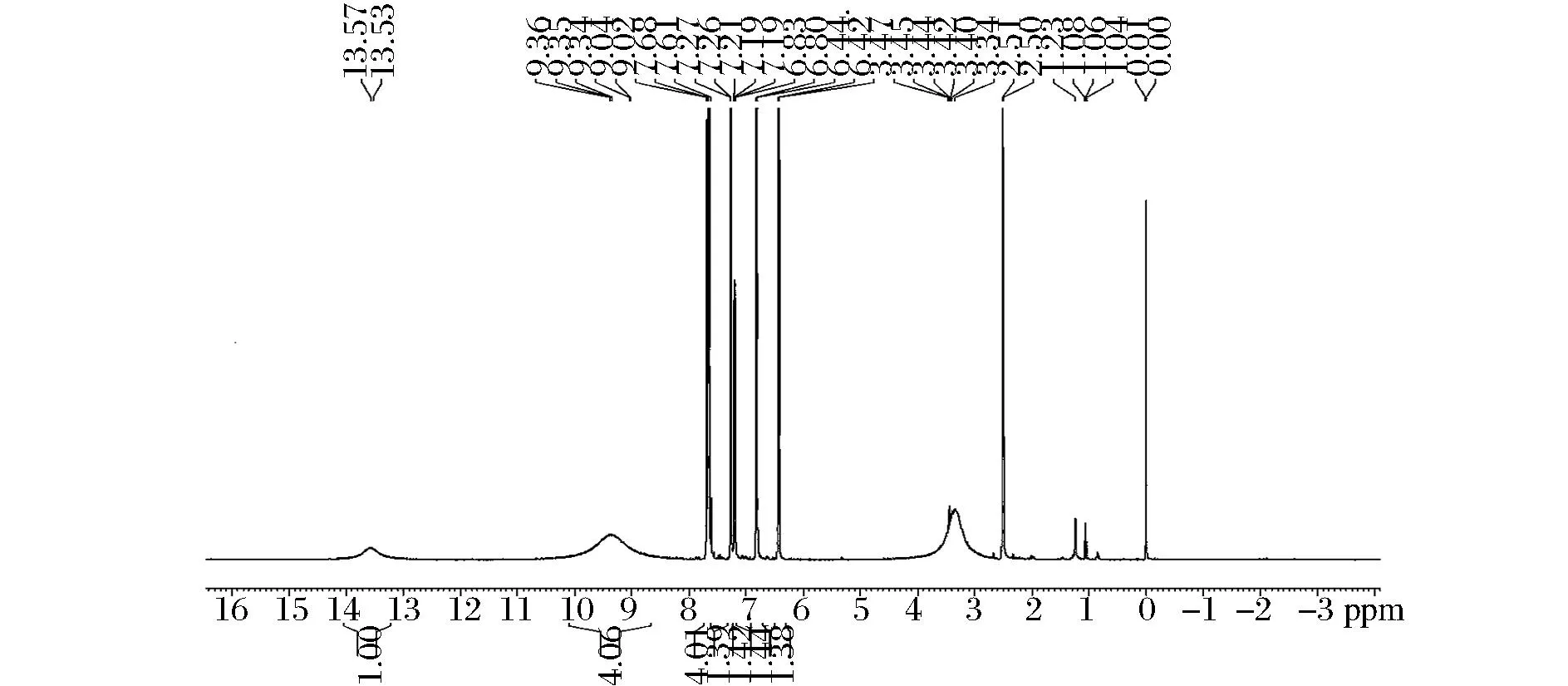
图3 K11H-NMR 谱Fig.3 1H-NMR spectrum of K1
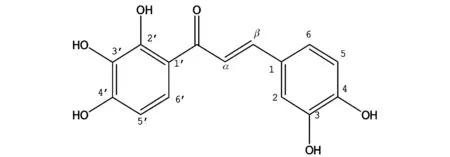
图4 金鸡查尔酮结构Fig.4 Okanin structure
3结论
黄酮类化合物有多种结构类型,查尔酮是其中重要的一种,存在于多种天然植物中,是植物体内合成黄酮的前体。由于查尔酮可结合不同的受体,因此具有广泛的生物活性,本文主要研究其抗氧化活性。
本研究通过正交试验考察了乙醇浓度、料液比、提取温度、提取时间这4个因素对昆仑雪菊总黄酮提取率的影响,利用正交优化分析得到提取条件为料液比1∶20(g∶mL)、70%乙醇浸泡昆仑雪菊,提取温度为80 ℃,提取时间为1 h,在此条件下提取2次,实验结果得到雪菊总黄酮提取率为9.92%。将粗提物通过D101大孔树脂进行梯度洗脱,利用DPPH法评价了各个分离部位提取物的抗氧化活性,并使用反相硅胶C18对活性最好的60%乙醇洗脱部位进行分离纯化,得到1个单体化合物,通过ESI-MS和NMR等手段确定该单体化合物为金鸡查尔酮,测定其IC50为10.21 μg/mL,远低于阳性对照芦丁的IC50值60.58 μg/mL,说明金鸡查尔酮具有很强的抗氧化活性,为深入分析其活性以及进一步开发昆仑雪菊的营养健康功能提供了理论基础。
参考文献
[1]阿不来提·合木提,顾承星,翟德武.和田县平原昆仑雪菊栽培技术[J].新疆农业科技,2011(6):39-40.
[2]木合布力·阿布力孜,张兰,张敏.昆仑雪菊中氨基酸的含量分析[J].医药导报,2011,30(4):431-432.
[3]木合布力·阿布力孜,张燕,景兆均,等.新疆昆仑雪菊化学成分的初步定性研究[J].新疆医科大学学报,2010,33(6):628-630.
[4]SMITH E B,PARKER H M.A biosystematic study ofCoreopsistinctoriaandC.cardaminefolia(compositae)[J].Brittonia,1971,23(2):161-170.
[5]DIAS T,BRONZE M R,HOUGHTON P J,et al.The flavonoid-rich fraction ofCoreopsistinctoriapromotes glucose tolerance regain through pancreatic function recovery in streptozotocin-induced glucose-intolerant rats[J].Journal of Ethnopharmacology,2010,132(2):483-490.
[6]赵军,孙玉华,徐芳,等.昆仑雪菊黄酮类成分研究[J].天然产物研究与开发,2013(25):50-52.
[7]DIAS T,MOTA-FILIPE H,LIU B,et al.Recovery of oral glucose tolerance by wistar rats after treatment with coreopsis tinctoria infusion[J].Phytotherapy Research,2010,24(5):699-705.
[8]KWON J W. Antioxidative and Hepatoprotective Effect of Compounds from the Flowers of Bidens bipinnata L[J]. Pharmacogn,2009,40(4):345-350.
Isolation and identification of the flavonoids compounds fromCoreopsistinctoriaNutt. and evaluation of their antioxidant activities
SONG Ye-wei1, JIN Hong-na1, XU Jie2, XIE Hong1*
1(College of FoodScience,Shenyang Agricultural University,Shenyang 110866,China) 2(Suzhou Herb-Res Biotechnology Co.,Ltd,Suzhou 215600,China)
ABSTRACTThe total flavonoids were extracted from Coreopsis tinctoria Nutt. using the orthogonal experiment to optimize the extraction conditions, using macroporous resin and reverse phase silica gel column chromatography to separate crude extract, and using a method of DPPH to evaluate the antioxidant activity of each separate part. The results show that the optimum extraction conditions is using 70% ethanol as the extraction solvent for Coreopsis tinctoria Nutt., material liquid ratio of 1∶20, extracting twice at 80 ℃, extracting 1 h each time, the total flavonoids extraction rate is 9.92%; a single compound named Okanin was isolated from the crude extract, and its structure was identified by nuclear magnetic resonance (NMR) and electrospray ionization mass spectrometry (ESI-MS). DPPH activity test results show that the antioxidant activity of the compound is better than that of the positive control Rutin, whose IC50is 10.21 μg/mL.
Key wordsCoreopsis tinctoria Nutt.; extraction; structure identification; antioxidant activity
收稿日期:2015-09-11,改回日期:2015-11-03
DOI:10.13995/j.cnki.11-1802/ts.201604040
第一作者:硕士研究生(谢宏副教授为通讯作者,E-mail:syxiehong@163.com)。
