板栗壳原花青素的提取及体外抑菌作用研究
2016-05-24韦琴乐薇吕凯波杨文婷朱文婷
韦琴,乐薇,吕凯波,杨文婷,朱文婷
(武汉工商学院 环境与生物工程学院,湖北 武汉,430065)
板栗壳原花青素的提取及体外抑菌作用研究
韦琴*,乐薇,吕凯波,杨文婷,朱文婷
(武汉工商学院 环境与生物工程学院,湖北 武汉,430065)
摘要采用超声波提取法对板栗壳原花青素(procyanidins from chestnut shells, CSPCs)进行提取工艺优化,在单因素的基础上以提取溶剂体积比、超声波提取时间、料液比为考察因素,以原花青素的得率(mg/g)为指标,采用正交试验优选最佳提取工艺;采用滤纸片法测定抑菌圈大小,采用试管二倍梯度稀释法测定最小抑菌浓度(mini muminhibition concentrations,MIC)。结果表明:板栗壳原花青素最佳提取工艺条件是以乙醇为最佳提取溶剂,乙醇体积分数为65%,料液比为1∶30(g∶mL),超声时间为50 min;板栗壳原花青素对真菌类的白色念珠菌和啤酒酵母菌均有抑菌作用,对金黄色葡萄球菌有抑菌作用,对大肠杆菌无抑菌作用,抑菌效果由大到小依次为:啤酒酵母菌>金黄色葡萄球菌>白色念珠菌,MIC依次为0.120、0.958、3.831 mg/mL。
关键词板栗壳;原花青素;提取;抑菌活性
原花青素是一类由不同数量的儿茶素、表儿茶素或没食子酸经C4-C6或C4-C8键缩合而成的聚多酚类物质[1]。原花青素在自然界广泛分布,种类繁多,能有效清除体内自由基,具有抗氧化、抗辐射、抗癌、预防心脑血管疾病等多种生理活性。板栗,是一类山毛榉科植物,人们习惯称其为栗子,属于落叶乔木种类。板栗在我国的种植时间长达3万年之久,其栽植面积和生产量在近几年都讯速增长,每年的产量均超过100万t。板栗壳一直以来大部分仍然采用焚烧和自然腐败的方法处理后遗弃,如果充分利用这些资源则可以产生更多经济效益。
本研究以板栗壳为原料,采用超声波提取法对板栗壳原花青素进行提取工艺优化,并探讨了板栗壳原花青素的抑菌作用。
1材料与方法
1.1材料与仪器
板栗,湖北罗田;原花青素标准品(含量>98%),天津尖峰天然产物开发公司;无水乙醇、 甲醇、乙酸乙酯、正丁醇、浓HCl、硫酸铁铵、NaOH、异丙醇、均为分析纯;AB-8大孔树脂,天津市海光化工有限公司;供试菌种:金黄色葡萄球菌、大肠杆菌、啤酒酵母菌、白色念珠菌,均由武汉工商学院微生物学实验室提供。
XW-80A微型旋涡混合仪,上海泸西分析仪器厂有限公司;KQ3200E型超声波清洗器,超声频率40 kHz,昆山市超声仪器有限公司;DG120型四两装中药材粉碎机,浙江省瑞安市春海药材器械厂; HH系列恒温水浴锅,江苏金坛中大仪器厂;TDZ5-WS湘麓离心机,长沙湘麓离心机仪器有限公司;722E型可见分光光度计,上海光谱仪器有限公司;HL-2恒流泵,BSZ-160型自动部分收集器,上海青蒲沪西仪器厂;旋转蒸发仪,上海亚荣生化仪器厂;真空冷冻干燥机,北京博医康实验仪器有限公司。
1.2实验方法
1.2.1板栗壳原花青素的提取工艺优化
1.2.1.1样品预处理
新鲜板栗取板栗壳在40 ℃烘箱中48 h烘干,粉碎,过40目筛,用正己烷浸泡并在温室摇床(150 r/min)中脱脂24 h,真空过滤,滤渣置于通风橱24 h以去除残留的正己烷,得板栗壳粉末,干燥容器中保存备用。
1.2.1.2标准曲线的绘制[2-3]
配制质量浓度为1.0 mg/mL的原花青素标准品溶液,然后分别取0、0.1、0.2、0.3、0.4、0.5 mL,用60%的乙醇定容至2 mL容量瓶中,各取1.0 mL,分别加入6.0 mL正丁醇-盐酸溶液(体积比95∶5)和0.2 mL 2%硫酸高铁铵溶液,摇匀后沸水浴加热40 min,显色后立即使用冰水冷却,快速用可见分光光度计于550 nm处比色测定,绘制原花青素含量测定标准曲线,得到回归方程y=0.860 3x-0.001 5(x为原花青素标准品浓度,mg/mL;y为吸光度),相关系数R2=0.999 8,表明原花青素对照品吸光度与原花青素浓度之间具有良好的线性关系。
1.2.1.3板栗壳原花青素提取的单因素实验
本实验选取不同的提取溶剂、溶剂的浓度、料液比、超声时间4个因素进行单因素试验,具体方法如下:
准确称取预处理过板栗壳粉末1.0 g,分别加入体积分数60%甲醇、60%乙醇、乙酸乙酯、蒸馏水,在料液比为1∶40(g∶mL),超声时间为30 min的条件下提取板栗壳原花青素,3 000 r/min离心10 min,上清液定容到100 mL,取1 mL,按照1.2.1.2显色并测定吸光度,通过标准曲线方程计算得到样品液中原花青素的浓度。根据公式1可计算原花青素得率。考察不同的提取溶剂对原花青素得率的影响。
原花青素得率/(mg·g-1)=
(1)
准确称取预处理过板栗壳粉末1.0 g,分别加入体积分数为50%、55%、60%、65%、70%的提取溶剂,在料液比为1∶40,超声时间为30 min的条件下提取板栗壳原花青素,3 000 r/min离心10 min,上清液定容到100 mL,后续步骤同上。考察提取溶剂的体积分数对原花青素得率的影响。
准确称取预处理过板栗壳粉末1.0 g,加入体积分数为60%的提取溶剂,料液比(g∶mL)分别为1∶10、1∶20、1∶30、1∶40、1∶50、1∶60,超声30 min,3 000 r/min离心10 min,上清液定容到100 mL,后续步骤同上。考察料液比对原花青素得率的影响。
准确称取预处理过板栗壳粉末1.0 g,加入体积百分比为60%的提取溶剂,料液比为1∶40,超声时间分别为10、20、30、40、50、60,3 000 r/min离心10 min,上清液定容到100 mL,后续步骤同上。考察超声时间对原花青素得率的影响。
1.2.1.4板栗壳原花青素的正交试验优化
按照单因素试验结果,选择溶剂体积分数、料液比、超声时间进行正交试验,正交试验因素水平设计表见表1。
1.2.1.5验证性实验
按照正交试验选定的最佳提取条件进行提取,做5组平行试验,取平均值作为最佳提取条件下板栗壳原花青素的得率。

表1 正交试验设计因素与水平
1.2.2板栗壳原花青素粗提液的纯化与冻干粉纯度测定
将预先处理好的AB-8大孔吸附树脂湿法装柱并平衡静置12 h后,将最佳实验条件下提取的原花青素粗提液以2 mL/min流速上柱吸附,吸附平衡后用4倍柱体积的蒸馏水冲洗去除水溶性色素和多糖等杂质,再用体积分数50%乙醇溶液以1 mL/min流速洗脱,收集洗脱液[4]。使用旋转蒸发仪将收集的洗脱液进行浓缩,将浓缩液于真空冷冻干燥,除去残留乙醇和水分,制成板栗壳原花青素冻干粉,放入冰箱-20 ℃保存备用。
称取板栗壳原花青素冻干粉10 mg,用体积分数60%乙醇溶解并定容至50 mL容量瓶中。摇匀后取1 mL,按照1.2.1.2显色并测定吸光度,通过标准曲线方程计算得到原花青素的浓度。做3次平行试验,取平均值。根据公式2计算冻干粉中原花青素的纯度。
原花青素纯度/%=
(2)
1.2.3板栗壳原花青素的体外抑菌试验
1.2.3.1培养基的制备
牛肉膏蛋白胨培养基:牛肉膏3 g,蛋白胨10 g,NaCl 5 g,水1 000 mL,固体培养基另加琼脂20 g。加热溶解,调pH 7.0~7.2,分装,121 ℃灭菌20 min,用于培养金黄色葡萄球菌和大肠杆菌[5]。豆芽汁葡萄糖培养基:称新鲜黄豆芽100 g,放入大烧杯中,加水1 L,煮沸约30 min,用6层纱布过滤弃掉滤渣,加入葡萄糖50 g,再加水补足至原量,pH自然,融化后分装,121 ℃灭菌20 min,用于培养啤酒酵母菌。察氏培养基:NaNO33 g,K2HPO41 g,MgSO4·7H2O 0.5 g,KCl 0.5 g,FeSO40.01 g,蔗糖30 g,蒸馏水1 L,固体培养基另加琼脂20 g,自然pH,加热溶解分装后,121 ℃灭菌20 min,用于培养白色念珠菌。
1.2.3.2菌种的活化及菌悬液的制备
在超净工作台上将供试菌种接种到各自的液体培养基上活化2次,每次活化细菌37 ℃培养36 h,真菌28 ℃培养48 h。然后用接种环蘸取活化的菌种划斜面,待斜面长出后放入4 ℃冰箱备用,使用前用接种环挑取斜面种到无菌生理盐水中,制成菌体浓度为105~106个/mL的菌悬液,用振荡器摇匀,备用。
1.2.3.3滤纸片法测定板栗壳原花青素的抑菌作用
用打孔器制好直径6 mm滤纸片若干放入干燥培养皿中灭菌,放入干燥箱中干燥备用。将事先准备好的培养基融化,在无菌操作台上倒入直径为9 cm的培养皿中,每皿约20 mL,待皿中培养基凝固冷却后,加入0.2 mL已制备好的菌悬液并涂布均匀。用镊子夹取干燥后的滤纸片分别蘸取板栗壳原花青素冻干粉配置的不同浓度的水溶液、无菌水、体积分数75%乙醇溶液后放入涂布后的平板上,每皿放入5片滤纸片,其中3片为浸泡原花青素纯化液的滤纸片(3个平行试验),1片为浸泡无菌水的滤纸片,作为阴性对照,另1片为浸泡75%乙醇溶液的滤纸片,作为细菌的阳性对照。每个样品重复3皿,测量结果取平均值。将处理好的培养皿倒置放入培养箱中培养24~36 h,细菌37 ℃培养,真菌28 ℃培养,培养后用游标卡尺采用十字交叉法测量抑菌圈直径(mm),结果取平均值[6]。
1.2.3.4试管二倍梯度稀释法测定最小抑菌浓度(MIC)[7-8]
取若干试管洗净灭菌干燥待用,对5种供试菌分别进行研究。将11支试管编号,从第2号管开始每管加入5 mL无菌去离子水,在第1号管中加入纯化后的浓度为7.662 mg/g的板栗壳原花青素溶液10 mL,从第1号管开始取5 mL样品溶液到下一管中并摇匀,依次稀释,最后一管取5 mL溶液弃掉。然后每管中加入5 mL液体双料培养基,接种0.5 mL菌液,并摇匀。以5.5 mL无菌去离子水加5 mL双料培养基为0号阴性对照,以5.5 mL无菌去离子水加5 mL双料培养基接种0.5 mL菌液为12号阳性对照。将处理好的样品放入培养箱培养24~36 h,观察试管中液体浑浊情况并测定各样品在600 nm处吸光度值,当某管不再发生浑浊现象且吸光度值接近于空白对照时该管原花青素浓度即为MIC。
2结果与分析
2.1单因素实验结果
2.1.1提取溶剂的确定
不同提取溶剂对板栗壳原花青素得率的影响见图1。结果表明,提取效果最好的是体积分数60%甲醇和60%乙醇,60%的甲醇略高。由于考虑到甲醇毒性比乙醇大,且两者在60%的浓度下提取的得率比较接近,考虑到试验安全性和成本使用情况,选用乙醇作为最佳提取溶剂。

图1 不同提取溶剂对板栗壳原花青素得率的影响Fig.1 Effect of solvent on the CSPCs yield
2.1.2乙醇体积分数对原花青素得率的影响
乙醇体积分数对原花青素得率的影响见图2。结果表明,板栗壳原花青素的得率随乙醇体积分数的增长而增长,当乙醇体积分数到达最大值60%时,原花青素得率最大,随后降低。乙醇体积分数过高反而不利于原花青素的提取,因此选择60%乙醇为最佳提取浓度。

图2 乙醇体积分数对板栗壳原花青素得率的影响Fig.2 Effect of ethanol percentage on the CSPCs yield
2.1.3料液比对原花青素得率的影响
料液比对原花青素得率的影响见图3。

图3 料液比对板栗壳原花青素得率的影响Fig.3 Effect of solid-liquid ratio on the CSPCs yield
结果表明,一般来说随着溶剂体积的增加,原花青素得率也相应增加。当料液比大于1∶40时,原花青素的得率不再增加,反而有所降低,溶剂使用量增大会导致杂质的产生,影响原花青素的提取,同时考虑到成本使用情况,选择1∶40为最佳料液比。
2.1.4超声时间对原花青素得率的影响
超声时间对原花青素得率的影响见图4。结果表明,随着超声时间的增加原花青素得率增加,在40 min时原花青素的溶出量最大,提取效果最好。之后再延长提取时间,原花青素得率不仅无明显提高,反而下降,可能是超声提取时间的延长加速了原花青素的氧化分解。因此,选择最佳超声时间为40 min。

图4 超声时间对板栗壳原花青素得率的影响Fig.4 Effect of ultrasonic extraction time on the CSPCs yield
2.2正交试验结果
以原花青素的得率为参考指标,由表2可知各因素对板栗壳原花青素得率的影响大小依次为:A>C>B,即乙醇体积分数>超声时间>料液比。表2由表3方差分析来看,A(乙醇体积分数)对得率影响显著,B(料液比)和C(超声时间)影响不显著。从直观分析来看,板栗壳原花青素的最佳提取条件为A3B1C3,即乙醇浓度65%、料液比1∶30、超声时间50 min。

表2 正交试验方案及结果分析

表3 正交试验方差分析
注:F0.05(2,2)=19.00,F0.01(2,2)=99.00,*显著 。
2.3验证性实验
在最佳提取条件下,做5次平行试验得到原花青素得率分别为36.67、35.86、37.02、35.39、36.44 mg/g。平均值为36.27 mg/g,RSD值为1.79%,相对标准偏差较小,表明该实验重现性良好。
2.4纯化所得板栗壳原花青素冻干粉纯度的测定
结果表明,平行试验3次所得原花青素纯度分别为78.17%、76.42%、75.26%,纯化所得冻干粉纯度取平均值为76.62%,RSD值为1.91%,相对标准偏差较小,表明该实验重现性良好。
2.5滤纸片法测定板栗壳原花青素的抑菌作用
由表4可知,对照组中蒸馏水对各供试菌无抑菌效果,75%乙醇溶液对细菌类金黄色葡萄球菌和大肠杆菌有抑制作用,对真菌类的白色念珠菌和啤酒酵母菌无抑菌作用。质量浓度在3.831~11.493 mg/mL的板栗壳原花青素对真菌类的白色念珠菌和啤酒酵母菌均有抑菌作用,对金黄色葡萄球菌有抑菌作用,对大肠杆菌无抑菌作用。总体来说,板栗壳原花青素随着质量浓度的提高,对金黄色葡萄球菌、啤酒酵母菌和白色念珠菌抑菌圈增大,抑菌作用增强,抑菌效果和原花青素浓度呈一定正相关。质量浓度为7.662 mg/mL及以上的原花青素溶液对金黄色葡萄球菌、啤酒酵母菌和白色念珠菌的抑制效果均要强于75%乙醇溶液。

表4 抑菌圈试验结果比较
注:实验数据为3次平行实验的平均值,抑菌圈直径包括滤纸片直径6.00 mm。
质量浓度为11.493 mg/mL的CSPCs对金黄色葡萄球菌的抑制效果如图5所示。
综合各因素判断板栗壳原花青素对4种供试菌的抑菌效果次序为:啤酒酵母菌>金黄色葡萄球菌>白色念珠菌>大肠杆菌。
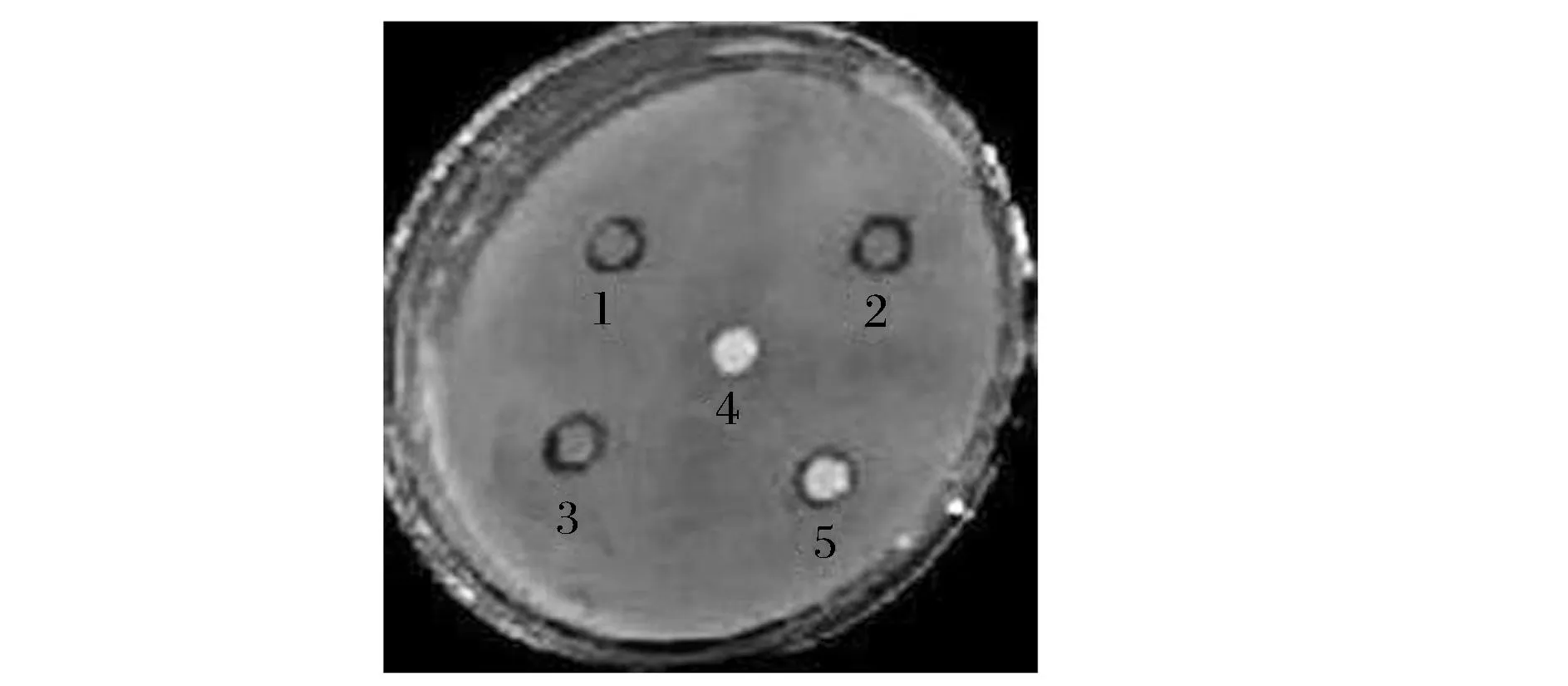
1、2、3-11.49 mg/mL的CSPCs3次平行试验;4-蒸馏水;5-75%乙醇图5 板栗壳原花青素抑制金黄色葡萄球菌效果照片Fig.5 Photo of CSPCs inhibit Staphylococcus aureus
2.6板栗壳原花青素MIC的测定
由表5可知,质量浓度在0.007~7.662 mg/mL的板栗壳原花青素对大肠杆菌无明显抑菌效果,对金黄色葡萄球菌、白色念珠菌、啤酒酵母菌的最小抑菌浓度依次为0.958、3.831、0.120 mg/mL。可见板栗壳原花青素对4种供试菌的抑菌效果次序为:啤酒酵母菌>金黄色葡萄球菌>白色念珠菌>大肠杆菌。

表5 MIC的测定结果
注:“-”表示无菌生长,“+”表示少量菌生长,“++”表示有菌大量生长。
3结论
(1)正交试验优化法中板栗壳原花青素的最佳提取工艺为乙醇体积分数65%、超声时间50 min、料液比1∶30。
(2)本试验中用于抑菌研究的板栗壳原花青素是经过AB-8大孔树脂吸附纯化后的产物,浓缩后经过真空冷冻,除去了乙醇和水分,最终形成了干燥粉。干燥粉中除去了乙醇的残留对抑菌作用的影响,使得试验结果更加可靠。
(3)抑菌作用研究显示,板栗壳原花青素在0.007~11.493 mg/mL浓度范围内对革兰氏阴性杆菌类的大肠杆菌无抑菌作用,对革兰氏阳性菌类的金黄色葡萄球菌有一定的抑菌效果,MIC为0.958 mg/mL,对真菌类的白色念珠菌和啤酒酵母菌也均有抑菌效果,MIC分别为3.831 mg/mL和0.120 mg/mL。参考文献[9]研究了葡萄皮渣中原花青素的抑菌作用,其中提及在3~8 mg/mL内葡萄皮渣中原花青素对革兰氏阴性杆菌中的大肠杆菌无抑菌作用,对革兰氏阳性菌类的金黄色葡萄球菌有抑菌作用;参考文献[10]报道了葡萄籽原花青素对真菌类的白色念珠菌有抑制作用,这些报道与本研究中板栗壳原花青素的抑菌性是有一致性的,说明板栗壳原花青素可以作为对抗革兰氏阳性球菌和对抗真菌类的白色念珠菌的一种潜在新药。本研究只是对板栗壳原花青素的提取和抑菌活性进行了初步报道,关于其抑菌的确切机制还有待深入的研究和探讨。
参考文献
[1]姜贵全.落叶松树皮原花青素的分级纯化及催化降解研究[D].哈尔滨:东北林业大学,2013.
[2]中华人民共和国卫生部.保健食品检验与评价技术规范(2003年版)[S].
[3]温志英,曹妍.响应面法优化花生红衣原花青素微波辅助提取工艺[J].中国粮油学报, 2011, 26(6):97-101.
[4]张海晖,段玉清,李金凤,等.板栗壳原花青素大孔吸附树脂分离纯化工艺优化[J].农业机械学报,2011,42(5):155-159.
[5]郭东贵, 王寒, 朱晓鹤,等.山慈姑体外抑菌活性的初步研究[J].时珍国医国药, 2009, 20(3):594-595.
[6]单文荣,李俊霞,刘花粉.滤纸片法筛选不同活性物对棉花黄萎病菌抑制效果研究[J].中国农学通报,2010,26(19):285-289.
[7]祝瑞雪,曾维才,赵志峰,等.汉源花椒精油的化学成分分析及其抑菌作用[J].食品科学,2011,32(17):85-88.
[8]陈沙,罗秋水,张凤英.越橘粗体物体外抑菌活性及稳定性的研究[J].食品工业科技,2012,33(9):158-162.
[9]方莉,王静,许媛,等. 葡萄皮渣中原花青素对临床常见分离菌的抗菌效应分析[J].重庆医学,2015,44(4):453-455.
[10]董波, 刁天娇, 李益玲,等. 葡萄籽原花青素对白色念珠菌抑菌作用的体外研究[J]. 中国微生态学杂志, 2015,27(1):49-51.
Study on extracting technology by orthogonal design and antibacterial activity of procyanidins from chestnut shells
WEI Qin*, YUE Wei, LYU Kai-bo, YANG Wen-ting, ZHU Wen-ting
(Environmental and Biological Engineering College,Wuhan Technology and Bussiness University,Wuhan 430065,China)
ABSTRACTThis paper reported the optimization of extraction process of procyanidins from chestnut shells, CSPCs by orthogonal design. On the basis of single-factor experiments, with procyanidins yield (mg/g) as an index,three extraction factors including ethanol percentage,solid-liquid ratio and ultrasonic extraction time were optimized. At the same time, mini muminhibition concentrations,MIC were determined by filter paper method and tube double dilution method. The optimum process conditions were ethanol concentration of 65%, solid-liquid ratio of 1∶30 (g∶mL), and ultrasonic extraction time of 50 min. The CSPCs had a certain inhibitory effect on Staphylococcus aureus, Monilia albican and Saccharomyces cerevisiae, but had no inhibitory effect on Escherichia coli. The inhibitory effect is from strong to weak in the order: Saccharomyces cerevisiae>Staphylococcus aureus>>Monilia albican. Its MIC was 0.120 mg/mL, 0.958 mg/mL and 3.831 mg/mL, respectively.
Key wordschestnut shell; procyanidins; extraction; antibacterial activity
收稿日期:2015-09-06,改回日期:2015-10-27
基金项目:湖北省教育厅科学技术研究项目(No. B2015336);武汉工商学院校级科学研究项目(No. A2014022)
DOI:10.13995/j.cnki.11-1802/ts.201604039
第一作者:硕士,讲师(本文通讯作者,E-mail:53471348@qq.com)。
