响应面法优化山樱桃多酚提取工艺及其抗氧化活性研究
2016-05-24公衍玲王沙沙
公衍玲,刘 洋,王沙沙
(青岛科技大学化工学院,山东 青岛 266042)
响应面法优化山樱桃多酚提取工艺及其抗氧化活性研究
公衍玲,刘洋,王沙沙
(青岛科技大学化工学院,山东 青岛 266042)
摘要:对山樱桃多酚的乙醇回流提取工艺条件进行了优化并研究了其抗氧化活性。以多酚得率为评价指标,采用分光光度法测定吸光度,通过单因素实验筛选得到山樱桃多酚乙醇回流提取工艺的主要影响因素为液料比、乙醇浓度、回流时间;然后采用星点设计-响应面法确定最佳提取工艺为:液料比16∶1(mL∶g)、乙醇浓度68%、回流时间90 min、回流温度90 ℃,在此条件下多酚得率预测值为1.172%,实测平均值为1.166%,RSD为0.55%;山樱桃多酚具有较强的抗氧化活性,对羟基自由基及超氧阴离子自由基均有较强的清除作用。
关键词:山樱桃;多酚;提取;响应面法;抗氧化活性
山樱桃又名毛樱桃,属蔷薇科李属植物,落叶灌木,其果实为球形,性味甘温,有调中、益脾之功效,可治疗四肢瘫痪、风湿腰疼等症状[1-3]。山樱桃的营养价值非常高,除含蛋白质、碳水化合物外,还含有钙、磷、钾和多种维生素以及花青素、黄酮醇和酚酸等多酚类物质[4-5]。研究表明,多酚具有较强的抗氧化[6-11]、清除自由基[12]、防治心脑血管疾病[13-15]和抗肿瘤等作用[16-17]。近年来,多酚类化合物凭借其良好的药理作用受到研究者的广泛关注,山樱桃作为提取多酚类物质的理想材料,具有良好的市场前景[18-21]。鉴于此,作者采用传统乙醇回流法提取山樱桃多酚,通过单因素实验筛选主要影响因素;再通过星点设计-响应面法优化提取工艺,并对山樱桃多酚的抗氧化活性进行研究,拟为山樱桃的进一步开发利用提供依据。
1实验
1.1材料、试剂与仪器
山樱桃,采自青岛崂山,经青岛科技大学化工学院中药学副教授金宏老师鉴定为蔷薇科植物山樱桃的果实。
没食子酸标准品,上海中药标准化研究中心;三氯乙酸,上海山浦化工有限公司;抗坏血酸、三羟甲基氨基甲烷、邻苯三酚,国药集团化学试剂有限公司;其它试剂均为市售分析纯。
T6型新世纪紫外可见分光光度计,北京普析通用仪器有限公司;HH-4型数显恒温水浴锅,常州华普达教学仪器有限公司;6YP02N型电子天平,上海精密科学仪器有限公司;RE-52型旋转蒸发器,上海亚荣生化仪器厂。
1.2方法
1.2.1山樱桃多酚的提取
精确称取4.0g山樱桃果肉,切块,充分捣碎成粗浆,装入蒸馏瓶。加入乙醇溶液,充分振摇后放入水浴锅中充分冷凝回流提取,得粗提液。待粗提液冷却后,用真空抽滤机减压抽滤。滤液旋转蒸发挥去乙醇,浓缩至一定体积作为提取液。
1.2.2山樱桃多酚得率的测定
没食子酸标准曲线的绘制:精密称取干燥后的没食子酸标准品5.0mg于5mL容量瓶中,加水溶解并定容至刻度,摇匀,得1.0mg·mL-1没食子酸标准溶液;精密量取没食子酸标准溶液1.0mL于10mL容量瓶中,加入5mL10%福林酚试剂,摇匀,静置2~3min;再加入4mL7.5mg·mL-1Na2CO3溶液,摇匀,静置60min,测定其在770nm处吸光度,绘制没食子酸标准曲线。
精密量取提取液1.0mL,按上述方法测定吸光度,根据标准曲线计算提取液中多酚质量,按下式计算多酚得率:

1.2.3单因素实验
1)液料比的选择
固定回流温度为90 ℃、回流时间为90 min、乙醇浓度为70%,在液料比(mL∶g,下同)分别为5∶1、10∶1、15∶1、20∶1、25∶1的条件下提取山樱桃多酚,测定多酚得率,选择适宜液料比。
2)乙醇浓度的选择
在确定液料比的情况下,在回流温度为90 ℃、回流时间为90 min、乙醇浓度分别为50%、60%、70%、80%、90%的条件下提取山樱桃多酚,测定多酚得率,选择适宜乙醇浓度。
3)回流温度的选择
在确定液料比和乙醇浓度的情况下,在回流时间为90 min、回流温度分别为60 ℃、70 ℃、80 ℃、90 ℃、100 ℃的条件下提取山樱桃多酚,测定多酚得率,选择适宜回流温度。
4)回流时间的选择
在确定液料比、乙醇浓度和回流温度的情况下,在回流时间分别为30 min、60 min、90 min、120 min、150 min的条件下提取山樱桃多酚,测定多酚得率,选择适宜回流时间。
1.2.4星点设计-响应面法实验
在单因素实验的基础上,以多酚得率为响应值,进行星点设计-响应面法实验,进一步优化乙醇回流法提取山樱桃多酚的工艺条件。
1.2.5山樱桃多酚抗氧化活性的测定
1.2.5.1抗氧化活性用山樱桃多酚提取液的制备
在最优工艺条件下提取山樱桃多酚,分别配制成浓度为0.0625 g·mL-1、0.125 g·mL-1、0.25 g·mL-1、0.5 g·mL-1、1.0 g·mL-1的山樱桃多酚提取液。
1.2.5.2清除羟基自由基活性测定
在具塞试管中依次加入9 mmol·L-1FeSO4溶液1 mL、9 mmol·L-1水杨酸-乙醇溶液1 mL、不同浓度的山樱桃多酚提取液1 mL,再加入6 mmol·L-1H2O2溶液1 mL,开始反应,并在37 ℃下水浴30 min后,测定510 nm处吸光度。每个具塞试管做3个平行,取平均值。空白对照组以相同体积蒸馏水代替山樱桃多酚提取液。
考虑到山樱桃多酚提取液在510 nm处可能存在吸收,用相同体积的蒸馏水代替H2O2溶液,其余均相同,测定510 nm处吸光度。每个具塞试管做3个平行,取平均值。维生素C作为阳性对照。按下式计算清除率:

式中:A0为空白对照组的吸光度;Ax为加H2O2时山樱桃多酚提取液的吸光度;Ax0为不加H2O2时山樱桃多酚提取液的吸光度。
1.2.5.3清除超氧阴离子自由基活性测定
参照文献[22],采用邻苯三酚自氧化法测定山樱桃多酚清除超氧阴离子自由基的活性。首先取0.05 mol·L-1pH值为8.2的Tris-HCl缓冲液5 mL于具塞试管中,分别加入1 mL不同浓度的山樱桃多酚提取液,25 ℃水浴20 min后,再加入3 mmol·L-1邻苯三酚(于棕色瓶中现配)0.4 mL,摇匀,于25 ℃水浴反应4 min后,立即用0.5 mL 10 mmol·L-1盐酸终止反应,测定320 nm处吸光度。每个具塞试管做3个平行,取平均值。空白对照组以相同体积的Tris-HCl缓冲液代替山樱桃多酚提取液。
考虑到山樱桃多酚提取液在320 nm处可能存在吸收,用相同体积的Tris-HCl缓冲液代替邻苯三酚溶液,其余均相同,测定320 nm处吸光度。每个具塞试管做3个平行,取平均值。维生素C作为阳性对照。按下式计算清除率:

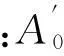
2结果与讨论
2.1山樱桃多酚提取的单因素实验
2.1.1液料比对多酚得率的影响(图1)
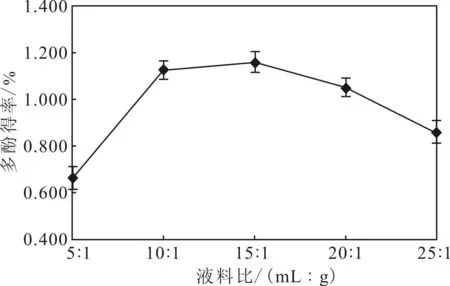
图1 液料比对多酚得率的影响
由图1可以看出,在开始阶段多酚得率随着液料比的增大而升高;当液料比为15∶1时,多酚得率达到最高;继续增大液料比,多酚得率反而下降。这是因为,在温度一定的条件下,物质的溶解度是恒定的,因此多酚得率随着液料比的增大而升高,但当液料比增大到一定值时,多酚已基本溶出,此时增加溶剂对多酚得率影响不大。因此,选择液料比15∶1为星点设计-响应面法实验的中心条件。
2.1.2乙醇浓度对多酚得率的影响(图2)

图2 乙醇浓度对多酚得率的影响
由图2可以看出,多酚得率随着乙醇浓度的增大先升高后降低,在乙醇浓度为70%时达到最高。根据相似相溶原理,与山樱桃多酚极性相似的溶剂可以使其充分溶于溶剂中从而被提取出来。乙醇浓度过低,溶剂对氢键的破坏力不强,多酚得率不高;乙醇浓度过高,溶剂极性低,导致多酚得率下降。因此,选择乙醇浓度70%为星点设计-响应面法实验的中心条件。
2.1.3回流温度对多酚得率的影响(图3)

图3 回流温度对多酚得率的影响
由图3可以看出,多酚得率随着回流温度的升高呈先升高后降低趋势,在回流温度为90 ℃时,多酚得率达到最高。这可能是因为,回流温度越高,溶剂分子运动越快,促进了多酚的溶解,多酚得率相应升高;回流温度过高,对多酚造成了破坏,导致多酚得率降低。因此,选择回流温度90 ℃为星点设计-响应面法实验的中心条件。
2.1.4回流时间对多酚得率的影响(图4)
由图4可以看出,多酚得率随着回流时间的延长先升高后降低,在回流时间为90 min时多酚得率达到最高。这可能是由于,长时间的提取破坏了多酚类化合物的酚羟基结构[23],导致其得率下降;且长时间浸泡可能造成乙醇和多酚发生反应,降低了提取液中多酚含量,导致多酚得率下降。因此,选择回流时间90 min为星点设计-响应面法实验的中心条件。

图4 回流时间对多酚得率的影响
2.2山樱桃多酚提取的星点设计-响应面法实验
2.2.1实验设计与结果
考虑到回流温度的趋势线较为平缓,对多酚得率的影响不大,所以固定回流温度与回流次数,选择液料比、乙醇浓度、回流时间为考察因素,以多酚得率为响应值进行星点设计-响应面法实验,实验因素与水平见表1,实验设计与结果见表2。
表1
星点设计-响应面法实验因素与水平
Tab.1

Factors and levels of central composite
2.2.2模型方程
以多酚得率为因变量,采用Design-Expert 8.0软件对各因素进行二次多项式拟合,得到以山樱桃多酚得率(Y)为目标函数的二次回归方程:Y=-1.48738+0.087354A+0.020166B+0.059747C-0.00236881A2+0.000164022AB-0.000176101B2-0.0000902098AC+0.000021738BC-0.000032859C2,R2=0.9421。方差分析结果见表3。
由表3可知,模型的P值小于0.0001,说明二次方程具有高度显著性,模型与实验实际拟合良好,实验误差小,较好地反映了山樱桃多酚得率与液料比、乙醇浓度、回流时间的关系。一次项中液料比、乙醇浓度、回流时间对多酚得率的影响极显著(P<0.01),二次项中除液料比与回流时间的交互作用不显著外(P>0.05),其它作用均显著。删除不显著项可得简化方程:Y=-1.48738+0.087354A+0.020166B+0.059747C-0.00236881A2+0.000164022AB-0.000176101B2+0.000021738BC-0.000032859C2。
表2
星点设计-响应面法实验设计与结果
Tab.2

Design and results of central composite
表3
拟合二次方程的方差分析结果
Tab.3

Results of variance analysis of quadratic model
注:*表示P<0.05,有显著意义;**表示P<0.01,有极显著意义。
2.2.3响应面分析及工艺优化
采用Design-Expert 8.0软件进行多元回归拟合分析2个自变量的交互作用对山樱桃多酚得率的三维响应面图,如图5所示。

图5 乙醇浓度和液料比(a)、回流时间和液料比(b)、回流时间和乙醇浓度(c)的交互作用对山樱桃多酚得率的响应面分析
由图5可以看出,液料比在9.05∶1~20.95∶1范围内、乙醇浓度在58.11%~81.89%范围内、回流时间在72.16~107.84 min范围内有较高的多酚得率。经分析得到回归模型的最大值点分别为液料比16.02∶1、乙醇浓度68.64%、回流时间90.31 min,此条件下多酚得率可达1.172%。
结合生产实际,确定山樱桃多酚的最优提取工艺条件为:液料比16∶1、乙醇浓度68%、回流时间90 min、回流温度90 ℃。
2.2.4验证实验
在最优条件下,即液料比16∶1(mL∶g)、乙醇浓度68%、回流时间90 min、回流温度90 ℃,采用乙醇回流法提取山樱桃多酚,重复提取3次,计算多酚得率并与预测值比较,结果见表4。
表4
多酚得率实测值和预测值的比较/%
Tab.4Comparison of measured value with predicted value/%

实验号实测值预测值偏差率平均偏差率RSD11.1630.7721.1511.1721.791.170.5531.1830.94
由表4可知,平均偏差率为1.17%,RSD为0.55%。可见,由数学模型所得到的较优条件与设计目标相符,实验设计和数学模型具有可靠性和重现性。
2.3山樱桃多酚的抗氧化活性测定
2.3.1对羟基自由基的清除作用
不同浓度的山樱桃多酚提取液和维生素C对羟基自由基的清除作用如图6所示。

Ⅰ~Ⅴ:山樱桃多酚提取液浓度(g·mL-1),0.0625、0.125、
由图6可以看出,随着山樱桃多酚提取液浓度的增大,羟基自由基清除率逐渐升高;当山樱桃多酚提取液浓度在1.0 g·mL-1时,羟基自由基清除率达92.61%,与维生素C的羟基自由基清除率相当。
2.3.2对超氧阴离子自由基的清除作用
不同浓度的山樱桃多酚提取液和维生素C对超氧阴离子自由基的清除作用如图7所示。
由图7可以看出,山樱桃多酚提取液对超氧阴离子自由基有明显的清除作用,且随着山樱桃多酚提取液浓度的增大,超氧阴离子自由基清除率相应升高;当山樱桃多酚提取液浓度为1.0 g·mL-1时,超氧阴离子自由基清除率可达84.27%,与维生素C的抗氧化活性接近,说明山樱桃多酚提取液具有较强的抗氧化活性。
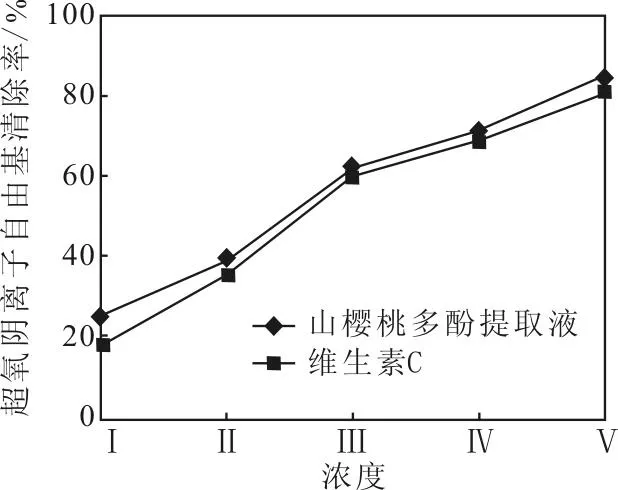
Ⅰ~Ⅴ:山樱桃多酚提取液浓度(g·mL-1),0.0625、0.125、
3结论
采用乙醇回流法提取山樱桃多酚,通过单因素实验和星点设计-响应面法实验对提取工艺条件进行优化,确定最佳提取工艺为:液料比16∶1(mL∶g)、乙醇浓度68%、回流时间90 min、回流温度90 ℃,在此条件下,山樱桃多酚得率的实测值与预测值接近,表明由星点设计-响应面法实验所得到的较优条件与设计目标相符,实验设计和数学模型具有可靠性和重现性,最优条件可用于山樱桃多酚的提取。山樱桃多酚提取液对羟基自由基及超氧阴离子自由基均有明显的清除作用,表明山樱桃多酚提取物可作为理想的自由基清除剂和天然抗氧化剂,应用潜力无限。
参考文献:
[1]仝晓刚,王燕,吕青,等.山樱桃树胶中的黄酮类成分研究[J].广西植物,2010,30(4):568-570.
[2]王蒙,冯晓元,戴莹,等.樱桃果实褪黑素及其营养功能研究进展[J].食品科学,2014,35(19):307-311.
[3]孙晶波,徐晶,陈璐,等.毛樱桃乙醇提取物的试验研究[J].中国实验方剂学杂志,2010,16(10):33-35.
[4]杨新周,陆礼和.毛樱桃的化学成分研究[J].江苏农业科学,2014,42(4):264-265.
[5]熊蔚蔚,徐铭键,张成义,等.毛樱桃果肉总黄酮最佳提取纯化工艺设计研究[J].北华大学学报(自然科学版),2013,14(2):183-185.
[6]韩爱芝,黄军海,孟庆艳,等.大花罗布麻不同部位酚类物质含量及其抗氧化活性比较研究[J].食品科学,2014,35(13):127-131.
[7]邵芳芳,尹卫平,梁菊.重要的植物多酚及其抗氧化性能的研究概况[J].西北药学杂志,2010,25(1):66-68.
[8]张红城,赵亮亮,胡浩,等.蜂胶中多酚类成分分析及其抗氧化活性[J].食品科学,2014,35(13):59-65.
[9]ATOUI A K,MANSOURI A,BOSKOU G,et al.Tea and herbal infusions:Their antioxidant activity and phenolic profile[J].Food Chemistry,2005,89(1):27-36.
[10]GORJANOVIC S Z,NOVAKOVIC M M,POTKONJAK N S,et al.Application of a novel antioxidative assay in beer analysis and brewing process monitoring[J].Journal of Agricultural and Food Chemistry,2010,58(2):744-751.
[11]GORINSTEIN S,CASPI A,LIBMAN I,et al.Bioactivity of beer and its influence on human metabolism[J].International Journal of Food Sciences and Nutrition,2007,58(2):94-107.
[12]于敏,杨春荣,陈帅.五倍子中多酚类物质对DPPH自由基清除作用的电子自旋共振研究[J].时珍国医国药,2007,18(12):3058-3059.
[13]NAGAO K,HIGA K,SHIPOUCHI B,et al.Effects ofVacciniumasheiReade leaves on lipid metabolism in Otsuka Long-Evans Tokushima fatty rats[J].Biosci Biotechnol Biochem,2008,72(6):1619-1622.
[14]孙宏,张泽.分光光度法测定天然多酚类化合物含量的研究进展[J].生物质化学工程,2008,42(3):55-58.
[15]FRATIANNI F,CARDINALE F,COZZOLINO A,et al.Polyphenol composition and antioxidant activity of two autochthonous brassicaceae of the Campania region,southern Italy[J].Food and Nutrition Sciences,2014,5(1):66-70.
[16]陆雪莹,热依木古丽·阿布都拉,李艳红,等.新疆石榴皮总多酚有效部位的抗氧化、抗菌及抗肿瘤活性[J].食品科学,2012,33(9):26-30.
[17]VATTEM D A,GHAEDIAN R,SHETTY K.Enhancing health benefits of berries through phenolic antioxidant enrichment:Focus on cranberry[J].Asia Pacific Journal of Clinical Nutrition,2005,14(2):120-130.
[18]乔小瑞.荔枝多酚的提取制备和抗氧化性活性研究[D].厦门:集美大学,2010.
[19]卢桃玲,欧阳玉祝,张晓旭,等.响应面法优化花椒总多酚的吸附分离工艺[J].吉首大学学报(自然科学版),2015,36(3):68-72.
[20]李巨秀,张朝红,房红娟,等.桑椹总多酚的提取工艺研究[J].食品研究与开发,2011,32(9):75-78.
[21]冯进,曾晓雄,李春阳.响应面法优化蓝莓叶多酚提取工艺[J].食品科学,2013,34(4):59-64.
[22]刘长建,姜波,刘亮,等.枸杞子多糖提取工艺优化及体外抗氧化活性研究[J].时珍国医国药,2009,20(3):661-663.
[23]伍春,徐立,刘峻池,等.响应曲面法优化新疆药桑桑皮总多酚提取工艺[J].食品科学,2011,32(2):104-107.
Optimization of Extraction Process for Polyphenols fromCerasusTomentosaWall.by Response Surface Methodology and Study on Its Antioxidant Activity
GONG Yan-ling,LIU Yang,WANG Sha-sha
(CollegeofChemicalEngineering,QingdaoUniversityofScienceandTechnology,Qingdao266042,China)
Abstract:The extraction process of polyphenols from Cerasus tomentosa Wall. was optimized and its antioxidant activity was studied.Using the yield of polyphenols as an evaluation index,through determining the absorbance by spectrophotometry,the main influencing factors of ethanol refluxing extraction process for polyphenols from Cerasus tomentosa Wall.,including liquid-solid ratio,ethanol concentration,refluxing time were selected.Through a central composite design-response surface methodology,the optimum extraction conditions were obtained as follows:liquid-solid ratio of 16∶1(mL∶g),ethanol concentration of 68%,refluxing time of 90 min,and refluxing temperature of 90 ℃.Under above conditions,the yield of polyphenols was predicted to be 1.172%,measured average value was 1.166%,RSD was 0.55%.Under the optimum conditions,the polyphenols from Cerasus tomentosa Wall. exhibited a high antioxidant activity with obvious scavenging effect on hydroxyl free radicals and superoxide anion free radicals.
Keywords:Cerasus tomentosa Wall.;polyphenol;extraction;response surface methodology;antioxidant activity
中图分类号:R 284.2
文献标识码:A
文章编号:1672-5425(2016)04-0012-06
doi:10.3969/j.issn.1672-5425.2016.04.004
作者简介:公衍玲(1975-),女,山东人,博士,副教授,研究方向:药物活性筛选和药效学,E-mail:hanyu_ma@126.com。
收稿日期:2015-12-16
基金项目:国家自然科学基金青年基金资助项目(81300281),山东省高校科技计划项目(J15LK12)
