海南黎药毛黄肉楠质量标准的初步研究△
2016-05-20谭小玉
谭小玉
(海南省药物研究所,海南 海口 570311)
海南黎药毛黄肉楠质量标准的初步研究△
谭小玉*
(海南省药物研究所,海南 海口 570311)
目的:初步研究了海南黎药毛黄肉楠的质量标准。方法:对毛黄肉楠进行化学成分预试验,采用紫外-可见分光光度法测定毛黄肉楠枝干中总黄酮含量,并对其水分、灰分和浸出物进行测定。结果:初步明确了毛黄肉楠化学成分类型,建立总黄酮含量测定紫外分光光度法,以芦丁为对照品,测定波长为506nm,回归方程为Y=12.08580X-0.01610(r2=0.9999),在0.003~0.077mg/mL线性关系良好,平均回收率为100.16%(RSD1.29%,n = 6);并确定了毛黄肉楠枝干水分、总灰分和浸出物的限量。结论:所建立方法简便、快捷、准确,可为毛黄肉楠药材质量标准的制定提供参考。
毛黄肉楠;总黄酮;含量测定;质量标准
毛黄肉楠(Actinodaphne pilosa (Lour.) Merr.) 系樟科(Lauraceae)黄肉楠属植物。毛黄肉楠具有净化大气污染的作用,多作为行道树、绿化树、生态公益林等在城市进行栽培[1]。在海南,黎族人民将毛黄肉楠枝干作为民间验方的组成之一,这已经有很长的使用历史。毛黄肉楠又称茶胶树、刨花、胶木等,文献记载毛黄肉楠具有祛风、消肿、散瘀、解毒、止咳之效,并能治疮疖,对跌打亦有效[2]。有文献采用色谱-质谱联用技术对毛黄肉楠叶片挥发油成分进行分析,鉴定出75种挥发性化合物[3],而枝干的成分分析未见报道。目前对毛黄肉楠的研究甚少,尚无其质量标准研究的文献报道,这极大地限制了毛黄肉楠药材的开发利用。本文通过查阅相关文献资料,拟从化学成分预试验、总黄酮含量测定、水分、灰分、浸出物等方面进行分析研究,按2015版《中华人民共和国药典》的方法和要求规范制定毛黄肉楠的质量标准,以促进海南黎药毛黄肉楠的开发使用。
1 仪器与材料
1.1 仪器:岛津UV-2401PC紫外分光光度计,岛津AUW220D电子天平,DHG-9203A型电热鼓风干燥箱(上海一恒科学仪器有限公司),SXZ-4-10N型箱式电阻炉(上海一恒科技有限公司),万能电子炉, SK250HP型超声波清洗器(上海科导超声仪器有限公司),XMTE-8112型电热恒温水浴锅(上海精宏实验设备有限公司)。
1.2 药材:毛黄肉楠采自海南五指山地区,经海南大学黄世满教授鉴别为樟科植物毛黄肉楠Actinodaphne pilosa (Lour.) Merr.的枝干。
1.3 试剂:芦丁对照品(批号 100080-201408,中国药品生物制品检定所);其余试剂均为分析纯,水为超纯水。
2 方法与结果
2.1 化学成分预试验[4]
2.1.1 水提取液的制备及结果:取毛黄肉楠粉末2g,置锥形瓶中,加入50mL超纯水,于50~60℃水浴中温浸1h,滤过,滤液供检识备用。经Molish反应阳性,表明可能含有糖、多糖或苷类物质;三氯化铁-铁氰化钾、明胶-氯化钠反应均阳性,表明可能含有鞣质;香草醛-盐酸反应阳性,表明可能含有间苯二酚和间苯三酚结构的化合物。
2.1.2 石油醚提取液的制备及结果:取1g毛黄肉楠粉末,加10mL石油醚,室温下浸渍提取2~3h,滤过,滤液供检识备用。油斑试验中,滤纸上未留下油斑表明本品可能不含有油脂或挥发油。
2.1.3 乙醇提取液的制备及结果:取毛黄肉楠粉末0.5g,精密称定,置具塞锥形瓶中,精密加入75%乙醇20mL,超声提取2次,每次60min,滤过,合并滤液,水浴蒸干,残渣加适量75%乙醇溶解转移至10mL量瓶中,加75%乙醇定容至刻度,即得乙醇提取液,用于黄酮类成分预试验。系列颜色反应结果(见表1)均可表明,毛黄肉楠中存在黄酮类化合物。
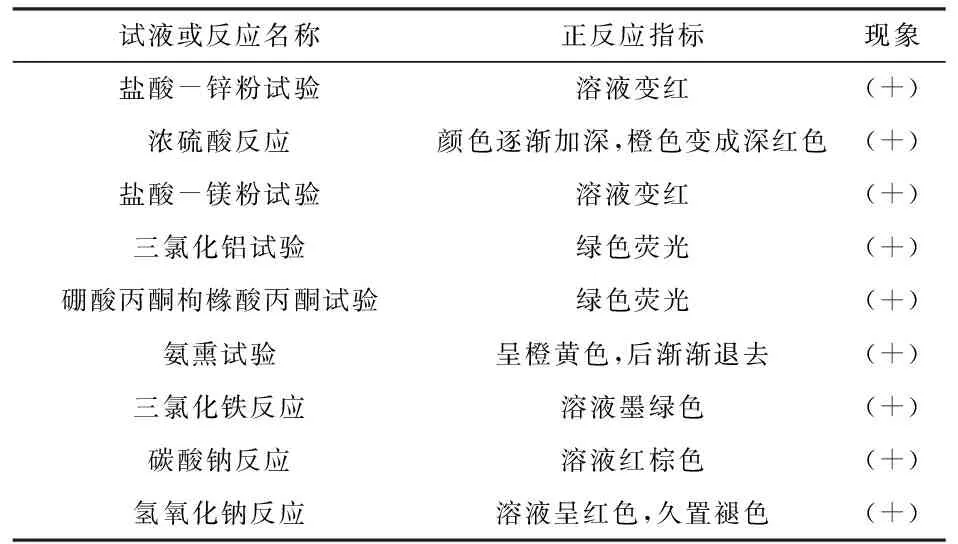
表1 黄酮类成分预实验反应结果
2.2 含量测定方法学研究
2.2.1 对照品溶液的制备: 取干燥的芦丁对照品12mg,精密称定,置50mL量瓶中,加75%乙醇溶解,并定容至刻度,摇匀,得质量浓度为0.2414mg/mL的芦丁对照品溶液。
2.2.2 供试品溶液的制备:取毛黄肉楠粉末0.5g,精密称定,置具塞锥形瓶中,精密加入75%乙醇20mL,于水浴中保持微沸回流提取2次,每次60min,滤过,合并滤液,水浴蒸干,残渣加适量75%乙醇溶解转移至10mL量瓶中,加75%乙醇定容至刻度,得待测供试品溶液。
2.2.3 显色方法[5]:精密移取待测液1mL,置25mL量瓶中,加5%NaNO2溶液1mL,摇匀,放置6min,加10%Al(NO3)31mL,摇匀,放置6min,加4%NaOH溶液4mL,加水定容至刻度,摇匀,放置15min,以75%乙醇溶液1mL加显色剂用水定容为空白,测定。
2.2.4 测定波长的选择: 取对照品溶液及供试品溶液按2.2.3项下显色方法加入显色剂,以相应溶剂为空白,于400~700nm范围内进行扫描。发现两者最大吸收波长均在506nm左右,故选定检测波长为506nm。
2.2.5 线性关系考察: 精密量取芦丁对照品溶液0.3,0.5,1.0,2.0,4.0,6.0,8.0mL,分别置25mL量瓶中,按2.2.3项下显色方法加入显色剂,以相应溶剂为空白,于506nm波长处测定。以吸光度为纵坐标,浓度为横坐标,绘制标准曲线,得回归方程为Y=12.08580X-0.01610(r2=0.9999),表明芦丁在0.003~0.077mg/mL呈良好线性关系。
2.2.6 精密度试验: 精密量取对照品溶液4mL,置于25mL量瓶中,按显色方法加入显色剂,以相应溶剂为空白,于506nm处测定吸光度,重复测定6次,记录吸光度值,RSD 0.14%,结果表明该方法精密度良好。
2.2.7 显色稳定性试验: 精密量取供试品溶液1mL,置25mL量瓶中,按显色方法加入显色剂,以相应溶剂为空白,于506nm处测定吸光度,每隔5min扫描1次,记录30min内供试品溶液的吸光度值,结果表明该供试品溶液显色后放置15min达到稳定,30min内RSD 1.50%。结果见表2。

表2 稳定性试验结果
2.2.8 重复性试验: 精密称取同一份样品粉末共6份,每份0.5g,精密称定,平行按2.2.2项下方法制备供试品溶液,按2.2.3项下显色方法加入显色剂,在506nm标准曲线下测定吸光度,并计算含量和RSD值。实验结果表明该方法重复性良好,RSD 2.13%。
2.2.9 加样回收率试验: 取同一份已知含量的样品粉末共6份,各0.25g,精密称定,分别精密加入芦丁对照品6.095mg,按2.2.2项下方法制备供试品溶液,精密移取供试品溶液1mL,按2.2.3项下显色方法加入显色剂,显色后于506nm标准曲线下测定,记录吸光度值,计算回收率。试验结果平均回收率为 98.10%,RSD 1.57%。结果见表3。
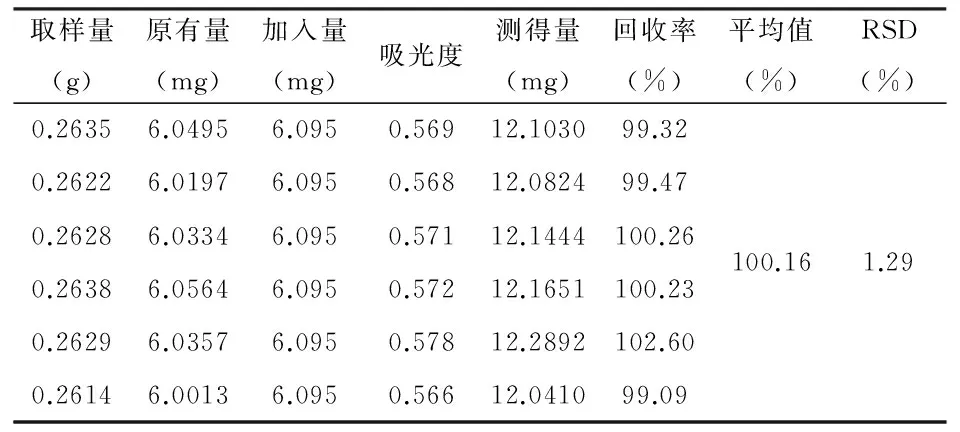
表3 毛黄肉楠芦丁加样回收率
3 样品测定
准确称取毛黄肉楠枝干粉末,每个样3个重复,按2.2.2项下方法制备供试品溶液,精密移取供试品溶液1mL,按2.2.3项下显色方法,参照芦丁线性回归方程,测得毛黄肉楠枝干总黄酮含量。结果见表4。

表4 毛黄肉楠总黄酮含量结果
4 检查
按《中华人民共和国药典》2015版四部通则0832第二法(烘干法)、通则2302、通则2201对采集的毛黄肉楠枝干水分、总灰分和浸出物进行测定。结果如下(表5):水分测定结果为10.31%~11.06%;总灰分测定结果为3.92%~5.03%;水溶性浸出物的测定结果为4.99%~5.97%;醇溶性(溶剂为95%乙醇)浸出物的测定结果为3.49%~4.60%。
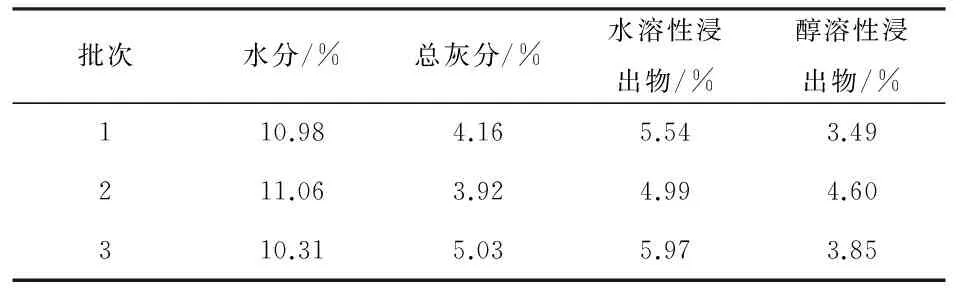
表5 毛黄肉楠水分、总灰分、浸出物测定结果(n=3)
5 讨论
5.1 通过化学成分预试验结果表明,毛黄肉楠中可能含有糖、多糖或苷类物质、鞣质、间苯二酚和间苯三酚结构的化合物。根据系列颜色反应表明,毛黄肉楠中存在黄酮类化合物。
5.2 通过对比冷浸提取法、超声提取法和回流提取法,根据提取效果,回流法更适宜作为该药材总黄酮含量测定的提取方法。以芦丁为对照,NaNO2-Al(NO3)3-NaOH显色反应体系,采用紫外-可见分光光度法测定毛黄肉楠中总黄酮的含量,结果表明该方法具有操作简单,测定快速,对仪器要求不高等优点。
5.3 Al(NO3)3比色法常用于总黄酮的含量测定,原理是在碱性条件下,可与黄酮形成红色螯合物为特征。进行比色法测量时,要注意考察吸光度值的稳定性,在NaNO2-Al(NO3)3-NaOH体系中,碱性条件经常会影响试验结果的准确度和稳定性[6]。根据试验结果,在稳定性试验中,供试品溶液显色后放置15min测定吸光度较稳定,实验中吸光度值呈减小趋势,可能因黄酮在碱性条件下与铝离子形成的络合物时间长不稳定,易分解有关,测定过程中应注意显色后及时测定,避免造成实验误差。
5.4 根据实验结果,初步拟定拟定毛黄肉楠(枝干)水分不得超过13.0%;总灰分不得超过6.0%;水溶性浸出物含量不得低于4.0%,醇溶性(溶剂乙醇)浸出物含量不得低于3.0%。
目前,对毛黄肉楠的药用价值探索仍处于初级阶段,更完善的质量控制方法需要后续进一步的研究。
[1]孔国辉,陈宏通,刘世忠,等.广东园林绿化植物对大气污染的反应及污染物在叶片的积累[ J] .热带亚热带植物学报,2003, 11(4):297-315.
[2] 中国科学院中国植物志编写委员会.中国植物志第31卷[M].北京:科学出版社,1982:256.
[3] 冯志坚,李文锋,陈秀娜,等.毛黄肉楠挥发油成分分析[J].广东林业科技,2009,25(3):25-28.
[4] 王薇.中药化学实验指导[M].陕西:陕西科学技术出版社,2014.
[5] 马雯芳,邓慧连,蔡毅,等.冰糖草总黄酮含量测定及显色方法优化[J].中国实验方剂学杂志,2013,19(3):112-115.
[6] 马陶陶,张群林,李俊.中药总黄酮的含量测定方法[J].安徽医药,2007,11(1):1030-1032.
2016年7月6日收稿
Preliminary Study on Quality Standards of Hainan Li Folk MedicineActinodaphnepilosa(Lour.) Merr.
TAN Xiao-yu
Pharmaceutical institute of Hainan Province, Haikou Hainan 570311 China
Objective: To study quality standards forActinodaphnepilosa(Lour.) Merr.Method: Preliminary tests for chemical constituents ofActinodaphnepilosa(Lour.) Merr. was performed. Total flavonoids were determined by ultraviolet spectrophotometry(UV). Determination of moisture, total ash and extractives were studies based on Chinese Pharmacopoeia published in 2015. Result: Its chemical constituents were determined. Limit of moisture, total ash and extractives inActinodaphnepilosa(Lour.) Merr. were determined. A quantitative method for the determination of total flavonoids by UV was established, using rutin as comparison sample, the detection wave length was set at 506nm. The standard curve of total flavonoids was linear in the range of 0.003~0.077mg/mL (r2=0.9999) and its average recovery ratio was 100.16 %( RSD 1.29%). Conclusion: The method simple, rapid and accurate can be used for the quality standards ofActinodaphnepilosa(Lour.) Merr.
Actinodaphnepilosa(Lour.) Merr.; total flavonoids ; quantitative method ; quality standards
海南省中药现代化专项——海南黎族特色抗炎止血药物院内制剂的研究开发(项目编号ZY201420)
谭小玉(1989-),女,本科学士,研究实习员,主要从事海南黎药质量标准研究方向。E-mail:tan_xiaoyu@126.com。
*通讯作者:谭小玉(1989-),女,本科学士,研究实习员,主要从事海南黎药质量标准研究方向。E-mail:tan_xiaoyu@126.com。
R298.1
B
1006-6810(2016)11-0050-03
