海洋低温α-淀粉酶酶解豌豆淀粉及其生物活性
2016-05-18吕明生王淑军焦豫良房耀维刘姝薛晔敏淮海工学院海洋学院江苏连云港222005淮海工学院江苏省海洋生物产业技术协同创新中心江苏连云港222005
吕明生,王淑军,焦豫良,房耀维,刘姝,薛晔敏(.淮海工学院海洋学院,江苏连云港222005;2.淮海工学院江苏省海洋生物产业技术协同创新中心,江苏连云港222005)
海洋低温α-淀粉酶酶解豌豆淀粉及其生物活性
吕明生1,2,王淑军1,2,焦豫良1,2,房耀维1,2,刘姝1,2,薛晔敏1
(1.淮海工学院海洋学院,江苏连云港222005;2.淮海工学院江苏省海洋生物产业技术协同创新中心,江苏连云港222005)
摘要:豌豆淀粉是一种广泛用于食品加工的重要的食品原料,采用研制的新型海洋低温α-淀粉酶,结合单因素试验和正交试验优化了α-淀粉酶酶解豌豆淀粉的工艺参数,并对酶解产物的生物活性进行了研究。结果表明,低温α-淀粉酶酶解豌豆淀粉工艺条件为加酶量35 U/g,时间165min,温度35℃,豌豆淀粉浓度4%,pH6.5。经高效液相色谱(HPLC)分析,酶解产物中麦芽三糖、麦芽四糖和麦芽五糖的总和达到65.88 %。酶解产物对羟自由基和DPPH自由基均有清除作用,对DPPH自由基的清除效果好于对羟自由基的清除效果。为豌豆淀粉的深入加工提供了参考。
关键词:低温α-淀粉酶;豌豆淀粉;酶解;羟自由基;DPPH自由基
低温酶是指在低温条件下能有效催化生化反应的一类酶,最适反应温度低,在0℃有一定的活性[1]。低温α-淀粉酶在面团发酵,污水处理,酿造,洗涤剂,食品,纺织和生物燃料生产方面具有广泛的工业应用[2]。
目前应用的α-淀粉酶主要是中高温淀粉酶(最适作用温度约为50℃以上),这些酶只有在较高温度下才具有较好的催化活性。低温淀粉酶能节约能量,降低生产成本,在全世界的需求量逐年剧增,国外研究生产的低温α-淀粉酶已创造了10亿美元的价值[3],而国内低温淀粉酶的生产还缺乏,有关低温淀粉酶的报道尚处于实验室研究阶段。
豌豆是一种以淀粉和蛋白质为主的豆料植物,是世界各地广泛种植的主要食用豆类之一,其产量在豆科类农作物中排名第四[4]。豌豆的成熟籽粒中分别含有蛋白质21 %~28 %和淀粉48 %~52 %[5]。自然界中的淀粉大多含有80 %的支链淀粉和20 %的直链淀粉[6]。豌豆淀粉中含直链淀粉所占比例较大,光粒豌豆淀粉中含直链淀粉33%~50%,皱粒豌豆淀粉中含直链淀粉60%~88%[7]。豌豆淀粉用途极广,既是食品工业原料,又可直接食用,还可广泛地用于纺织、轻化、医药等方面[8]。
目前应用的α-淀粉酶主要是中高温淀粉酶(最适作用温度约为50℃以上),这些酶只有在较高温度下才具有较好的催化活性。
α-淀粉酶水解麦麸淀粉[9]、番薯淀粉[10]、芭蕉芋淀粉[11]等淀粉,都采用中温或高温α-淀粉酶,水解板栗淀粉采用的低温α-淀粉酶则来自Sigma公司的酶作用温度为40℃的低温α-淀粉酶[12]。
本试验采用自主研制的低温α-淀粉酶[13]酶解豌豆淀粉,研究酶解条件以及酶解产物的生物特性,以期为豌豆淀粉的深加工提供参考。
1 材料与方法
1.1材料与试剂
海洋低温ɑ-淀粉酶:实验室制备;豌豆淀粉:四川友嘉食品有限公司生产;硅胶板:上海信谊仪器厂生产的GF254硅胶板,厚度为0.20 mm~0.25mm。Tris、浓盐酸、3,5-二硝基水杨酸、无水亚硫酸钠、苯酚、氯仿、冰醋酸、浓硫酸、正丁醇等试剂:国药集团化学试剂有限公司。DPPH:Sigma公司。
1.2仪器与设备
酶标仪:美国BioTek公司;电热恒温水浴锅:上海精宏实验设备有限公司;pH仪:上海梅特勒-托利多仪器有限公司;BS323S型电子天平:北京赛多利斯科学仪器系统有限公司;冷冻离心机:法国Thermo公司;格兰仕微波炉:广东佛山市格兰仕集团有限公司。
1.3试验方法
1.3.1酶解工艺流程
精确称取一定质量的豌豆淀粉,加水调成所需浓度的粉浆→加酸或碱调节至所需pH→移入恒温水浴锅中按要求加入一定量的低温α-淀粉酶→反应一段时间后取出灭酶并冷却液化液→测定还原糖。
1.3.2还原糖测定方法
用3,5-二硝基水杨酸(DNS)法测定还原糖[14]。
1.3.3酶解豌豆淀粉工艺的优化
单因素试验:在其他条件相同的情况下,分别研究时间(15、45、75、105、135、165 min)、加酶量(10、15、20、25、30、35 U/g)、温度(20、25、30、35、40、45℃)、豌豆淀粉(1 %、2 %、3 %、4 %、5 %、6 %)、pH(5.0、5.5、6.0、6.5、7.0、7.5)5个因素酶解豌豆淀粉的影响。
正交试验:在单因素试验的基础上,选择加酶量、时间、料液比、温度进行四因素三水平L9(34),试验因素水平见表1。

表1 正交试验因素水平表Table 1 Factor and level of orthogonal test of the cold-adapted αamylase
1.3.4酶解产物生物活性的分析
1.3.4.1高效液相色谱法(HPLC)
标品处理:配等质量分数的葡萄糖、麦芽糖、麦芽三糖、异麦芽三糖、麦芽四糖、麦芽五糖和麦芽六糖,用超纯水溶。测高效液相图谱。样品处理:加酶量为35 U/g,时间为165 min,豌豆淀粉浓度为4 %,温度为35℃,取5 mL,测高效液相图谱。色谱条件:色谱柱为Waters Sugar-Pak1(300 mm×7.8 mm),流动相为水,流速为0.4 mL/min,柱温为85℃。
1.3.4.2酶解产物对羟自由基(·OH)清除率的测定[15]
取10 mL具塞试管,按顺序加入5 mmol/L邻二氮菲1.5 mL,0.5 mol/L、pH 7.4的磷酸缓冲液3 mL,1 mL、7.5 mmol/L的FeSO4,不同浓度酶解液3 mL,1 mL体积分数0.1 %的H2O2,用重蒸水稀释到10 mL,37℃保温60 min,于510 nm处测吸光值(As),空白管(Ab)不加H2O2及酶解液,对照管(Ap)只加H2O2不加酶解液。
1.3.4.3酶解产物对DPPH自由基清除率的测定[16]
在比色管中依次加入3.5 mL 6.5 μmol/L DPPH溶液和0.5 mL不同浓度酶解液,混匀20 min后,于517 nm处测定吸光值。用3.5 mL无水乙醇和0.5 mL蒸馏水作为参照,以上各均做3组平行。As为加入样品的吸光度,Ar为本底吸收的吸光度,A0为空白溶液的吸光度。
2 结果与分析
2.1酶解豌豆淀粉的单因素试验
2.1.1时间对酶解豌豆淀粉的影响
时间对酶解豌豆淀粉的影响见图1。
由图1可知,当反应时间从15 min变化为45 min时,还原糖得率有个明显的上升趋势,当过了45 min后还原糖得率的变化趋于平缓,直至135 min后有了下降的趋势,后续试验的时间选择135 min。
2.1.2加酶量对酶解豌豆淀粉的影响
加酶量对酶解豌豆淀粉的影响见图2。
由图2的总体趋势可知,加酶量越大,还原糖得率越大。但当加酶量超过30 U/g时,还原糖得率有明显下降的趋势。即当加酶量为30 U/g时,还原糖得率最大并大于50 %。综合试验效果和节约成本考虑,将后续试验的加酶量定为30 U/g。

图1 时间对酶解豌豆淀粉的影响Fig.1 Effect of time on the degree of hydrolysis pea starch

图2 加酶量对酶解豌豆淀粉的影响Fig.2 Effect of enzyme dosage on the degree of hydrolysis pea starch
2.1.3温度对酶解豌豆淀粉的影响
温度对酶解豌豆淀粉的影响见图3。

图3 温度对酶解豌豆淀粉的影响Fig.3 Effects of temperature on the degree of hydrolysis pea starch
由图3可知,当温度从20℃变化到35℃时,还原糖得率变化呈平缓上升趋势,直至35℃时达到最大值,从试验效果出发,后续试验的温度选择35℃。
2.1.4淀粉浓度对酶解豌豆淀粉的影响
淀粉浓度对酶解豌豆淀粉的影响见图4。

图4 淀粉浓度对酶解豌豆淀粉的影响Fig.4 Effect of substrate concentration on the degree of hydrolysis pea starch
由图4知,当淀粉浓度从1 %增加到4 %时,还原糖得率呈平稳上升趋势,4 %达到最高点,后续试验的豌豆淀粉浓度选择4 %。
2.1.5 pH对酶解豌豆淀粉的影响
pH对酶解豌豆淀粉的影响见图5。
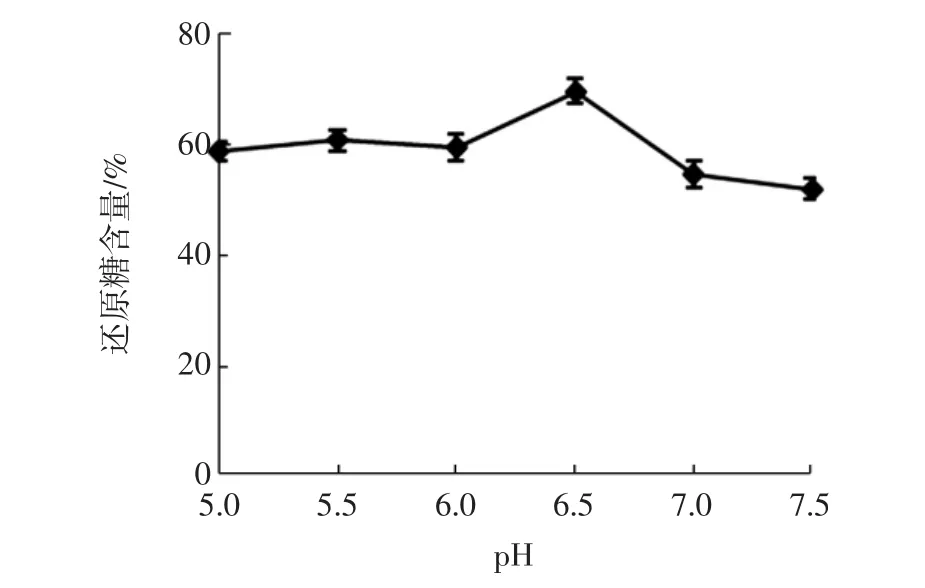
图5 pH对酶解豌豆淀粉的影响Fig.5 Effect of pH on the degree of hydrolysis pea starch
由图5可知,pH从5.0变化至6.0,还原糖得率几乎呈水平变化,直至pH变为6.5,还原糖得率才有一个较大的变化幅度,而当pH继续变大,还原糖得率没有完全上升的趋势,后续反应的pH选择6.5。
2.2低温α-淀粉酶酶解豌豆淀粉的正交试验
根据以上研究结果,分别选择加酶量、底物浓度、温度、pH 4个影响较大的因素,并以各因素的最佳试验条件为依据确定其最佳使用范围,进行正交试验。试验结果见表2。
将获得数据用SPSS 17 Statistics软件进行方差分析见表3。

表2 豌豆淀粉正交试验L9(34)Table 2 Orthogonal experiment of pea starch L9(34)
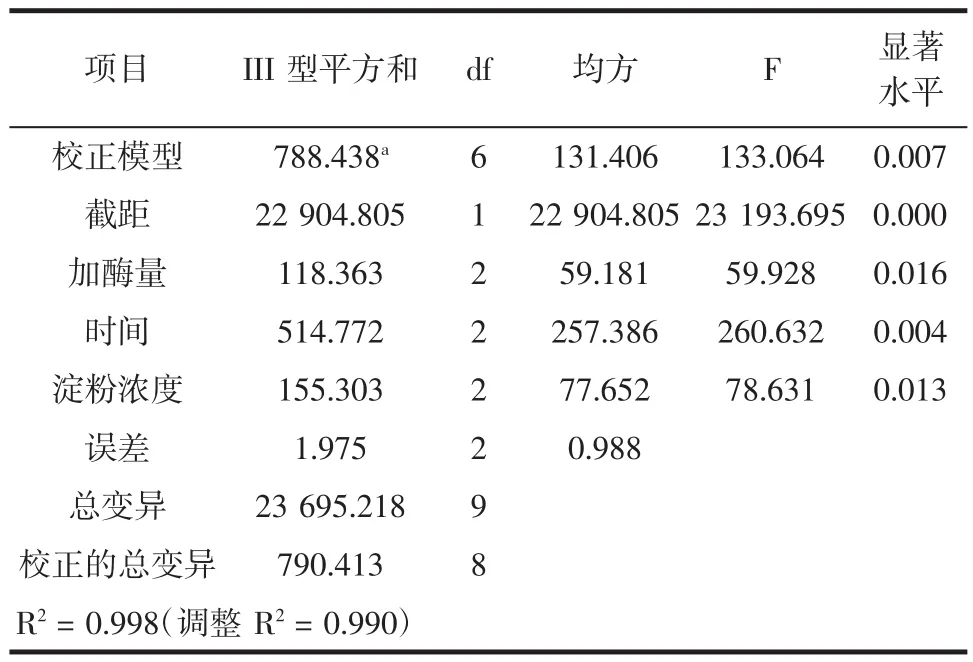
表3 正交试验方差分析Table 3 Orthogonal experiment analysis of variance
从表3中可看出,时间(B)对豌豆淀粉的酶解有极其显著的影响(P<0.01),而加酶量(A)和豌豆淀粉浓度(C)对酶解效果也有显著影响(P<0.05)。综合各种因素,确定豌豆淀粉酶解的最优组合为A3B3C2D2,即加酶量为35 U/g,时间为165 min,豌豆淀粉浓度为4 %,温度为35℃。按最优条件进行验证,得到还原糖为81.96 %,通过正交试验提高了低温α-淀粉酶对豌豆淀粉的酶解作用。
2.3豌豆淀粉酶解产物分析
2.3.1高效液相色谱法(HPLC)
低聚糖具有促进益生菌增殖润肠通便和降血糖等功能特性,广泛应用于食品、保健品、饮料、医药、饲料添加剂等领域[17-18]。低温α-淀粉酶在最优条件下酶解豌豆淀粉,其酶解产物的HPLC结果显示(见图6)。

图6 酶解产物的HPLC图谱Fig.6 HPLC of hydrolyzate
由图6可知,酶解产物有葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖,其中麦芽五糖含量最高,根据峰面积计算,麦芽五糖含量达到50.56 %,麦芽三糖、麦芽四糖和麦芽五糖的总和达到65.88 %,这为利用低温α-淀粉酶对豌豆淀粉进行深入加工提供了一定的依据。
2.3.2酶解产物对羟自由基的清除率
酶解产物对羟自由基的清除率见图7。

图7 豌豆淀粉酶解产物的羟自由基清除率Fig.7 Scavenging rate of hydroxyl radical from pea starch
由图7可知,从曲线走势来看,随着豌豆淀粉酶解产物中多糖浓度的增加,羟自由基的清除率呈上升趋势。酶解产物中多糖浓度越高,对羟自由基的清除效果越好。
2.3.3酶解产物对DPPH自由基的清除率
酶解产物对DPPH自由基的清除率见图8。

图8 酶解产物的DPPH自由基清除率Fig.8 Scavenging rate of DPPH radical from pea starch
由图8可知,豌豆淀粉水解产物对DPPH自由基的清除率随着多糖浓度的增加呈上升趋势。豌豆淀粉酶解液对DPPH自由基的清除率要好于羟自由基率,当多糖的浓度为21.58 mg/mL时,此酶解液对DPPH自由基的清除率达到最大为20.15 %。
3 结论
本试验采用研制的新型海洋低温α-淀粉酶,结合单因素试验和正交试验优化了α-淀粉酶酶解豌豆淀粉的工艺参数,并对酶解产物的生物活性进行了研究。结果表明:低温α-淀粉酶酶解豌豆淀粉的最佳工艺条件为加酶量35 U/g,时间165 min,温度35℃,豌豆淀粉浓度4 %,pH6.5。低温α-淀粉酶在最优条件下酶解豌豆淀粉,其酶解产物的HPLC分析结果表明酶解产物有葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖,其中麦芽五糖含量最高,根据峰面积计算,麦芽五糖含量达到50.56 %,麦芽三糖、麦芽四糖和麦芽五糖的总和达到65.88 %,这为利用低温α-淀粉酶对豌豆淀粉进行深入加工提供了一定的参考。酶解产物对羟自由基和DPPH自由基均有清除作用,羟自由基和DPPH自由基的清除率的高低与水解产物中多糖的浓度的大小呈正比,但对DPPH自由基的清除效果好于对羟自由基的清除效果。
参考文献:
[1] Cavicchioli R, Siddiqui K S, Andrews D, et al. Low temperature extremophiles and their applications[J]. Curr Opin Biotechnol, 2002, 13(3):253-261
[2] Emampour M, Noghabi K A, Zahiri H S. Molecular cloning and biochemical characterization of a novel cold-adapted alpha-amylase with multiple extremozyme characteristics[J]. J Mol Catal B:Enzym, 2015,111:79-86
[3] Roohi, M K. Bio-statistical approach for optimization of cold-active α-amylase production by novel psychrotolerant M. foliorum GA2 in solid state fermentation[J]. Biocatal Agr Biot, 2014, 3(2): 175-181
[4]余平,石彦忠.淀粉与淀粉制品工艺学[M].北京:中国轻工业出版社,2011
[5]莫重文.豌豆蛋白及淀粉的制取研究[J].郑州粮食学院学报, 1999, 20(4):84-88
[6]惠斯特勒,王雒文,闵大栓,等.淀粉的化学与工艺学[M].北京:中国食品出版社,1998:8
[7] Colonna P, Mercier C. Macromolecular structure of wrinkled and smooth-pea starch components[J]. Carbohyd Res,1984,126(2):233-247
[8]裴亚琼,宋晓燕,杨念,等.豌豆淀粉的提取及其理化性质的研究[J].中国粮油学报,2014,29(9):24-28
[9]朱芸,信汝林,侯伟伟,等.淀粉酶水解麦麸中淀粉工艺的研究[J].中国食物与营养,2014,20(4):59-62
[10]陈玉,李生潘.α-淀粉酶水解番薯淀粉的研究[J].广州化工,2013, 41(15):79-81,144
[11]王成,荣玉芝,李虎,等.α-淀粉酶水解对芭蕉芋淀粉理化性质的影响[J].食品与药品,2014,16(4):229-232
[12]解华东,刘邻渭,陈德经,等.低温α-淀粉酶液化板栗淀粉的工艺研究[J].食品科技,2007,32(3):80-83
[13] Lu M S, Fang Y W, Li H Z,et al. Isolation of a novel cold-adapted amylase-producing bacterium and study of its enzyme production conditions[J]. Annu Microbiol, 2010, 60(3): 557-563
[14]魏爱丽,张学武.木薯淀粉酶解工艺的优化[J].现代食品科技, 2008,24(12):1250-1253
[15]全桂静,宋文婷.甘薯多糖提取条件及抗氧化性的研究[J].沈阳化工大学学报,2014,28(4):325-342
[16]刘璐,乔宇,汪兰,等.山药多糖的抗氧化作用研究[J].食品科技, 2014,39(12): 212-216
[17] Crittenden R G, Playne M J. Production, properties and applications of food-grade oligosaccharides[J]. Trends food Sci Tech, 1996, 7 (11): 353-361
[18]杨海军,李发财,袁伟涛.低聚麦芽糖在固体饮料中的应用[J].食品安全导刊,2011(12):50
Hydrolyzate of Pea Starch by Marine Cold-adapted α-Amylase and Its Biological Activity
L譈Ming-sheng1,2,WANG Shu-jun1,2,JIAO Yu-liang1,2,FANG Yao-wei1,2,LIU Shu1,2,XUE Ye-min1
(1. School of Marine Science and Technology,Huaihai Institute of Technology,Lianyungang 222005,Jiangsu,China;2. Co-Innovation Center of Jiangsu Marine Bio-industry Technology,Huaihai Institute of Technology,Lianyungang,222005,Jiangsu,China)
Abstract:Pea starch has become an important food ingredient and has been widely used in food processing. Some factors which could influence enzymatic hydrolysis were studied. The optimal conditions of pea starch hydrolysis with the α-amylase:enzyme amount 35 U/g,hydrolysis time 165 min,temperature 35℃,pea starch concentration 4 %,and pH 6.5. The amylase could hydrolyze pea starch into maltose,maltotriose,maltotetraose and maltopentaose by HPLC of analysis. The quantity of maltotriose,maltotetraose and maltopentaose was 65.88 %. The hydrolyzate had the scavenging effect on the hydroxyl radical and DPPH radical. The scavenging effect of DPPH radical was higher than one of hydroxyl radical.
Key words:cold-adapted α-amylase;pea starch;enzymatic hydrolysis;hydroxyl radical;DPPH radical
收稿日期:2015-02-06
作者简介:吕明生(1963—),男(汉),教授,本科,研究方向:食品生物技术。
基金项目:国家海洋公益性行业科研专项(201205020-8);国家自然科学基金(31271929)
DOI:10.3969/j.issn.1005-6521.2016.08.024
