纳米锶羟基磷灰石的制备及对甲氨蝶呤吸附性能的研究*
2016-05-17谢袁菲季金苟向存程
谢袁菲,季金苟,向存程,徐 溢
(重庆大学 化学化工学院,重庆 400030)
纳米锶羟基磷灰石的制备及对甲氨蝶呤吸附性能的研究*
谢袁菲,季金苟,向存程,徐溢
(重庆大学 化学化工学院,重庆 400030)
摘要:为了制备具有较高甲氨蝶呤(MTX)吸附性能的药物载体用于骨肿瘤治疗,用共沉淀法制备不同掺锶量的纳米锶羟基磷灰石(nano-SrHA),利用XRD、TEM等对其进行了表征,并考察了共沉淀时间、掺锶比、甲氨蝶呤(MTX)浓度、溶液pH值等对吸附MTX性能的影响。结果表明,掺锶比对nano-SrHA的大小及形状都有一定影响,随着掺锶比的增加,晶体尺寸变小;掺锶比影响nano-SrHA对MTX吸收,不同掺锶比中nano-Sr(0.3)HA对MTX的吸附效果最佳;共沉淀反应时间增加有利于晶型的锐化和吸附性能的提高;pH值为7.8的弱碱环境有助于nano-Sr(0.3)HA吸附MTX,最大吸附量高达43.09 mg/g。nano-Sr(0.3)HA是一种良好的MTX吸附载体。
关键词:纳米锶羟基磷灰石;吸附性能;甲氨蝶呤
0引言
炎症、肿瘤等常会引起骨组织的缺损,不仅造成畸变,还会引起一系列的功能障碍。纳米羟基磷灰石[nano-Ca10(PO4)6(OH)2, nano-HA]是众多磷酸钙化合物的一种,其化学组分和晶型结构类似人体自然骨,表现出较好的生物相容性、生物可降解性、生物稳定性、吸附载药性、引导骨生长、无毒性等生物活性[1-3]。nano-HA因其较大的比表面积和表面活性,能吸附和传递蛋白质、多肽类、免疫调节剂、疫苗等药物[4],可有效地提高药物的通透性而发挥药效,故被广泛地应用于骨损伤方面的治疗[5-7]。nano-HA中的OH-与2个Ca2+连接,当晶体表面的OH-位置在某一时刻空缺时,使得HA晶体表面带有由Ca2+引起的多余的正电荷而形成较强的吸附位点(C点),这个位点能够吸附大分子上的磷酸基团或是羧基基团[8]。锶是人体内必需微量元素之一,在骨内的含量约为0.01%,远低于钙含量。大量实验表明,纳米锶羟基磷灰石[nano-CaxSry(PO4)6(OH)2, nano-SrHA,x+y=10]比nano-HA具有更好的生物性能,锶的掺入改变了载体材料的结晶性和生物降解性,提高骨容量,减少骨流失,诱导成骨细胞活性,促进成骨细胞的增殖与分化,抑制破骨细胞活性,增强骨强度和更好地吸附蛋白质、脂质、氨基酸及骨肿瘤治疗药物[9]。
本文以共沉淀法制备了不同掺锶比的nano-SrHA,并对其进行表征,以含羧基的抗肿瘤药物甲氨蝶呤(Methotreaxate, MTX)为模型药物,考察了nano-SrHA对MTX的吸附性能,以期找到一个较好的抗骨肿瘤药物载体。
1实验
1.1 试剂与仪器
MTX(陕西顶点医药化工有限公司)、硝酸钙、氯化锶、磷酸氢二铵、氨水、氢氧化钠等其余试剂均为国产分析纯。
T6-新世纪紫外分光光度计(北京普析通用有限责任公司);Shimadzu XRD6000X射线衍射仪(XRD,日本Shimadzu制作所);HITACHI-600透射电镜(TEM,日本日立公司);85-2数显恒温磁力搅拌器(江苏省金坛市中正仪器制造有限公司);KQ-2200B超声清洗器(巩义市予华仪器有限责任公司);FD-1冷冻干燥机(北京德天佑科技发展有限公司)等。
1.2nano-SrHA的制备
采用共沉淀法制备nano-SrHA[10]。在伴有搅拌和回流的三颈瓶中,加入计量好的硝酸钙和氯化锶溶液,用1∶2的氨水调节溶液pH值=10,在油浴中加热至60 ℃。另量取相应的磷酸氢二铵溶液,事先用1∶1的氨水调节pH值=10,转入滴液漏斗,以每分钟2~5 mL的速度滴入三颈瓶中。滴加过程中用1∶2的氨水调节溶液pH值=10。于80 ℃下反应3 h,加热沸腾1 h,室温陈化(静置过夜),制得nano-SrHAP。过滤,沉淀物用去离子水多次洗涤至pH值=7,沉淀冷冻干燥,制备含不同掺锶比的nano-SrHA。
1.3nano-SrHA晶型及表面形貌表征
用XRD进行晶型分析,扫描2θ角为10~60°;另取少量样品于 50 mL蒸馏水中,超声分散后滴到铜网上,用磷钨酸染色,室温干燥,再用TEM观察表面形貌。
1.4检测波长的选择
配制一定浓度的MTX溶液,用紫外-可见光200~600 nm扫描,确定MTX最大吸收波长。
1.5MTX标准曲线的绘制
配制0.25 mg/mL的MTX储备液,分别吸取0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9和1.0 mL储备液置于10 mL容量瓶中,加0.01 mol/L的NaOH溶液定容,摇匀,即得MTX标准溶液。以0.01 mol/L的NaOH溶液为参比,在MTX最大吸收波长处测定其吸光度,重复3次,取平均值。
1.6载药nano-SrHA的制备及药物吸附量的测定
采用吸附-冷冻干燥法制备载药nano-SrHA[11]。分别称取一定量的不同掺锶比的nano-SrHA粉体于适量药物浓度的溶液中,超声30 min,再恒温振荡吸附一定时间,过滤,用去离子水洗涤沉淀,去掉表面粘附的药物,冷冻干燥沉淀,即得载药nano-SrHA。滤液稀释,于MTX最大吸收波长处测定其吸光度,换算成浓度,按下式计算药物的吸附量
式中,q表示每克nano-SrHA吸附药物的量,mg/g;C0为溶液中药物的初始浓度,μg/mL;CV为吸附后残留药物浓度,μg/mL;m为nano-SrHA的质量,g;V为吸附液体积,mL。
考察掺锶比、共沉淀时间、药物浓度、溶液pH值对nano-SrHA吸附MTX性能的影响。
2结果与讨论
2.1掺锶比对nano-SrHA晶型的影响
图1为不同掺锶比的nano-SrHA XRD图,从图中可以看出,2θ在25.8°(002)、31.7°(211)、32.2°(112)分别出现强的特征衍射峰。nano-HA的XRD谱与HA标准卡片(ICSD 09-0432)中的数据吻合,nano-HSr的XRD谱与HSr标准卡片(ICSD 33-1348)中的数据吻合,其余nano-SrHA(Sr/[Sr+Ca]=0.3~0.7)的XRD谱分别与34-0482、34-0479、34-0478中数据相对应。由此可以推断所制备的产物为nano-HA、nano-HSr及nano-SrHA(Sr/[Sr+Ca]=0.3~0.7)。
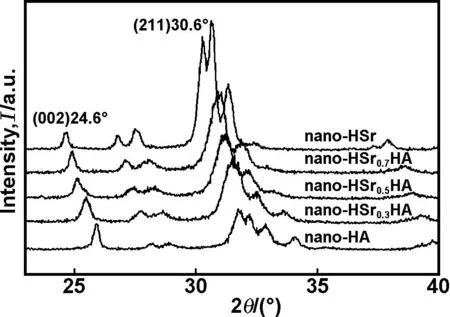
图1Nano-HA、不同掺锶比nano-SrHA、nano-HSr 的XRD图
Fig 1 XRD patterns of nano-HA, nano-SrHA with different Sr ratios and nano-HSr
从图1还可以看出,随着掺锶比的增加,(002)晶面与(211)晶面衍射峰逐渐向小角度偏移,这和Bragg 公式λ=2dsinθ是相一致的,由于Sr2+半径大于Ca2+(Sr2+、 Ca2+半径分别为0.113和0.099 nm),使得晶格常数变大、晶面间距d增大,当X射线波长λ一定时,衍射角2θ向小角偏移。
本文发现,随着掺锶比的增加,(211)晶面与(002)晶面峰面积之比随之增加,R2=0.98914(见表1)。这可以推测,随着掺锶比的增加,nano-SrHA沿c轴(002)晶面方向生长趋势逐渐弱化。
表1(211)晶面与(002)晶面峰面积
Table 1 Peak area of (211) and (002)

Sr/[Sr+Ca]原子比S(002)S(211)S(211)/S(002)0.0334295862.870.34248169433.990.53396190085.600.72425210798.691.020133411816.95
2.2共沉淀时间对nano-SrHA晶型的影响
表2为共沉淀时间对nano-Sr0.3HA (211)晶面间距和峰高的影响,由表2可以发现随着共沉淀时间的增加,nano-Sr0.3HA (211)晶面间距和峰高逐渐增大。根据布拉维法则可知,随着(211)晶面间距d的增大,晶面的结点密度增大,相邻晶面间引起减小,晶体成长逐渐变缓,并于3 h后趋于稳定。一般认为峰高是由同方向排列的晶面分布数量决定的,(211)晶面峰高随共沉淀时间增加而增大,说明其晶面增多,晶体结晶度提高,且3 h后晶体生长已基本稳定。
表2共沉淀时间对nano-Sr0.3HA 晶型的影响
Table 2 Effect of coprecipitation time on the crystal forms of nano-Sr0.3HA

Coprecipitationtime/h2θdHeight0.531.4782.83970.671.031.3812.84822.571.531.3412.85183.632.031.3202.85374.102.531.2992.85564.483.031.2822.85714.843.531.2772.85754.984.031.2792.85745.10
2.3掺锶对nano-SrHA粒径的影响
图2分别为nano-HA(a)、nano-Sr0.3HA(b)和nano-HSr(c)的TEM图。从图2可以看出,nano-HA为针条状,nano-Sr0.3HA为短针状, nano-HSr为短棒状,其对应尺寸分别约为Ø25 nm×130 nm、Ø20 nm×100 nm和Ø15 nm×70 nm。这可能和nano-HA沿c轴(002)方向有较强的生长趋势有关(见表1),随着掺锶比增加,沿c轴(002)方向生长趋势减弱,导致晶体尺寸变小。

图2Nano-HA、nano-Sr0.3HA、nano-HSr的TEM图
Fig 2 Transmission Electron Microscope of nano-HA, nano-Sr0.3HA, nano-HSr
2.4掺锶比对nano-SrHA吸附MTX性能的影响
图3为掺锶比对nano-SrHA吸附性能的影响。

图3 掺锶比对nano-SrHA吸附性能的影响
Fig 3 Ratios of Sr on absorption quantity of nano-SrHA
由图3可以看出,nano-SrHA对MTX吸附性能的大小顺序为nano-Sr0.3HA>nano-Sr0.5HA>nano-Sr0.7HA>nano-HA>nano-HSr。nano-SrHA对MTX的吸附能力可能是由两方面的原因所决定:(1)不同离子对MTX的结合力不同所致,Ca2+离子的半径小,其对MTX的结合力要大于Sr2+对MTX的结合力,故nano-HA > nano-HSr;(2)晶格应力不同导致其对MTX的吸收不同,掺Sr2+后的晶体,其晶格应力要大于纯的nano-HA和nano-HSr,对MTX的吸附能力增强,故nano-Sr0.3HA> nano-HA。综合考虑以上两个因素,最终导致它们对MTX吸附的能力为nano-Sr0.3HA> nano-Sr0.5HA>nano-Sr0.7HA>nano-HA >nano-HSr。
2.5共沉淀时间对nano-SrHA吸附MTX性能的影响
图4为制备nano-Sr0.3HA共沉淀时间对吸附MTX性能的影响。从图4可以发现,nano-Sr0.3HA吸附MTX的量随其制备时的共沉淀时间的增加而增加,3 h后均基本不变。这可能是因为在共沉淀法制备nano-Sr0.3HA时,率先形成的缺钙(或锶)HA,导致其对MTX的吸附位点较减少,随着共沉淀反应的时间增长,正离子的位点逐渐被填补,吸附MTX量也逐渐增加。共沉淀3 h后,nano-CaxSry(PO4)6(OH)2中[x+y]/6基本达到1.67,形成了较完整的nano-Sr0.3HA晶型,故吸附量不再增加,这和图3的现象是基本一致的。

图4 共沉淀时间对吸附MTX性能的影响
Fig 4 Effect of coprecipitation time of on the absorption quantity
2.6MTX浓度对nano-SrHA吸附性能的影响
图5为溶液pH值=8.8时, MTX浓度对nano-Sr0.3HA吸附性能的影响。

图5 MTX浓度对nano-Sr0.3HA吸附性能的影响
Fig 5 Effect of MTX concentrations on absorption quantity of nano-Sr0.3HA
由图5可知,随着MTX浓度的增加,nano-Sr0.3HA的吸附量随之增加。当MTX为62.40 μg/mL时吸附量趋于饱和,此时nano-Sr0.3HA最大吸附量为40.27 mg/g。
2.7pH值对nano-SrHA吸附MTX性能的影响
图6为pH值对nano-Sr0.3HA吸附性能的影响。从图6可以看出,在pH值=7.8附近的吸附量最大,为43.09 mg/g,过酸或过碱使得吸附量减少。这可能与MTX的pka值及溶液pH值对nano-Sr0.3HA吸附位点的影响有关。如图7所示,MTX上α位的羧基pka=4.7,β位的羧基pka=3.4[12]。在较低pH值环境中,MTX上的H+解离有限,因此较难被nano-Sr0.3HA吸附位点(Ca2+或Sr2+)吸附;随着溶液pH值的升高,H+解离增加,从而使MTX呈现负电荷形式增多,nano-Sr0.3HA对其吸附增加。然而当碱性过强时,Sr2+、Ca2+所带来的吸附位点可能会优先吸附富余的OH-,使得nano-Sr0.3HA吸附MTX的能力下降。

图6 pH值对nano-Sr0.3HA吸附性能的影响
Fig 6 Effect of pH on the absorption of nano-Sr0.3HA

图7 甲氨蝶呤结构式
3结论
(1)Nano-HA呈短针状,尺寸约Ø25 nm×130 nm,锶的掺入抑制了晶体沿c轴方向的生长趋势,致使其晶体尺寸变小。
(2)随着共沉淀时间的增加,nano-SrHA晶型逐渐锐化,对MTX的吸附量随之增加,3 h后基本不变。
(3)由于Sr的掺入,晶体应力发生改变,nano-SrHA对MTX的吸附不仅与钙离子相对量有关,也与应力有关,最终导致nano-Sr0.3HA对MTX的吸附效果最佳。
(4)弱碱环境有助于提高nano-SrHA吸附MTX性能,当pH值为7.8时,nano-Sr0.3HA对MTX吸附可达到43.09 mg/g。
综上所述,nano-Sr0.3HA对含羧基抗肿瘤药物具有良好的吸附性能,有望成为骨肿瘤治疗的良好的药物载体。
参考文献:
[1]Chai F, Hornez J C, Blanchemain N, et al. Antibacterial activation of hydroxyapatite (HA) with controlled porosity by different antibiotics [J]. Biomolecular Engineering, 2007, 24: 510-514.
[2]Juhong Y, Xiaobing C, Yurong C, et al. Preparation and characterization of antimicrobial nano-hydroxyapatite composites [J]. Materials Science and Engineering C, 2014, 37: 54-59.
[3]Fuyin Z, Shige W, Shihui W, et al. Characterization and antibacterial activity of amoxicillin-loaded electrospun nano-hydroxyapatite/poly (lactic-co-glycolic acid) composite nanofibers [J]. Biomaterials, 2013, 34: 1402-1412.
[4]Yang Hui,Huang Feifei. Preparation of porous spherical hydroxyapatite and study on its properties of drug delivery in vitro[J]. Journal of Functional Materials, 2012, 43(4): 533-536.
杨辉,黄菲菲. 多孔球形羟基磷灰石的制备及其药物控释性能的研究[J].功能材料,2012,43(4): 533-536.
[5]Sanjaya K S, Debasish S. Study of BSA protein adsorption/release on hydroxyapatite nanoparticles[J]. Applied Surface Science, 2013, 286: 99-103.
[6]Jia Zhibin, Zhi Wei, Li Jinyu, et al. Preparation and characterization of porous hudroxyapatite scaffolds lined with composite coatings[J]. Journal of Functional Materials, 2014, 45(18): 18129-18134.
贾治彬,智伟,李金雨,等.羟基磷灰石基多孔复合支架的制备及其表征[J].功能材料,2014,45(18): 18129-18134.
[7]Zhang Yi,Li Jidong,Zuo Yi,et al. Preparation and characterization of the magnetic hydroxyapatite composite[J]. Journal of Functional Materials, 2012, 43(10): 1273-1276.
张熠,李吉东,左奕,等.磁性羟基磷灰石复合物的制备与表征[J].功能材料,2012,43(10): 1273-1276.
[8]Chen Qingyu,Zhu Rongrong,Zhang Rui,et al. Preparation and characterization of nano-hydroxyapatite as carrier of two drugs[J]. Journal of Fudan University(Natural Science), 2009, 48(3): 386-390.
陈庆榆,朱融融,张蕤,等.纳米羟基磷灰石对两种药物的载药性能研究[J].复旦学报(自然科学版),2009,48(3): 386-390.
[9]Kaili L, Peiyi L, Wei L, et al. Strontium substituted hydroxyapatite porous microspheres: surfactant-free hydrothermal synthesis, enhanced biological response and sustained drug release [J]. Chemical Engineering Journal, 2013, 222: 49-59.
[10]Ji Jingou,Ran Junguo,Gou Li,et al. Synthesis of HA/β-TCP biphasic bioceramic powders by a modified co-precipitation method[J]. Journal of Functional Materials, 2003, 34(5): 597-599.
季金苟,冉国军,苟立,等.共沉淀法制备HA/β-TCP双相生物陶瓷粉末新工艺研究[J].功能材料,2003,34(5): 597-599.
[11]Shaoning W, Xiaoyun W, Hui X, et al. Towards sustained delivery of small molecular drugs using hydroxyapatite microspheres as the vehicle [J]. Advanced Powder Technology, 2010, 21: 268-27.
[12]William R C, Barbara J G, Stephen J B. Consideration of the pH-dependent inhibition of dihydrofolate reductase by methotrexate [J]. Journal of Molecular Biology, 1997, 271: 656-668.
Preparation and absorption capability study of strontium substituted nano-hydroxyapatite for methotreaxate
XIE Yuanfei,JI Jingou,XIANG Cuncheng,XU Yi
(College of Chemistry and Chemical Engineering, Chongqing University, Chongqing 400030, China)
Abstract:Strontium substituted nano-hydroxyapatite (nano-SrHA) was synthesized by co-precipitation method and applied to treat bone tumors.. The morphology of nano-SrHA was determined by transmission electron microscope (TEM) while its phase composition was characterized with X-ray diffraction (XRD). The absorption capability of nano-SrHA effected by coprecipitation time, feeding ratios of Sr, methotreaxate (MTX) concentrations and pH were also investigated. The results showed that the diffraction angles of nano-SrHA shifted to small value with the increase of feeding ratios of Sr, crystal forms and absorption capability increased with the coprecipitation time, and the nano-Sr(0.3)HA with the acicular structure had the best absorption capability of 43.09 mg/g when the pH was about 7.8. It indicated that nano-Sr(0.3)HA might be a potential candidate as MTX-delivery carrier.
Key words:nano-SrHA;absorption capability;methotreaxate
DOI:10.3969/j.issn.1001-9731.2016.02.007
文献标识码:A
中图分类号:O614.23+2; R318.08
作者简介:谢袁菲(1989-),女,重庆人,在读硕士,师承季金苟教授,从事纳米材料研究。
基金项目:国家自然科学基金资助项目(21375156)
文章编号:1001-9731(2016)02-02031-05
收到初稿日期:2015-03-10 收到修改稿日期:2015-10-21 通讯作者:季金苟,E-mail: 725_tiger@sina.com
