注射用盐酸溴己新溶媒相容性实验研究
2016-05-16兰宇
兰 宇
黑龙江省澳利达药业股份有限公司 黑龙江哈尔滨 150078
注射用盐酸溴己新溶媒相容性实验研究
兰 宇
黑龙江省澳利达药业股份有限公司 黑龙江哈尔滨 150078
目的考察注射用盐酸溴己新用5%葡萄糖注射液和0.9%的生理盐水等不同溶媒溶解后6小时内外观性状、不溶微粒、含量等质量指标随时间的变化,为临床正确应用药物提供依据。方法采用紫外-可见光分光光度法,在249nm的波长处测定吸光度,来测定盐酸溴己新的含量;采用高效液相色谱法,以十八烷基硅烷键合硅胶为填充剂;以甲醇:0.01mol/L磷酸二氢钠溶液(70:30)为流动相;流速每分钟1.0ml,检测波长248nm,测定有关物质;用不溶微粒检测仪测定不溶微粒。结果在20℃、6小时内,注射用盐酸溴己新用5%葡萄糖注射液和0.9%的生理盐水等不同溶媒溶解后,5%葡萄糖注射液各项质量指标均无明显变化,而用0.9%氯化钠溶解后含量有下降趋势,不溶微粒有所增加;ph值两种溶媒均无明显变化。结论临床注射用盐酸溴己新的应用应严格遵照说明书使用。
注射用盐酸溴己新;溶媒;相容性
注射用盐酸溴己新,是从鸭咀花碱(Vasicine)得到的半合成品,具有减少和断裂痰液中粘多糖纤维的作用,使痰液黏度降低,痰液变薄,易于咳出。其次它能抑制黏液腺和杯状细胞中酸性糖蛋白的合成,使痰液中的唾液酸(酸性粘多糖成分之一)含量减少,痰液黏度下降,有利于痰液咳出。本品的祛痰作用尚与其促进呼吸道粘膜的纤毛运动及具有恶性祛痰作用有关。由于痰液咳出,使患者的通气得到了改善。
1 试验方法与材料
1.1 材料
上海雷磁PH计、苏净L01A-24智能微粒检测仪、上海元析双光束紫外可见分光光度计UV-8000、SW-CJ-1BU净化工作台(单人水平)、岛津16AT高效液相色谱仪,CLASS-LC-16A色谱工作站,BP-211S电子天平,KQ-250DE数控超声波仪。
1.1.2 试验材料
注射用盐酸溴己新(批号20160501、20160502、20160503),甲醇为色谱纯,磷酸等试剂为分析优质纯。
1.2 试验方法与结果
1.2.1 方法
1.2.1.1 样品配制:为便于比较,均配制成250ml容积,即取一支注射用盐酸溴己新,分别用2ml5%GS(葡萄糖注射液)和0.9%氯化钠(NaCL)完全溶解,然后分别扩容到250ml的5%GS0.9%和0.9%氯化钠(NaCL)中(注:配制过程要求在超净台上操作,保持配制过程室温保持在10℃-30℃),得到样品A、B溶液,另取250ml的5%GS,0.9%NaCL做空白对照,分别在0、0.5、1、2、4、6小时考察各项指标的变化值。
1.2.1.2 考察指标:溶液外观、ph值、不溶性微粒、溶液澄明度、含量。
1.2.1.3 考察方法依据中国药典1相关附录和本品质量标准2。
在C语言课程实践教学中,采用团队合作模式是通过分组教学的方式,利用小组中学生的优缺点搭配,取长补短,促进教学质量的提升。操作过程中,教师要按照学生的学习成绩和特长进行分组,形成高效的学习团队,通过合作,互相促进。学生承担各自的角色分工责任,加强沟通协调,每个人都为实践内容的完成发挥作用。项目驱动教学,也称为案例教学。教师在教学过程中会提供学生可借鉴的案例,实际的项目内容研究需要学生根据自己的理解去完成。怎么完成,则由学生自己研究更有效的实现办法,根据目标去做所有的工作,而不是被要求做什么。这样,可以有效调动学生的主动性和积极性,尤其是全面解决问题的能力。
2.2 实验结果
2.2.1 外观 本品为白色或类白色的疏松块状物及粉末
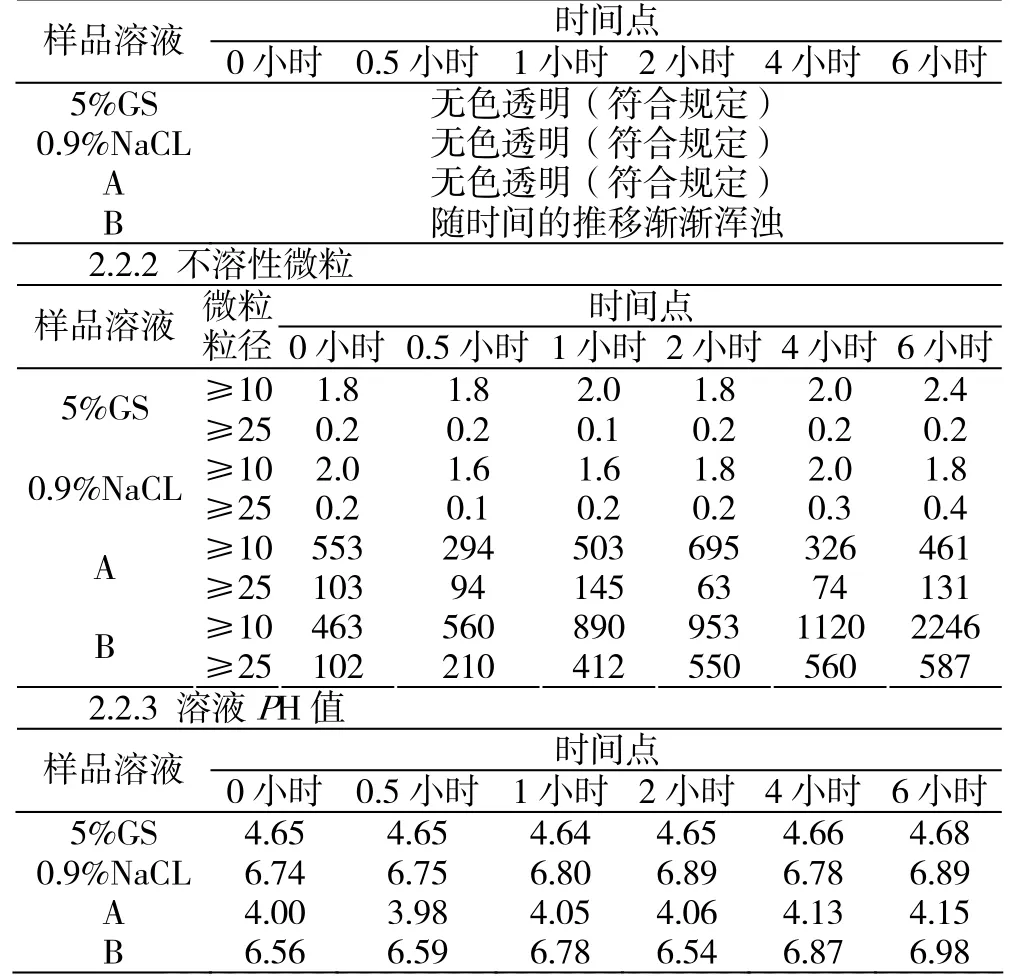
时间点样品溶液 0小时 0.5小时 1小时 2小时 4小时6小时5%GS 无色透明(符合规定)0.9%NaCL 无色透明(符合规定)A 无色透明(符合规定)B 随时间的推移渐渐浑浊2.2.2 不溶性微粒样品溶液 微粒粒径 0小时 0.5小时 1小时 2小时 4小时6小时时间点5%GS ≥25 0.2 0.2 0.1 0.2 0.20.2≥10 2.0 1.6 1.6 1.8 2.01.8 0.9%NaCL ≥25 0.2 0.1 0.2 0.2 0.30.4≥10 553 294 503 695 326461 A ≥25 103 94 145 63 74 131≥10 463 560 890 953 11202246 B ≥25 102 210 412 550 560587≥10 1.8 1.8 2.0 1.8 2.02.4 2.2.3 溶液PH值样品溶液 0小时 0.5小时 1小时 2小时 4小时6小时时间点5%GS 4.65 4.65 4.64 4.65 4.664.68 0.9%NaCL 6.74 6.75 6.80 6.89 6.786.89 A 4.00 3.98 4.05 4.06 4.134.15 B 6.56 6.59 6.78 6.54 6.876.98
2.2.4 溶液澄明度

样品溶液0小时0.5小时1小时 2小时 4小时6小时时间点5%GS符合规定符合规定符合规定 符合规定 符合规定符合规定0.9%NaCL符合规定符合规定符合规定 符合规定 符合规定符合规定A 符合规定符合规定符合规定 符合规定 符合规定符合规定B 符合规定符合规定不符规定 不符规定 不符规定不符规定
2.2.5 含量
取装量差异项下的内容物,混匀,精密称取细粉适量(约相当于盐酸溴己新2mg),置于100ml量瓶中,加乙醇适量,振摇使盐酸溴己新溶解,并加乙醇至刻度,摇匀,照紫外-可见分光光度法(中国药典2015年版四部),在249nm的波长处测定吸光度,按C14H20Br2N2·HCl的吸收系数为270计算,即得。

时间点样品溶液0小时0.5小时1小时 2小时 4小时6小时A 94.4%94.7%94.9% 95.4% 95.8%98.9% B 95.4%93.2%91.3% 90.7% 88.6%86.4%
2.2.6 有关物质
取本品内容物适量,加流动相制成每1ml含有盐酸溴己新0.4mg的溶液,做为供试品溶液;精密量取适量,用流动相稀释制成每1ml含有1μg的溶液,作为对照溶液照高效液相色谱法(中国药典2015年版四部)试验。用十八烷基硅烷键合硅胶为填充剂,以甲醇-0.01mol/L磷酸二氢钠溶液(用磷酸调节PH值至3.0)(70:30)为流动相,检测波长248nm。理论塔板数按盐酸溴己新峰计算应不低于2000。取对照品溶液20μl注入液相色谱仪,调节检测灵敏度,使主成分峰的峰高为满量程的10%-25%;再取供试品溶液20μl注入液相色谱仪,记录色谱图至供试品溶液主成分峰保留时间的3倍,供试品溶液的色谱图上如显杂质峰,量取各杂峰面积之和,不得大于对照品溶液的主峰面积(0.25%)。

时间点样品溶液0小时0.5小时1小时 2小时 4小时6小时A 符合规定符合规定符合规定 符合规定 符合规定符合规定B 符合规定符合规定不符规定 不符规定 不符规定不符规定
3 实验结论
从本试验结果可以看出,在六个小时内的各设计试验点检测,外观性状5%葡萄糖溶液符合规定而0.9%氯化钠发生浑浊,PH值5%葡萄糖溶液符合规定而0.9%氯化钠不符合规定(质量标准要求PH值应在3.0-5.0之间),不溶性微粒(药典规定≥10的微粒不超过3000个,≥25的微粒不超过300个)和澄明度5%葡萄糖溶液符合规定而0.9%氯化钠不符合规定,含量5%葡萄糖溶液符合规定而0.9%氯化钠不符合规定(合格范围90.0%-110.0%),有关物质5%葡萄糖溶液符合规定而0.9%氯化钠不符合规定。说明在临床应用时正常用5%葡萄糖稀释配制本品,不会产生影响。
4 实验讨论
(1)注射用盐酸溴己新生产过程中用到了注射用水,盐酸溴己新的注射水溶液也是很稳定的,故注射用水不再考察;
(2)注射用盐酸溴己新说明书已经明确写明使用时要用注射用水溶解(肌肉注射)和5%葡萄糖溶解,故在临床上不能用生理盐水稀释配制,这点临床医生应注意。
[1]王烽;方东伟;谢展鹏.高效液相色谱法测定盐酸溴己新片的含量[J].中国药业.2007(19).
[2]栾蓉,白冰.盐酸溴己新片鉴别方法的改进[J].山东医药工业.2003(01).
[3]陈乃江.高效液相色谱法测定茶新那敏片中盐酸溴己新含量[J].中国药业.2009(08).
R927
A
1672-5018(2016)07-240-01
