骨桥蛋白在侵入性胎盘组织中的表达和意义
2016-05-14赵卫卫侯朝晖陈冰任力朱建平
赵卫卫 侯朝晖 陈冰 任力 朱建平

[摘要] 目的 分析骨桥蛋白(OPN)在侵入性胎盘和正常胎盘组织中的表达差异,探讨其在侵入性胎盘发病机制中的作用。 方法 选取2014年1月~2015年10月在中国人民解放军空军总医院妇产科住院分娩的单胎晚期妊娠68例产妇的胎盘组织为研究对象,将其中正常妊娠产妇的胎盘组织34例作为对照组,侵入性胎盘疾病产妇的胎盘组织34例作为研究组,其中胎盘粘连26例(胎盘粘连组),胎盘植入8例(胎盘植入组)。采用免疫组化EnVision二步法检测所有胎盘组织中OPN蛋白表达水平;采用SYBR Green PCR方法检测所有标本中OPN mRNA的表达水平。 结果 OPN蛋白在胎盘粘连组、胎盘植入组和对照组胎盘组织中的阳性表达率分别为73.07%、75.00%、35.29%。胎盘粘连组和胎盘植入组OPN蛋白阳性表达率均高于对照组,差异均有统计学意义(P < 0.05);胎盘植入组与胎盘粘连组OPN蛋白阳性表达率比较,差异无统计学意义(P > 0.05)。胎盘粘连组中OPN mRNA表达较对照组上调1.36倍,而胎盘植入组OPN mRNA表达较对照组上调了1.21倍。 结论 胎盘组织中OPN表达升高可能与侵入性胎盘疾病的发生有关。
[关键词] 骨桥蛋白;侵入性胎盘;粘连性胎盘;植入性胎盘
[中图分类号] R339.22 [文献标识码] A [文章编号] 1673-7210(2016)03(b)-0080-04
[Abstract] Objective To investigate the role in thepathogenesis of placenta accrete through analyzing the expression differences of osteoponin (OPN) in the tissues of placenta accrete and normalplacenta. Methods Sixty-eight cases of placenta tissues of the third trimester pregnant women delivering in Department of Gynecology and Obstetrics of Air Force General Hospital from January 2014 to October 2015 were chosen as the research objects. 34 cases of placenta tissues from normal pregnancy women were taken as the control group and 34 cases of placenta tissues from pregnant women with placenta accrete were taken as the research group, of which including 26 cases of placenta adhesion (placenta adhesion group) and 8 cases of placenta increta (placenta increta group). The protein expressions of OPN in all placenta tissues were measured by EnVision immunohistochemistry. The mRNA expression of OPN in all placenta tissues were detected through SYBR Green PCR method. Results The positive rates of OPN protein expression in the placenta adhesion group, placenta increta group and control group were 73.07%, 75.00%, 35.29% respectively. The positive rates of OPN protein expression in the placenta adhesion group and placenta increta group were both significantly higher than the control group, the differences were statistically significant (P < 0.05). There was no statistically significant difference between placenta increta group and placenta adhesion group (P > 0.05). The mRNA expression of OPN in placenta adhesion group increased 1.36 times compared with the control group; and the mRNA expression of OPN in placenta increta group increased 1.21 times compared with control group. Conclusion High expression of OPN in tissues of placenta may be related to the pathogenesis of placenta accrete.
[Key words] Osteoponin; Placenta accrete; Placenta Adhesion; Placentaincreta
侵入性胎盘是由于胎盘种植部位子宫内膜缺损或者发育不良,导致胎盘绒毛直接种植在子宫肌层甚至深入肌层的病理现象[1],是导致产后出血极为严重的并发症。根据绒毛侵入子宫肌层的深度分为粘连性胎盘、植入性胎盘和穿透性胎盘[2]。目前我国剖宫产率居高不下,计划外妊娠人工流产不断增加,“普遍二胎”制度放开,妊娠伴子宫创伤史的孕妇会越来越多,侵入性胎盘疾病的发生率也将随之上升。据统计,近年来我国侵入性胎盘的发病率占所有妊娠的0.4%~1.93%[3]。侵入性胎盘疾病发病隐蔽,胎盘娩出前不易被发现,处理起来被动棘手,因此该疾病越来越受到人们的关注。骨桥蛋白(osteoponin,OPN)是一种细胞外介质,可以与整合素受体αvβ3特异性结合,从而发挥细胞间黏附、细胞迁移以及细胞外基质的相互作用[4]。目前对于OPN与侵入性胎盘疾病发生关系的报道极为少见,本研究采用免疫组化EnVision二步法和SYBR Green PCR方法检测晚孕期侵入性胎盘组织中OPN的表达情况,从而初步探讨OPN在侵入性胎盘发病机制中的作用。
1 资料与方法
1.1 一般资料
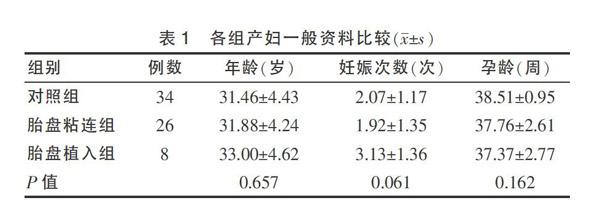
选取2014年1月~2015年10月在空军总医院妇产科住院分娩的单胎晚期妊娠孕妇共68例,其中正常妊娠孕妇胎盘组织34例作为对照组,发生侵入性胎盘疾病孕妇胎盘组织34例作为研究组,其中包括胎盘粘连26例(胎盘粘连组),胎盘植入8例(胎盘植入组)。参照Gielchinshey等[5]在2002年提出的侵入性胎盘的诊断标准,排除合并妊娠期高血压、妊娠期糖尿病、围生期心肌病及胎膜早破等病史的孕妇。经过孕妇同意,并经相关医学医学伦理委员会批准,收集部分产后胎盘组织进行检测。三组孕妇年龄、妊娠次数及孕龄比较差异均无统计学意义(P > 0.05),具有可比性。见表1。
1.2 标本采集
产妇胎盘娩出后迅速取胎盘母面粘连或植入部位的胎盘组织2~3块,正常胎盘选取中间带部位,避开出血、坏死、钙化的地方,每块大小1.0 cm×1.0 cm×1.0 cm,用生理盐水冲洗,置于4%多氯甲醛中固定24 h后,自来水冲洗,酒精梯度脱水,二甲苯透明,最后石蜡包埋制成蜡块,用于免疫组化和SYBR Green PCR实验。
1.3 免疫组织化学EnVision二步法检测胎盘组织OPN蛋白表达水平
每例标本取石蜡切片2张,EnVision二步法免疫组织化学染色。主要步骤:石蜡切片60℃烤片机过夜;二甲苯脱蜡2次,每次5 min;100%酒精、95%酒精、85%酒精、75%酒精、双蒸水各5 min,水化;盛有pH 6.0乙二胺四乙酸液(北京中杉金桥生物技术有限公司)的高压锅中高温抗原修复2 min;3%过氧化氢溶液中10 min,阻断内源性过氧化物酶;磷酸缓冲盐(PBS)液冲洗后,滴加一抗即兔抗人OPN单克隆抗体(1∶150,北京中杉金桥生物技术有限公司),37℃孵育60 min;PBS液冲洗,滴加二抗(DAKO公司),室温孵育30 min;PBS液冲洗,使用二氨基联苯胺溶液(DAKO公司)显色,自来水冲洗;苏木精复染,1%的盐酸酒精分化,1%氨水中返蓝;75%酒精、85%酒精、95%酒精、100%酒精脱水各3 min;二甲苯溶液透明,中性树胶封片。用一抗稀释液替代一抗进行阴性对照,反应呈阴性。
1.4 免疫组化结果判定标准
参照Shimizu法[6],每张切片在显微镜下观察随机选择5个高倍镜视野,计数100个细胞。根据阳性细胞在全部组织细胞中所占的百分比以及阳性细胞染色强度进行半定量评分。阳性细胞占总细胞百分比评分:<25%为0分;25%~50%为1分;>50%~75%为2分;>75%为3分。染色强度评分:不着色为0分;黄色为1分;棕色为2分;棕褐色为3分。根据以上两项评分之和进行判断:0分为阴性(-);1~2分为弱阳性(+);3~4分为中度阳性(++);5~6分为强阳性(+++)。
1.5 SYBR Green PCR方法检测胎盘组织中OPN mRNA表达水平
分别取5 μm厚石蜡切片5片,使用HiPure FFPE RNA Plus Kit试剂盒(Magen公司)提取RNA。使用核酸测定仪(Merinton公司)检测并记录提取样品RNA浓度,计算OD260/OD280比值。比值为1.80~2.00,说明纯度符合要求;低于1.80说明存在蛋白质污染,需要重新提取RNA。使用M-MLV First Strand cDNA Synthesis Kit试剂盒(Omega公司)反转录cDNA。选用GAPDH作为内参指标,标准化目的基因结果,校正不同样本间RNA纯度和逆转录效率的差异。最后取2×RT2 SYBR Green Mastermix 10 μL、RNase-Free Water 4 μL、上下游引物各1 μL、cDNA 4 μL配成20 μL体系,每例样品均设4个平行重复孔。简单离心后置于实时荧光定量PCR仪(美国BIO-RAD)中,并设定程序:95℃ 10 min,1次;95℃ 15 s,60℃ 1 min,循环40次,进行扩增。所有步骤均按照相关说明书严格执行。引物由迪纳兴科公司设计合成,引物序列见表2。
1.6 SYBR Green PCR结果处理
由于Ct值指从基线到指数增长的拐点所对应的循环次数,是指数关系,而不是线性关系,不能用t检验或者方差分析等的统计学方法。因而将原始Ct值转换为2-Ct,从而达到线性关系。本实验采用Ct值法(2-ΔΔCt)对SYBR Green PCR结果进行相对定量分析。2-ΔΔCt表示实验组目的基因表达相对于对照组变化的倍数。计算公式:ΔΔCt=(Ct目的基因-Ct内参基因)研究组-(Ct目的基因-Ct内参基因)对照组[7]。
1.7 统计学方法
采用SPSS 19.0统计学软件进行数据分析,计量资料数据用均数±标准差(x±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P < 0.05为差异有统计学意义。
2 结果
2.1 三组胎盘组织中OPN蛋白表达情况
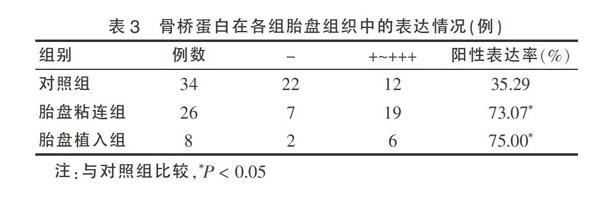
OPN蛋白在侵入胎盘组和对照组胎盘组织中均有表达,其免疫反应阳性产物为棕褐色颗粒状或点状,主要定位于胎盘绒毛滋养细胞胞浆和胞膜中,绒毛间质和毛细血管内皮细胞中也有大量表达。侵入性胎盘组OPN蛋白表达较对照组细胞数量多,着色深。高倍镜下观察胎盘植入组胎盘组织中OPN蛋白表达与胎盘粘连组并无明显差异,见图1(封三)。OPN在胎盘粘连组、胎盘植入组和对照组胎盘组织中表达的阳性率分别为73.07%、75.00%、35.29%。胎盘粘连组、胎盘植入组标本中OPN蛋白阳性表达率均明显高于对照组,差异均有统计学意义(P < 0.05)。而胎盘植入组与胎盘粘连组标本中OPN蛋白阳性表达率比较,差异无统计学意义(P > 0.05)。见表3。
2.2 SYBR Green PCR检测结果
OPN mRNA在在两组胎盘组织中均有表达,经2-ΔΔCt法分析后可知:胎盘粘连组中OPN mRNA表达较对照组上调1.36倍,而胎盘植入组OPN mRNA表达较对照组上调了1.21倍。
3 讨论
OPN是一种分泌型磷酸化糖蛋白,分子量为25~75 kU,含有精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)特殊结构域。RGD特殊结构域是OPN发挥多种生物学功能的重要结构,可以与整合素受体αvβ3结合[8],从而发挥细胞间黏附、细胞迁移以及细胞外基质的相互作用。OPN广泛存在于多种组织、体液和细胞中,包括骨、软骨、血液、尿液、乳汁、白细胞、血管内皮细胞、平滑肌细胞、肿瘤细胞等[9]。OPN在肿瘤的发生、发展[10-11]、免疫调节[12]以及损伤修复[13]中的作用已经得到公认。刘能辉等[14]通过动物实验发现,OPN在围植入期小鼠子宫内膜中有表达,且随孕龄增加而表达增强。殷莉等[15]通过免疫组化和RT-PCR方法研究发现OPN mRNA和蛋白在妇女种植期子宫内膜组织中的表达明显升高,在早孕蜕膜和绒毛组织中表达进一步升高,推测OPN可能与种植窗开放和胚胎着床有关。Von Wolff等[16]的研究发现,OPN mRNA在妊娠6~9周的蜕膜组织也有表达,是分泌期的1.5倍。推测OPN与妊娠密切相关,可能参与受精、胚胎着床、胎盘形成、母胎界面黏附、信号转导以及母胎免疫调节等生殖的全过程[17]。
正常的妊娠的建立需要胎盘滋养细胞黏附、侵入并固定在蜕膜样变的子宫内膜上。滋养细胞属于上皮细胞,是胎盘的主要细胞,具有侵袭功能,这种功能与肿瘤细胞极为相似而又不同。滋养细胞的侵袭行为受时间和空间的严格限制,这是滋养细胞与肿瘤细胞的主要区别[18]。滋养细胞的分化和侵袭能力决定胎盘能否正常发育。而胎盘滋养细胞侵袭行为受到细胞因子、细胞外基质蛋白以及黏附分子的共同调控作用,相互制约平衡,一旦平衡被打破,就可能造成滋养细胞侵袭不足或者过度侵袭,从而发生各种病理妊娠[19]。Batorfi等[20]研究证实葡萄胎中OPN蛋白和mRNA水平的表达均明显降低。薛涵等[21]研究发现稽留流产患者绒毛和蜕膜组织中OPN表达低于正常人流组。秦晨等[22]通过动物实验发现自然流产组小鼠绒毛和蜕膜组织中OPN的表达明显低于正常妊娠组织。夏俊霞等[23]研究证实,OPN在子痫前期患者胎盘组织中低表达,滋养细胞侵袭力下调,导致滋养细胞浅浸润,子宫螺旋动脉重铸失败,胎盘浅着床。推测OPN在胎盘组织中的低表达可能导致葡萄胎、流产、子痫前期等疾病。
本研究结果显示,OPN在正常妊娠和侵入性胎盘组织中均有不同程度表达。OPN主要定位于胎盘绒毛滋养细胞胞浆和胞膜中,间质和毛细血管内皮细胞中也有表达。OPN蛋白在粘连性胎盘、植入性胎盘胎盘组织中表达的阳性率均高于对照组,差异有统计学意义(P < 0.05);胎盘植入组OPN蛋白阳性表达率与胎盘粘连组比较,差异无统计学意义(P > 0.05)。胎盘粘连组OPN mRNA较对照组上调了1.36倍,而胎盘植入组OPN mRNA较对照组上调了1.21倍。据此推测,OPN在侵入性胎盘组织中高表达,滋养细胞侵袭能力上调,导致滋养细胞侵袭过度,胎盘侵入甚至穿透子宫肌层,从而导致侵入性胎盘的发生。但是OPN具体是如何作用使滋养侵袭力上调导致侵入性胎盘发生的机制尚不清楚,有待进一步研究。本研究中植入性和胎盘粘连组织中OPN表达差异并无显著性,可能为样本数量较少所致,有待扩大样本量进一步研究。本研究为侵入性胎盘的发生机制提供参考依据,临床上能否以OPN为突破点,预测和预防侵入性胎盘疾病的发生,仍需进一步研究。
[参考文献]
[1] Ryan GL,Quinn TJ,Syrop CH,et al. Placenta accrete postpartum [J]. Obstet Gynecol,2002,100(5 Pt 2):1069-1072.
[2] 戴钟英.胎盘植入的命名、发生率及病因[J].实用妇产科杂志,2008,24(12):705-707.
[3] 刘艳,赵琳,罗远材,等.前置胎盘、胎盘粘连及胎盘植入的临床病理分析[J].中国妇幼保健,2015,30(11):1660-1663.
[4] Kim S,Shin T. Immunohistochemical study of osteopontin in boartestis [J]. J Vet Sci,2007,8(2):107-110.
[5] Gielchinsky Y,Rojansky N,Fasouliotis SJ,et al. Placenta accrete-summary of 10 years:a survey of 310 cases [J]. Placen,2002,28(2):210-214.
[6] Laicuori H,Kaaja R,Koistine H,et al. Leptin during and after preeclampsia or normal pregnancy:its relation to serum insulin and insulin sensitivity [J]. Metabolism,2000, 49(2):259-263.
[7] 颜露春.TLR-4,HBD-2及TNF-α在子痫前期胎盘组织中的表达及相关性研究[D].南宁:广西医科大学,2010.
[8] Ahmed M,Kundu GC. Osteopontin selectively regulates p70S6K/mTOR phosphorylation leading to NF-kappaB dependent AP-1-mediated 1 CAM-1 expression in breast cancer cells [J]. Mol Cancer,2010,9:101.
[9] 徐琛,李红霞.骨桥蛋白表达与卵巢癌紫杉醇耐药相关性临床研究[J].中国妇产科临床杂志,2015,(6):531-533.
[10] Bandiera E,Zanotti L,Fabricio AS,et al. Cancer antigen 125,human epididymis 4,kallikrein 6,osteopontin and soluble mesothelin-related peptide immunecomplexed with immunoglobulin M in epithelial ovarian cancer diagnosis [J]. Clin Chem Lab Med,2013,51(9):1815-1824.
[11] Rafal M,Sebastian S,Dariusz S,et al. Role of osteopontin in differential diagnosis of ovarian tumors [J]. Obstet Gynaecol,2013,39(11):1518-1525.
[12] Liang KH,Yeh CT. OPN sesame [J]. Hepatobiliary Surg Nutr,2014,3(3):112-114.
[13] Dabiri G,Heiner D,Falanga V. The emerging use of bone marrow-derived mesenchymal stem cells in the treatment of human chronic wounds [J]. Expert Opin Emerg Drugs,2013,18(4):405-419.
[14] 刘能辉,周昌菊.骨桥蛋白(OPN)在围植入期小鼠子宫内膜中的表达[J].中国现代医学杂志,2012,22(25):18-23.
[15] 殷莉,钟刚.骨桥蛋白在人子宫内膜、早孕蜕膜和绒毛中的表达及意义[J].现代妇产科进展,2007,16(9):670-675.
[16] Von Wolff M,Bohlmann MK,Fiedler C,et al. Osteopontin is upregulated in human decidual stromal cells [J]. Fertil Steril,2004,81(Suppl 1):741-748.
[17] Briese J,Oberndorfer M,Patschenik C,et al. Osteopontin is colocalized with the adhesion molecule CEACAM1 in the extravillous trophoblast of the human placenta and enhances invasion of CEACAM1-expressing placental cells [J]. J Clin Endocrinol Metab,2005,90(9):5407-5413.
[18] Patan S. Vasculogenesisand angiogenesis [J]. Cancer Treat Res,2004,(117):3-32.
[19] 刘艳.侵入性胎盘的发病原因及病理学、分子生物学特征[J].山东医药,2015,55(35):100-102.
[20] Batorfi J,Fulop V,Kim JH,et al. Osteopontin is down-regulated in hudatidiformmole [J]. Gynecol Oncol,2003,89(1):134-139.
[21] 薛菡,陈梅.骨桥蛋白在稽留流产疾病中的表达[J].广东微量元素科学,2015,22(9):26-29.
[22] 秦晨.survivin和OPN在自然流产孕鼠模型胎盘组织中的表达[J].中国优生优育,2013,19(6):453-455.
[23] 夏俊霞,乔福元,苏放明,等.整合素αvβ3在子痫前期患者胎盘组织中的表达及意义[J].华中科技大学学报:医学版,2011,40(3):310-314.
(收稿日期:2015-12-10 本文编辑:任 念)
