液相色谱-串联质谱法筛查原多甲藻酸毒素及其代谢产物
2016-05-12吴海燕郭萌萌赵春霞谭志军
吴海燕, 郭萌萌, 赵春霞, 谭志军*,
顾海峰3, 翟毓秀1,2, 卢立娜1,2
(1. 农业部水产品质量安全检测与评价重点实验室, 中国水产科学研究院黄海水产研究所, 山东 青岛 266071;
2. 农业部水产品质量安全风险评估实验室(青岛), 山东 青岛 266071;
3. 国家海洋局第三研究所, 福建 厦门 361000)
研究论文
液相色谱-串联质谱法筛查原多甲藻酸毒素及其代谢产物
吴海燕1,2,郭萌萌1,2,赵春霞1,2,谭志军1,2*,
顾海峰3,翟毓秀1,2,卢立娜1,2
(1. 农业部水产品质量安全检测与评价重点实验室, 中国水产科学研究院黄海水产研究所, 山东 青岛 266071;
2. 农业部水产品质量安全风险评估实验室(青岛), 山东 青岛 266071;
3. 国家海洋局第三研究所, 福建 厦门 361000)
摘要:建立了原多甲藻酸毒素(azaspiracids, AZAs)及其代谢产物的液相色谱-串联质谱检测方法,考察了目标代谢产物检测方法和非目标多离子检测方法,将二级质谱图与标准品谱库进行比对,从而获得高精准定性。通过对产毒藻、蓄积代谢实验样品和实际阳性样品综合分析,共检出11种AZAs,其中包括AZA-2,3,6,11,12,16,17,28和36,以及AZAs的谷胱甘肽结合型代谢产物。结果发现,目标代谢产物检测法可无偏差地筛出常规代谢物,而且对低浓度代谢产物表现出更佳的响应。本方法重现性好,数据分析简单,对操作人员的专业要求不高,更适合AZAs的监控要求。
关键词:液相色谱-串联质谱法;原多甲藻酸毒素;代谢产物;定性分析
贝类毒素具有强毒性和不可预见性等特点,对消费者健康安全和近海生态造成严重威胁,是国际社会共同关注的生态灾害和重大海洋环境问题。现有8大类贝类毒素中,原多甲藻酸毒素(azaspiracids, AZAs)是最晚发现的一类新型脂溶性贝类毒素,但这类毒素毒性强、残留高且代谢慢,因此成为欧盟、美国、加拿大等组织和国家重点关注的对象,不仅将其限量标准设定为160 μg AZA-1 eq/kg,而且在国际贸易中重点加以监控。在我国,本实验室在东部沿海城市市售贝类中发现AZAs的存在[1],随后又在北黄海养殖虾夷扇贝中也发现了这类毒素[2]。顾海峰等[3,4]则证实了其产毒藻Azadiniumpoporum(A.poporum)广泛分布于我国近海海域,超过86%的藻株均可产生AZAs,主要毒素为AZA-2,表明AZAs及其产毒藻已对我国近海生态和食品安全带来严重的潜在威胁,必须加以重视。
AZAs被认为是已知贝类毒素中风险最大的一种,主要通过蓄积到贝类组织中对人类健康安全造成威胁[5]。AZAs是现有贝类毒素中毒性较强的一种,人体可观测到最小效应剂量(LOAEL)为1.9 μg AZA-1 eq/kg b. w.,低于麻痹性贝毒2 μg/kg b. w.的水平[6]。多种贝类对AZAs的富集能力都极强,最高则可达到8 970 μg/kg,为限量标准的56倍之多[7,8]。比较而言,AZAs在贝类中的消除半衰期则长达11天,不仅可长时间存在于贝类中,而且消除过程中可代谢成数十种产物,其毒性和风险性仍不明确[7-10],给消费者带来严重的潜在风险[8]。因此,欧盟拟将贝类中AZAs限量标准下调到30 μg AZA-1 eq/kg b. w.,并加强对这类毒素及其代谢物的监控[11]。
目前,AZAs快速前处理提取技术以及高效质谱检测技术[12-14]已比较完善,且被用于相关地区AZAs污染的监控。不过,现有方法检测的目标物多限于商品化标准物质AZA-1,2,3等3种主要组分,虽然这3种组分为欧盟限量规定的主要目标,但是缺少AZAs代谢产物的确证方法,严重阻碍了进一步开展AZAs代谢产物对消费者健康风险的评估。现有研究表明,AZAs经食物链蓄积到贝类后,可通过氧化、羟基化或脱羧等不同代谢途径,形成40余种反应性代谢产物[7-10]。另外,在乳猪AZA-1,2,3毒素口服暴露试验中发现,肠道内容物中除50%是毒素原体外,还有以AZA-8和AZA-10为主的代谢产物,同时证实了存在Ⅱ相代谢过程[15]。可见代谢产物的检测也非常有必要,尤其是代谢产物毒性数据尚不完善,给消费者带来的安全风险较大。因此,本研究在前期基础上,进一步创建了AZAs的目标代谢产物检测方法和非目标多离子检测方法,并通过对产毒藻、蓄积代谢试验样品和实际阳性样品的综合分析,明确了AZAs在贝类中蓄积代谢的主要途径及代谢产物,为进一步完善我国水产品中贝类毒素的监控体系提供可靠的工作基础和技术支撑。
1实验部分
1.1仪器与试剂
Prominence UFLC超快速液相色谱(Shimadzu公司); 5500 QTRAP四极杆-线性离子阱复合质谱检测系统(SCIEX公司),配电喷雾离子(electrospray ionization, ESI)源;T18 basic均质机(IKA公司); XW-80 A旋涡混合器(上海医大仪器厂); Himac CR 22GⅡ高速离心机(HITACHI公司); N-EVAP112氮吹仪(Organomation公司); Milli-Q超纯水仪(Millipore公司); JY92-IIN超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
标准品azaspiracid-1(CRM-AZA1, (1.24±0.07) g/mL)、azaspiracid-2(CRM-AZA2, (1.28±0.05) g/mL)、azaspiracid-3(CRM-AZA3, (1.04±0.04) g/mL)购自加拿大国家研究理事会海洋生物科学研究所(CRM);甲醇、乙腈(HPLC级,Merck公司);甲酸(HPLC级,Fluka公司);超纯水(18. 2 MΩ5cm),其他未作特殊说明的试剂均为分析纯。
1.2样品处理方法
产毒藻收集及毒素提取:AZAs产毒藻(A.poporum, AZDY06株)由国家海洋局三所顾海峰老师提供,该藻所产毒素种类为AZA-2。实验室条件下f/2-Si培养液培养,温度20 ℃,光照强度60%,光暗比12 h∶12 h。玻璃纤维滤膜收集指数期(>107cells/L)藻细胞,置于2 mL离心管中,加入丙酮1mL溶解,超声破碎细胞15 min,强度20%,间隔0.2 s/次。然后用10 kDa超滤离心管超滤离心1 min(1 000×g),收集上清液以待分析。
蓄积实验及试验样品处理:24只栉孔扇贝((67±8) mm)于2015年4月购自青岛金海湾养殖合作社,不间断充氧条件下运入实验室,暂养48 h后用于蓄积实验。18只扇贝暴露于指数期藻液稀释液(50 000 cells/L)中作为实验组,6只扇贝作为空白对照组,共持续12 h,暴露过程中不投喂任何饵料。暴露试验结束后,分离扇贝肌肉组织及消化腺,均质后冷藏于-18 ℃。
实际阳性样品为采自福建省福州市水产品市场的市售栉孔扇贝,经检测浓度为40 μg AZA-2 eq/kg[2]。
样品前处理参考实验室已有方法[2]。概述如下:称取(2.00±0.02) g样品,分别用3 mL甲醇提取3次,离心后合并上清液,于40 ℃氮吹至约1 mL,加入3 mL超纯水待净化。依次用1 mL甲醇、1 mL 30%(v/v)甲醇水溶液活化StrataTM-X固相萃取柱(60 mg/3 mL),然后加入提取液,再用1 mL 20%(v/v)甲醇水溶液淋洗,最后用1 mL 0.3%(v/v)氨水甲醇溶液洗脱,收集洗脱液,用甲醇定容至1 mL,过0.22 μm滤膜,上机分析。
1.3超快速液相色谱-串联质谱分析条件
液相色谱条件:Kinetex XB-C18色谱柱(100 mm×2.1 mm, 2. 6 μm);柱温:40 ℃;流速:0. 30 mL/min;进样量:5 μL;流动相:A为0.15%(v/v)甲酸水溶液,B为乙腈。洗脱梯度:0~7.0 min, 20%B~90%B; 90%B持续3 min; 10.0~10.1 min, 90%B~20%B; 20%B持续1 min。
质谱条件:电喷雾离子源,负离子模式;喷雾电压:4.5 kV;气帘气压力:0. 24 MPa;碰撞气压力:0. 02 MPa;温度:550 ℃;碰撞室入口电压:10 V;碰撞室出口电压:12 V;离子源Gas 1: 0. 34 MPa; Gas 2: 0. 34 MPa。其他参数见表1。

表 1 原多甲藻酸毒素的质谱分析参数
目标代谢产物检测法(predictive multiple reaction monitoring-information-dependent acquisition-enhanced product ion,pMRM-IDA-EPI):根据AZA-2的结构及质谱裂解规律,基于其常见和已知的I相和Ⅱ相生物转化途径,预测44种代谢反应的代谢产物的理论pMRM离子对,设置相应的IDA条件(扫描范围m/z428~1 250,阈值1 000 cps)以触发增强型子离子扫描(EPI)。获得代谢物的二级子离子全扫描谱图,代谢物结构解析应用MS Fragmenter软件完成,同时比对代谢物与母体的二级质谱,对代谢物进一步确认。
非目标多离子检测法(multiple ion monitoring-enhance resolution-information-dependent acquisition-enhanced product ion, MIM-ER-IDA-EPI):以m/z806~1 206为扫描范围,Q1和Q3设置相同的质荷比,共监测401对离子对。Q2碰撞能设置为5 V,避免母离子破碎,驻留/停顿时间设为1 ms, CXP 15。
2结果与讨论
2.1原多甲藻酸毒素质谱谱库的建立
AZAs是一种具有6,5,6-三螺环和环胺结构的亲脂性聚醚类海洋生物毒素(见图1)。产毒藻中的AZAs毒素主要以AZA-1,2,3的形式存在,经双壳贝类摄食代谢后产生一系列代谢产物。
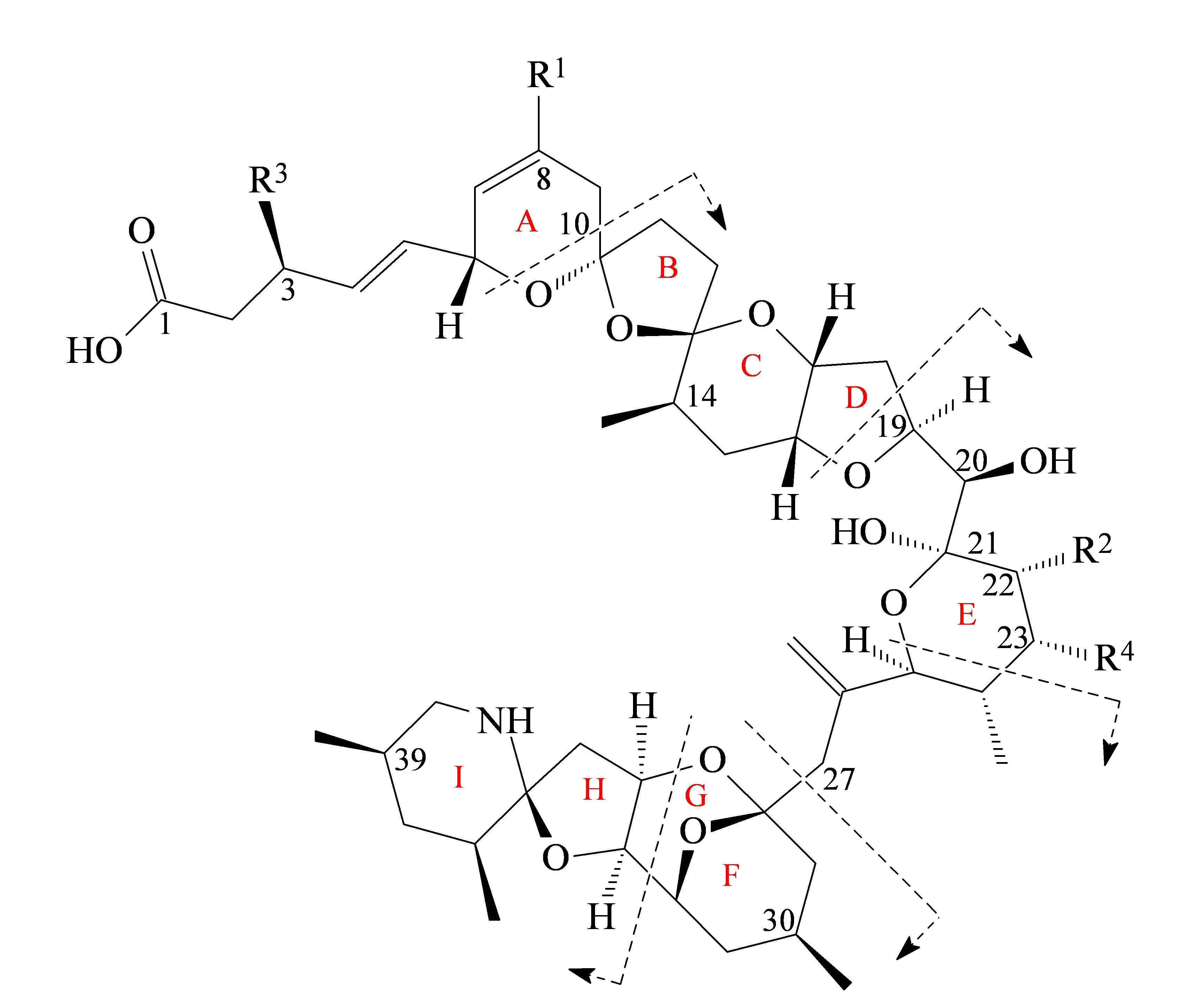
图 1 AZAs毒素的化学结构Fig. 1 Chemical structure of azaspiracids
AZAs在ESI源电离模式下,所带电荷位于分析结构末端,产生的碎片离子是末端脱离的小分子或者大分子结构。因此,在碰撞诱导解离(collision-induced dissociation, CID)模式下,多采用分子离子的脱水峰作为特征离子。AZAs分子电离产生的最小结构离子碎片为发生RDA (Retro-Diels-Alder)反应的A环断裂。AZAs的二级碎片离子主要包括:[M+H]+、[M+H-nH2O]+、[M+H-H2O-C9H10O2R1R3]+。按拟定实验方法对加标扇贝样品进行质谱检测,3种毒素的二级质谱中存在的特征离子包括m/z672 (AZA-3,m/z658)、m/z462 (AZA-3,m/z448)和m/z362等,主要碎片及其丰度见表2,而分离自我国海域的AZAs产毒藻中,其二级质谱中发现了m/z348[4],存在结构差异。
谱库即以标准品为样品,分别建立并储存碰撞能为20、35、50和(35±15) eV时的二级质谱图。通过调节Q2中的碰撞能量获得丰富的碎片,然后对其主要碎片做MS3,归属碎片来源,确定化合物结构。在实际样品检测过程中,将所获得的EPI谱图与谱库中该化合物的谱图匹配,当匹配值(Fit值)超过85时,为确证分析的有效判据。当Fit值小于50时可判为阴性。

表 2 谱库中AZAs主要碎片及其丰度
CE: (35±15) eV.
2.2原多甲藻酸毒素代谢产物质谱分析方法的建立
AZAs分子结构中的C3和C23是主要的羟基化位点,C8和C22为主要的甲基化位点(见图1),另外还有羧基化代谢产物[16]。根据上述已知的生物转化途径,通过预测代谢产物的pMRM进行代谢产物筛查。为了同时实现定性和定量的要求,本研究采用了pMRM-IDA-EPI模式,利用QTrap的线性离子阱功能在MRM获得化合物的保留时间、峰面积、离子比率等信息的同时,通过EPI扫描获得MS/MS图谱,以代谢产物中的碎片离子比对谱库与碎裂规律进行定性分析。为了防止丢失不可预测的非常规代谢产物,同时建立了MIM-ER-IDA-EPI方法,以达到同时检测常规和非常规代谢产物的目的。
由于生物体内的基质复杂且自然环境下暴露样品中代谢产物的含量低,因此获得优秀的灵敏度和精确度对于代谢产物的筛查更为重要。对比两种检测方法所获得的谱图(见图2), MIM-ER-IDA-EPI方法达到了更宽的扫描范围,因此对其数据的分析和后处理较为复杂。同时,pMRM-IDA-EPI根据AZAs的主要代谢反应预测的44种常规代谢产物,可以检测到主要的代谢产物并进行确证分析,且对低浓度代谢产物响应更优。因此,比较而言,pMRM-IDA-EPI方法满足代谢产物筛查需求,重现性好,数据分析简单,对操作人员专业要求不高,更适用于日常毒素监控要求。

图 2 蓄积代谢样品非目标多离子检测法与目标代谢 产物检测法总离子流图Fig. 2 Total ion chromatograms of exposure test sample with multiple ion monitoring-enhance resolution-information-dependent acquisition-enhanced product ion (MIM-ER-IDA-EPI) and predictive multiple reaction monitoring-information-dependent acquisition-enhanced product ion (pMRM-IDA-EPI) methods
2.3实际样品的分析
应用上述检测方法检测产毒藻、蓄积代谢实验样品和实际阳性样品中的原多甲藻酸毒素及其代谢产物。结果发现,蓄积代谢试验样品栉孔扇贝中的AZAs及其代谢产物主要有AZA-2,3,6,11,12,16,17,28,36以及1种AZAs的谷胱甘肽结合型代谢产物,其中羟基化、甲基化、羧基化为主要的代谢方式。本方法中应用pMRM-IDA-EPI结合的方式进行的定性具有更高的可信度,色谱及质谱离子碎片信息见图3。研究中在蓄积实验样品和实际阳性样品中均检测到少量谷胱甘肽结合物。初筛出的代谢产物类型及代谢途径见表3。
以AZA-1标准曲线计算除AZA-2和AZA-3外的其他代谢产物含量,AZA-2和AZA-3用各自的标准曲线定量,结果以μg AZA-1 eq/kg折算,其中AZA-1、AZA-2、AZA-3的毒力当量因子分别为1.0、1.8、1.4,其他物质的毒力当量因子以1.0计。产毒藻毒素含量最高,为530 μg AZA-1 eq/kg;蓄积实验消化腺样品贝类毒素次之,为(320±20) μg AZA-1 eq/kg;肌肉组织样品与实际阳性样品中毒素含量较低。应用代谢产物研究方法所获得AZA-2的EPI匹配谱库Fit值>89, AZA-3的EPI匹配谱库Fit值>86,证明了方法有效性。其中蓄积代谢实验消化腺样品代谢产物含量占比8.70%,实际阳性样品代谢产物含量占比为16.4%。

图 3 原多甲藻酸毒素代谢产物的增强子离子扫描谱图Fig. 3 EPI chromatograms of azaspiracid metabolites a. M44 (m/z 842.5); b. parent (m/z 856.5); c. M8 (m/z 838.2); d. M6 (m/z 870.4); e. M32 (m/z 888.4); f. M2 (m/z 858.5); g. M25 (m/z 936.6); h. M77 (m/z 828.5); i. M18 (m/z 1143.5). For peak IDs, see Table 3.

PeakIDinFig.4BiotransformationQ1/Q3(m/z)Retentiontime/minAZASourceofsampleParent856.5/838.45.36AZA-2toxinproducingalgae,exposuretestsample,AZAspositiveshellfishM6-H2O+2O870.4/852.55.54AZA-11,12,17toxinproducingalgae,exposuretestsample,AZAspositiveshellfishM2-CH2+O858.5/348.25.74AZA-36toxinproducingalgae,exposuretestsampleM8-H2O838.2/820.35.37AZA-28exposuretestsampleM32+2O888.4/870.53.92AZA-16exposuretestsampleM44-CH2842.5/824.57.38AZA-6exposuretestsampleM25+2C2H2O936.6/918.46.94-exposuretestsampleM77-2CH2828.54.65AZA-3exposuretestsampleM18+glutathione-H2O1143.5/1143.59.73-exposuretestsample,AZAspositiveshellfish
由于EPI只能获得m/z1 000以下的离子碎片,需要进一步完善谷胱甘肽型结合代谢产物定性方法,如采用中性丢失的方式。贝类样品基质复杂且所含贝类毒素尤其是代谢产物含量低,因此所获得的EPI谱图主要以母离子和脱水离子峰为主作为毒素定性依据(见图3),但无法清晰地看到A环、C19-C20和E环的碎裂片段。如需完成结构分析,仍需纯化后结合核磁共振数据。
3结论
本方法采用三重四极杆复合线性离子阱质谱仪,建立了原多甲藻酸毒素及其代谢产物的pMRM-IDA-EPI和MIM-ER-IDA-EPI方法,分别对产毒藻、蓄积代谢实验样品和实际阳性样品进行代谢产物分析。结果表明,pMRM检测方法从候选代谢物中无偏差地找到常规代谢物,满足代谢产物需求,且低浓度代谢产物响应更优。除原毒素AZA-2外,共发现10种代谢产物,包括AZA-3,6,11,12,16,17,28,36以及1种AZAs的谷胱甘肽结合型代谢产物。羟基化、甲基化、羧基化为主要的生物代谢途径。
产毒藻经过贝类的蓄积作用进入食物链,给消费者带来极大的食用安全风险。由于目前缺乏系统的监控计划,我国的鲜活贝类产品对欧美国家的出口已全面停止,成为制约产业发展的关键瓶颈。同时,消费者因摄入污染贝类中毒事件时有发生,其中2011年浙江地区发生了200余人的腹泻性贝类毒素中毒事件[17]。尤其是分离自我国的原多甲藻A.poporum已被证实产生多种AZAs且在整个海岸线均有分布[3],且主要毒素为AZA-2,其毒素当量因子为1.8,毒性较AZA-1更强,因此加强贝类安全监管已迫在眉睫。
目前国际上关注的AZAs产毒藻主要是A.spinosum,我国海域分布的AZAs产毒藻主要为A.poporum,且贝类体内代谢产物存在独特的“m/z348”碎片。为了明确该产毒藻的产毒特性,亟需开展AZAs在贝类体内的消除代谢规律研究,这对于确保我国消费者安全和贝类产业健康发展具有重要意义。
参考文献:
[1]Yao J H, Tan Z J, Zhou D Q, et al. Chinese Journal of Chromatography, 2010, 28(4): 363
姚建华, 谭志军, 周德庆, 等. 色谱, 2010, 28(4): 363
[2]Wu H, Guo M, Tan Z, et al. J Chromatogr A, 2014, 1358: 172
[3]Krock B, Tillmann U, Witt M, et al. Harmful Algae, 2014, 36: 22
[4]Gu H, Luo Z, Krock B, et al. Harmful Algae, 2013, 21/22: 64
[5]Furey A, O’Doherty S, O’Callaghan K, et al. Toxicon, 2010, 56(2): 173
[6]EFSA. The EFSA Journal, 2008, 723: 1
[7]Salas R, Tillmann U, John U, et al. Harmful Algae, 2011, 10(6): 774
[8]Jauffrais T, Marcaillou C, Herrenknecht C, et al. Toxicon, 2012, 60(4): 582
[9]Jauffrais T, Contreras A, Herrenknecht C, et al. Aquatic Toxicol, 2012, 124/125: 179
[10]Jauffrais T, Kilcoyne J, Herrenknecht C, et al. Toxicon, 2013, 65: 81
[11]EFSA. The EFSA Journal, 2009, 1306: 1
[12]Fang L Y, Yao X P, Wang L, et al. Chinese Journal of Health Laboratory Technology, 2014, 24(16): 2316
方兰云, 姚浔平, 王立, 等. 中国卫生检验杂志, 2014, 24(16): 2316
[13]Han S, Liu X, Li J H, et al. Food Science, 2014, 35(4): 116
韩深, 刘鑫, 李建辉, 等. 食品科学, 2014, 35(04): 116
[14]Han S, Wang P Y, Liu Y, et al. Chinese Journal of Chromatography, 2013, 31(10): 939
韩深, 王珮玥, 刘萤, 等. 色谱, 2013, 31(10): 939
[15]Botana L M. Seafood and Freshwater Toxins: Pharmacology, Physiology, and Detection. 3rd ed. Florida: CRC Press, 2014
[16]Rehmann N, Hess P, Quilliam M A. Rapid Commun Mass Spectrom, 2008, 22(4): 549
[17]Chen T, Xu X, Wei J, et al. PLoS One, 2013, 8(5): 1
Liquid chromatography-tandem mass spectrometry analysis for azaspiracids and their metabolites
WU Haiyan1,2, GUO Mengmeng1,2, ZHAO Chunxia1,2, TAN Zhijun1,2*,GU Haifeng3, ZHAI Yuxiu1,2, LU Lina1,2
(1. Key Laboratory of Testing and Evaluation for Aquatic Product Safety and Quality, Ministry of Agriculture,China; Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071,China;2. Laboratory of Quality & Safety Risk Assessment for Aquatic Products (Qingdao),Ministry of Agriculture, Qingdao 266071, China; 3. Third Institute of Oceanography,State Oceanic Administration, Xiamen 361000, China)
Abstract:A liquid chromatography-tandem mass spectrometry method was developed for the analysis of azaspiracids and their metabolites. Both target metabolites and non-objective compounds detection methods were investigated, and the secondary mass spectra were compared with the standard spectra libraries to achieve high precision qualitative analysis. As a result, 11 metabolites including AZA-2, 3, 6, 11, 12, 16, 17, 28 and 36, as well as the glutathione conjugated metabolites of AZAs were analyzed in toxin-producing algae, accumulated samples of metabolic experiments and positive samples. Conventional metabolites were unbiased detected by target metabolites detection method, and showed a better response to low concentration metabolites. The method has excellent reproducibility, and is easy for operators. It can be used for the routine monitoring of AZAs.
Key words:liquid chromatography-tandem mass spectrometry (LC-MS/MS); azaspiracids (AZAs); metabolites; qualitative analysis
中图分类号:O658
文献标识码:A
文章编号:1000-8713(2016)04-0401-06
基金项目:国家自然科学基金项目(41106109);中央级基本科研业务费项目(20603022011004,20603022015017-2).
*收稿日期:2015-11-26
DOI:10.3724/SP.J.1123.2015.11043
*通讯联系人.Tel:(0532)85826348,E-mail:tanzj@ysfri.ac.cn.
Foundation item: National Natural Science Foundation of China (No. 41106109); Special Funds for the Basic R & D Program in the Central Non-Profit Research Institutes (Nos. 20603022011004, 20603022015017-2).
