叶酸与八聚精氨酸双修饰脂质体的制备及其功效观察
2016-05-12金亚香沈玉杰赵毅房学东吉林大学中日联谊医院长春30033长春职业技术学院
金亚香,沈玉杰,赵毅,房学东(吉林大学中日联谊医院,长春 30033; 长春职业技术学院)
叶酸与八聚精氨酸双修饰脂质体的制备及其功效观察
金亚香1,沈玉杰1,赵毅2,房学东1(1吉林大学中日联谊医院,长春 130033;2 长春职业技术学院)
摘要:目的制备叶酸与穿膜肽八聚精氨酸(R8)双修饰的脂质体,并观察其功效。方法采用注入法制备叶酸与穿膜肽R8双修饰的脂质体(FA-R8-LPs),采用激光粒度分析仪对脂质体粒径和电位进行测定,采用琼脂糖凝胶电泳方法考察脂质体与VEGF siRNA的结合度,分别采用流式细胞计数法、激光共聚焦显微镜观察及Western blotting法观察载有VEGF siRNA脂质体对口腔癌KB细胞的抗肿瘤效果。结果叶酸与穿膜肽R8双修饰的脂质体粒径为(112.5±3.7)nm,电位为(3.23±0.88)mV。FA-R8-LPs已基本完全与VEGF siRNA结合(FA-R8-LPs-siRNA)。FA-R8-LPs-siRNA对KB细胞的抑制率为44.5%,平均荧光强度值是未修饰脂质体的5倍左右。FA-R8-LPs与未修饰的脂质体相比明显提高了转染效率。结论成功制备了叶酸与穿膜肽R8双修饰的脂质体,该脂质体能增强VEGF siRNA的抗肿瘤效果。
关键词:叶酸;穿膜肽;八聚精氨酸;脂质体
目前,核酸类药物是治疗恶性肿瘤的有效手段,但其具有容易被核酸酶降解、与细胞膜相互排斥、跨膜能力弱等特点[1~3],高效率、低成本、低毒的药物载体是解决以上问题的关键。细胞穿膜肽又称蛋白转导域,具有携带比自身大100倍的物质穿透细胞膜进入细胞的能力。八聚精氨酸(R8)是由8个精氨酸组成的穿膜肽,能够穿过与之相接触的任何细胞的细胞膜,具有高效的穿膜作用,能够应用于核酸药物的传递过程[4,5]。叶酸是一种水溶性维生素,能特异性结合叶酸受体,是公认的对于肿瘤细胞具有靶向性的配体[6~8],将叶酸与R8两种配体结合,制备双修饰的脂质体,装载核酸类药物,以增强核酸类药物的抗肿瘤效果鲜有报道。本研究将叶酸和穿膜肽R8连接到脂质体的表面,制备双修饰的脂质体,并观察其功效。
1材料与方法
1.1仪器与试剂BP221S型电子天平(德国赛多利斯);Mastersizer 2000型激光粒度分析仪(英国马尔文仪器有限公司);710 LSMNLO型激光共聚焦显微镜(德国卡尔·蔡司公司股份公司);EPICS XL型流式细胞仪(美国Beckman Coulter公司);Synergy4型多功能酶标仪(美国BioTek公司)。R8 peptide(Cys-RRRRRRRR,成都凯捷生物科技有限公司);血管内皮生长因子(VEGF)siRNA和5′-Cy3-VEGF siRNA(百奥迈科有效公司);FA-PEG2000-DSPE(美国nanocs公司);蛋黄卵磷脂(EPC,广州汉方有限公司);胆固醇(北京鼎国昌盛生物技术有限责任公司);其他试剂均为分析纯。
1.2细胞KB细胞为人口腔表皮癌细胞株,使用含10%胎牛血清的DMEM培养基,并加入100 μg/mL、链霉素和100 U/mL青霉素,于37 ℃孵箱中培养,采用0.25%胰蛋白酶传代消化。
1.3脂质体的制备分别精密称取EPC、胆固醇、FA-PEG2000-DSPE适量溶于氯仿乙醇溶液(体积比为5∶1)中,超声使之溶解。将上述磷脂溶液按照1∶9的体积比注入到Hepes缓冲液中,形成脂质体溶液,将穿膜肽R8与磷脂摩尔比为3∶17的比例加入到上述脂质体溶液中,制备叶酸与R8双修饰的脂质体(FA-R8-LPs)。按照同样方法,分别制备R8修饰的脂质体(R8-LPs)、叶酸修饰的脂质体(FA-LPs)和空白无修饰脂质体(C-LPs)。为了获得载有VEGF siRNA的脂质体,首先将上述脂质体溶液过0.22 μm的滤膜除菌,将VEGF siRNA溶于焦碳酸二乙酯(DEPC)水中,将siRNA与脂质体溶液在无菌条件下混合均匀,使得siRNA的终浓度为0.5 mmol/L,将上述载药脂质体超声10 s,备用。分别取载有VEGF siRNA的上述脂质体100 μL,用超纯水稀释至1 mL,采用激光粒度分析仪对粒径和电位进行测定,每个样品平行测定3次。采用琼脂糖凝胶电泳方法考察脂质体与siRNA的结合度。首先制备琼脂糖凝胶,称取2 g琼脂糖溶于100 mL TAE缓冲液中,加热后冷却,保证没有气泡,加入10 μL溴化乙锭溶液,轻摇使其混匀,倒入电泳胶槽,待冷却后备用。制备脂质体与siRNA溶液,用DEPC水将各样品总体积补充到10 μL,每个样品加入2 μL上样缓冲液,加入上样槽中,保持电压在100 mV运行20 min。最后将琼脂糖胶放于紫外凝胶成像系统中分析。
1.4载有VEGF siRNA脂质体对KB细胞的作用①脂质体载体毒性检测:将KB细胞计数后,稀释至1×105/mL浓度,按每孔1×104个细胞接种于96孔培养板,每组设6个平行孔,置于CO2培养箱培养24 h。24 h后,弃培养液,PBS洗3遍,分别设立空白对照组和样品组,样品组中未载有siRNA的脂质体包括C-LPs、R8-LPs、FA-LPs和FA-R8-LPs,载有VEGF siRNA的脂质体组样品包括C-LPs-siRNA、R8-LPs-siRNA、FA-LPs-siRNA、FA-R8-LPs-siRNA,将上述样品分别加入96孔培养板,培养4 h。弃培养基,加入新鲜培养基,继续培养24 h后每孔加入10 μL的5 mg/mL的MTT溶液,置于CO2培养箱培养2 h,吸掉溶液后加入100 μL的DMSO,混匀后于540 nm处用酶标仪检测。②KB细胞对脂质体的摄取:a.采用流式细胞仪检测。将KB细胞用无叶酸培养基稀释至1×105/mL浓度,按每孔1×105个细胞接种于24孔培养板中,每组设3个平行孔,置于CO2培养箱培养24 h。24 h后制备不同的VEGF siRNA脂质体样品,其中VEGF siRNA采用5′-Cy3(红色荧光)进行标记。弃去培养液,PBS洗3遍,按顺序加入制备好的脂质体/siRNA体系样品,同时设计游离的siRNA(Naked siRNA)组,即未加入任何载体的siRNA组作为对照。分别置于CO2培养箱培养4 h后,消化细胞,离心后加入500 μL 4%的甲醛溶液固定,收集全部溶液置于流式细胞仪测定管中,样品可在4 ℃避光条件下保存,待用。b.采用激光共聚焦显微镜进行观察。转染过程同a,加入Naked siRNA和FA-R8-LPs-siRNA样品。转染结束后,吸出培养液,洗3次,加入4%的甲醛进行固定,洗去固定液。采用DAPI染色细胞核3 min,洗去染色液,再次用PBS洗3次,置于激光共聚焦显微镜下进行拍照。③KB细胞对脂质体的摄取机制:将KB细胞用无叶酸培养基稀释至1×105/mL浓度,按每孔1×105个细胞接种于24孔培养板中,培养24 h后加入不同的VEGF siRNA脂质体样品,同时加入蔗糖(网格蛋白介导的内吞作用抑制剂)、制霉菌素(细胞膜介导的的内吞作用)和细胞松弛素D(胞吞作用抑制剂)3种抑制剂与样品同时孵育4 h。采用流式细胞仪测定细胞的平均荧光强度,初步探索脂质体进入细胞的摄取机制[9]。④KB细胞VEGF蛋白检测:将KB细胞用无叶酸培养基稀释至1×105/mL浓度,按每孔2×105个细胞接种于6孔培养板中,培养24 h后加入不同的VEGF siRNA脂质体样品和无载体样品Naked siRNA,孵育4 h后加入胎牛血清,继续培养48 h后,采用细胞裂解液将KB细胞裂解,提取总蛋白,定量蛋白后,采用SDS电泳对蛋白进行分离,转膜后以GAPDH为内标,分别对GAPDH和VEGF蛋白进行一抗、二抗孵育,显影后观察蛋白下调效果。
2结果
FA-R8-LPs、R8-LPs、FA-LPs和C-LPs脂质体粒径和电位测定结果见表1。与Naked siRNA相比,4种脂质体均与siRNA呈现了不同程度的结合,其中FA-R8-LPs和R8-LPs与siRNA结合效果较好,已基本完全与siRNA结合,C-LPs和FA-LPs与siRNA的结合效果相对较差,siRNA的亮度较明显。
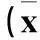
表1 4种脂质体粒径和电位比较±s)
注:与C-LPs脂质体比较,*P<0.01。
MTT检测结果显示,与空白对照组相比,C-LPs、R8-LPs、FA-LPs和FA-R8-LPs各脂质体对KB细胞无明显毒性,细胞存活率分别为98.545%、96.334%、97.546%、96.387%。与空白对照组相比,C-LPs-siRNA、R8-LPs-siRNA、FA-LPs-siRNA、FA-R8-LPs-siRNA对肿瘤细胞的抑制率分别为11.446%、25.666%、27.453%、44.527%,后三者与空白对照组比较,P均<0.01。流式细胞仪检测结果显示,与空白对照组和Naked siRNA相比,C-LPs-siRNA、R8-LPs-siRNA、FA-LPs-siRNA和FA-R8-LPs-siRNA均有明显的荧光迁移,其中迁移程度由大到小分别为FA-R8-LPs-siRNA、FA-LPs-siRNA、R8-LPs-siRNA和C-LPs-siRNA。C-LPs-siRNA、R8-LPs-siRNA、FA-LPs-siRNA和FA-R8-LPs-siRNA的平均荧光强度值分别为4.533±0.802、8.467±1.050、11.467±1.504、20.400±2.326,高于空白对照组(0.367±0.058)和Naked siRNA组(2.500±0.854),P均<0.01。激光共聚焦显微镜观察发现,FA-R8-LPs-siRNA较Naked siRNA将大量siRNA转染进入到KB细胞内,使得肿瘤细胞的荧光强度明显增强。
与无抑制剂相比,制霉菌素和细胞松弛素D处理的KB细胞荧光强度值未见明显变化,而蔗糖作为抑制剂显著降低了KB细胞的平均荧光强度,见表2。与空白对照组相比,Naked siRNA、C-LPs-siRNA、R8-LPs-siRNA、FA-LPs-siRNA和FA-R8-LPs-siRNA均对VEGF蛋白有一定的抑制效果(P均<0.01),VEGF蛋白相对下调量分别为11.68%、23.69%、57.77%、54.10%、60.86%。
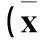
表2 3种抑制剂处理的KB细胞荧光强度比较±s)
注:与无抑制剂相比,*P<0.01。
3讨论
VEGF是最有效的促血管生长因子,对肿瘤新生血管形成及肿瘤生长和转移起重要作用[10~12]。以VEGF及其受体为靶点,抑制肿瘤的发生与发展是抗癌药物研究的热点。本研究制备了叶酸与穿膜肽R8双修饰的脂质体,同时对一种VEGF siRNA进行装载,对其功效进行了系统的评价,同时对转染机制进行了初步考察。希望通过该载体高效地将VEGF siRNA转染进入到肿瘤细胞,发生RNA干扰[13]现象,降低VEGF的表达,导致肿瘤细胞发生凋亡或死亡的现象,提高抗肿瘤效果。
首先,为了评价制备脂质体的性质是否适用于进入到肿瘤部位,对制备的几种脂质体进行粒径和电位进行评价,双修饰脂质体粒径为(112.5±3.7)nm,粒径有利于载体在肿瘤部位的富集,同时具有较强的正电荷,因此利于与带负电荷的siRNA结合,转染进入细胞,进而发挥抗肿瘤功效。脂质体与siRNA结合度考察结果显示,双修饰的脂质体能够较好地与siRNA结合,进而有利于进入肿瘤细胞,而叶酸单修饰的脂质体与siRNA的结合能力较弱,可能由于与siRNA产生了阴离子竞争。
MTT实验结果显示,双修饰后的脂质体载体能够较高效率地将siRNA转染进入肿瘤细胞,导致细胞出现凋亡或者死亡现象,肿瘤细胞生长抑制率明显上升,而未载药的脂质体无明显毒性,表明脂质体载体安全可靠。流式细胞仪检测、激光共聚焦显微镜观察KB细胞对脂质体的摄取实验中,双修饰的脂质体进入肿瘤细胞明显,直观地反映了制备的载体能够将VEGF siRNA装载进入肿瘤细胞,释放核酸药物,进而实现抗肿瘤效果。同时采用了Western blotting实验对肿瘤细胞的VEGF蛋白进行测定,发现采用双修饰脂质体装载siRNA对肿瘤细胞的VEGF蛋白起到明显下调效果,这也是导致MTT实验中细胞出现凋亡或死亡现象的主要原因。
为了对本研究制备的体系进入肿瘤细胞的过程进行探讨,进行了细胞内吞机制的初步研究,可初步判断,脂质体的摄取可能是通过网格蛋白介导的内吞作用。这也为今后对于该载体的进一步体内研究提供了一定的参考和依据。
参考文献:
[1] Avolio TM, Lee Y, Feng N, et al. RNA interference targeting the R2 subunit of ribonucleotide reductase inhibits growth of tumor cells in vitro and in vivo[J]. Anticancer Drugs, 2007,18(4):377-388.
[2] Lee M, Kim SW. Polyethylene glycol-conjugated copolymers for plasmid DNA delivery[J]. Pharm Res, 2005,22(1):1-10.
[3] Yan Y, Johnston AP, Dodds SJ, et al. Uptake and intracellular fate of disulfide-bonded polymer hydrogel capsules for Doxorubicin delivery to colorectal cancer cells[J]. ACS Nano, 2010,4(5):2928-2936.
[4] 何笑冬,舒小镭,李少林.双功能RGD-R8修饰阿霉素脂质体的制备及其体外评价[J].第三军医大学学报,2014,36(20):2103-2106.
[5] 张楠,白银,赵景状,等.多聚精氨酸融合增强型绿色荧光蛋白制备方法及穿膜效果[J].生物工程学报,2013,29(11):1644-1653.
[6] 张奇,张友九,杨科亚,等.叶酸受体阳性肿瘤细胞对Folate-PGA偶联酶的特异性结合[J].中国药理学通报,2007,23(6):746-750.
[7] 闫颖,齐宪荣.以叶酸受体为靶向的阳离子脂质体的制备与性质考察[J].药学学报,2008,43(11):1134-1139.
[8] 赵洁,夏亚丹,刘艳艳.叶酸偶联白蛋白纳米粒的应用研究进展[J].山东医药,2015,55(22):97-99.
[9] Zhang Y, Zhou C, Kwak KJ, et al. Efficient siRNA delivery using a polyamidoamine dendrimer with a modified pentaerythritol core[J]. Pharm Res, 2012,29(6):1627-1636.
[10] 杨辉,徐笑红.靶向VEGF-C的siRNA表达载体对人乳腺癌细胞VEGF-C基因表达的影响[J].中国现代医生,2015,53(10):1-3.
[11] 黄秋林,刘璇,阳勇,等.靶向肝癌HepG2细胞VEGF基因siRNA表达载体裸鼠成瘤抑制作用[J].中国现代医药杂志,2013,23(14):18-19.
[12] Takahashi S. Vascular endothelial growth factor (VEGF), VEGF receptors and their inhibitors for antiangiogenic tumor therapy[J]. Biol Pharm Bull, 2011,34(12):1785-1788.
[13] Morille M, Passirani C, Vonarbourg A, et al. Progress in developing cationic vectors for non-viral systemic gene therapy against cancer[J]. Biomaterials, 2008,29:3477-3496.
(收稿日期:2015-08-27)
中图分类号:R318
文献标志码:A
文章编号:1002-266X(2016)11-0038-03
doi:10.3969/j.issn.1002-266X.2016.11.014
通信作者:房学东(E-mail: fangxdooo@sina.com)
