蟾衣提取物对大鼠佐剂性关节炎的治疗作用
2016-05-12陈锡赟王恒余跃生陈燕贺勇张玲敏许键炜黔南民族医学高等专科学校药理学教研室贵州都匀558003贵州医科大学药理学教研室3贵州医科大学组织工程与干细胞实验中心
陈锡赟,王恒,余跃生,陈燕,贺勇,张玲敏,许键炜,3 (黔南民族医学高等专科学校药理学教研室,贵州都匀 558003;贵州医科大学药理学教研室;3贵州医科大学组织工程与干细胞实验中心)
蟾衣提取物对大鼠佐剂性关节炎的治疗作用
陈锡赟1,王恒1,余跃生1,陈燕2,贺勇2,张玲敏2,许键炜2,3(1黔南民族医学高等专科学校药理学教研室,贵州都匀 558003;2贵州医科大学药理学教研室;3贵州医科大学组织工程与干细胞实验中心)
摘要:目的 观察蟾衣提取物对大鼠佐剂性关节炎(AA)的治疗作用。方法将60只SD大鼠随机分为治疗组、模型组和对照组各20只。模型组和治疗组于每只大鼠右后足跖皮内一次性注射0.1 mL 弗氏完全佐剂,对照组注射等量的生理盐水。治疗组造模3周后按2 mL/kg腹腔注射蟾衣提取物,1次/d,连续给药3周,模型组和对照组腹腔注射等量生理盐水。在造模当天及造模后第1、2、3、4、5、6、7周分别测量大鼠体质量、左右后爪体积,各组大鼠在治疗第4周后行四肢关节X线摄片检查及四肢关节病理检查,观察大鼠不良反应发生情况。结果与对照组相比,模型组造模后3、4、5、6、7周左、右后爪体积大(P均<0.05)。与模型组相比,治疗组造模后5、6、7周左、右后爪体积小(P均<0.05)。X线检查结果显示,治疗组大鼠后肢爪关节与对照组相似,较模型组骨质疏松、骨质破坏明显修复,关节面光滑,周围软组织影增厚减轻。HE染色结果显示,治疗组足趾关节面较光滑,增生不明显,炎症细胞浸润明显减轻,关节间隙出现,边缘骨质破坏不明显,与对照组相似。各组大鼠未见明显不良反应。结论蟾衣提取物可有效减轻并修复大鼠AA所致的损伤。
关键词:蟾衣提取物;佐剂性关节炎;类风湿性关节炎;实验动物模型
目前,类风湿性关节炎(RA)[1~3]采用的非甾体类抗炎药治疗仅能使患者的症状得到一定缓解,但不能有效地阻断RA的发生发展,而且长期使用该类药物还会出现一系列不可避免的不良反应。因此,寻找疗效更好、副作用更少的药物成为医药工作者追求的目标。一些中药、民族药在治疗RA方面有独特的优势。蟾衣,又称蟾蜕,含蟾蜍二烯醇化合物,包括蟾蜍毒素、蟾蜍内酯类、蟾毒配质等[4,5]。近年来研究[6,7]发现,蟾衣中所含的蟾毒内酯、蟾毒素等有解毒、消肿、止痛、抗菌、抗病毒、抗肿瘤、抗辐射以及调节免疫、调节内分泌等作用,能有效改善人体内环境,促进人体代谢平衡。弗氏完全佐剂(FCA)是由抗原水溶液与石蜡油、羊毛脂和分枝杆菌按一定比例混合成的强免疫制剂,采用FCA可建立与临床RA类似的动物疾病模型[8]。本研究采用蟾衣提取物治疗FCA诱导的佐剂性关节炎(AA)大鼠,为临床RA的治疗提供实验理论基础。
1材料与方法
1.1实验动物及仪器Sprague Dawley(SD)大鼠60只,雌雄各半,5周龄,体质量(100±20)g,由第三军医大学大坪医院动物中心提供,贵阳医学院实验动物中心代购,合格证号:SCXK(军)2012-0011。蟾衣由贵州省开阳县龙岗镇立京村蟾蜍养殖户董英奎友情馈赠;FCA(美国Sigma公司);水浴锅(泰斯特DK-98-HA型四孔,天津市泰斯特仪器有限公司);旋转蒸发仪(EYELA OSB-2100型,东京理化);2100型数字式口腔X线机(法国Kodak公司)。
1.2蟾衣提取物的制备参照文献[9]并加以改进,将干燥的蟾衣粗粉200 g,以10倍量95%乙醇回流提取3次,每次1 h,过滤,合并滤液,减压回收溶剂,静置,析出沉淀,过滤,滤液浓缩得到浸膏2.28 g,得率为1.14%。
1.3AA大鼠模型的制备及蟾衣提取物用法所有大鼠适应性饲养2 d后,按照随机数字表法将大鼠分为治疗组、模型组和对照组各20只。医用酒精棉球局部消毒,模型组和治疗组于每只大鼠右后足跖皮内一次性注射0.1 mL FCA[3],对照组注射等量的生理盐水。治疗组造模3周后即第21天,按2 mL/kg腹腔注射蟾衣提取物(以1%浓度溶于生理盐水),1次/d,固定注射时间点,连续给药3周。模型组和对照组腹腔注射等量生理盐水。
1.4观察方法观察各组大鼠的生命体征。在造模当天及造模后第1、2、3、4、5、6、7周分别测量大鼠体质量、左右后爪体积。爪体积的测量采用排水法,即用一特制量筒,灌满水后,将大鼠爪插入,以大鼠踝关节突出部位作为标记,使其处于水平面,用一烧杯收集测量从量筒侧口排出的水量(mL),即为所测大鼠爪的体积[10]。各组大鼠在治疗第4周后,腹腔注射10%水合氯醛3 mL/kg麻醉后行四肢关节X线摄片检查(采用口腔科移动式牙片X光机,电压、电流与曝光时间分别设定在60 kV、7 mA和0.10 ms)[10],之后颈椎脱臼法处死大鼠,行四肢关节病理检查。治疗前后全程观察大鼠不良反应发生情况。
2结果
各组大鼠在实验过程中生命体征平稳,造模后大鼠活动、食量较造模前以及正常组减少,毛色晦暗,关节肿胀逐渐加重,各组大鼠体质量、左右后爪体积比较见表1~3。影像学检查发现,模型组大鼠后肢足趾关节骨端出现骨质疏松,有锯齿状改变,关节面模糊,边缘骨质破坏;关节间隙狭窄,周围软组织肿胀;治疗组大鼠后肢足趾关节与对照组相似,较模型组骨质疏松、骨质破坏明显修复,关节面光滑,周围软组织影增厚减轻。病理切片HE染色显示,模型组大鼠关节滑膜明显增生,滑膜内有大量炎症细胞浸润,局部侵蚀到软骨中,腔隙消失,甚至纤维化;治疗组足趾关节面较光滑,增生不明显,炎症细胞浸润明显减轻,出现关节间隙,边缘骨质破坏不明显,与对照组相似。各组大鼠未见明显不良反应。
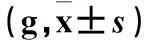
表1 各组大鼠体质量比较
注:与模型组比较,*P<0.05。

表2 各组大鼠右后爪体积比较±s)
注:与模型组比较,*P<0.05。

表3 各组大鼠左后爪体积比较
注:与模型组比较,*P<0.05。
3讨论
RA所致的关节破坏诱发的关节疼痛、晨僵以及很高的致残率严重影响人类的健康和生活质量。传统的西医治疗多数仅能缓解症状,而难以治愈。且有部分复发性、难治性RA患者对传统治疗反应差,临床疗效不满意。而长期病情活动的后果则是失去劳动能力和缩短生存期[2]。
RA的发病机制尚不十分明确,可能与免疫功能紊乱所致的自身免疫性炎症相关。虽然没有确认引发RA的具体抗原,但多种内、外源性抗原可能均不同程度参与了RA的发生。关节组织损伤和细胞凋亡释放的自身抗原未被免疫系统适应,进而被产生的特异性抗体结合。RA存在着促炎细胞因子和抑炎细胞因子的失衡。RA患者的关节中存在大量CD4+T细胞的浸润,分泌的细胞因子如TNF-α诱导内皮细胞表达黏附分子,促进白细胞在血管内皮的黏附渗透,同时局部成纤维细胞生长因子的释放促进了血管翳的形成;另外还可促使巨噬细胞、软骨细胞以及纤维母细胞等产生IL-1、IL-6、IL-8、IL-15、基质细胞衍生因子1等诱发炎症反应,并进一步促进了淋巴细胞由血管内向滑膜的迁入、活化,软骨细胞、滑膜母细胞分泌的前列腺素E2和胶原酶还能增强肿瘤坏死因子α(TNF-α)、IL-1的效应,参与RA的发生发展过程,加重组织损伤[11,12]。自身反应性B细胞也参与RA的发生。B细胞被激活后,产生类风湿因子、IL-6和TNF-α,还可诱导其向浆细胞分化,参与RA的发病[13,14]。蟾衣中的活性物质可下调炎症相关转录因子NF-κB核转位,抑制NF-κB激活,进而抑制上述各种炎症介质来发挥抗炎作用[5]。
中医认为RA属痹症,体虚感邪、风寒湿邪是发生本病的内、外因素,经络痹阻是主要病机[15]。蟾衣性凉,味辛,有微毒,具有扶正固本、攻坚破瘀、消肿祛癌等作用[16],能有效增强人体体质和免疫功能,促进生命代谢自然平衡,可用于包括各种炎症及肿瘤在内的许多疾病的治疗[4]。本研究选用贵州纯天然无污染饲养环境中获得的一级蟾衣提取物腹腔注射治疗与人RA类似的大鼠AA,此给药途径能尽可能避免首关消除效应带来的生物利用度下降,最大程度地发挥药效。最终本实验证实蟾衣提取物能有效抑制AA大鼠的病情进展,修复病损组织,这将为自身免疫性疾病乃至其他疾病的治疗提供新的思路。
参考文献:
[1] Tugnet N, Cooper S, Douglas K. Methotrexate therapy,rheumatoid arthritis,and life-threatening liver complications:should we be monitoring more closely[J]. Scand J Rheumatol, 2012,41(2):163-164.
[2] Kahlenberg JM, Fox DA. Advances in the medical treatment of rheumatoid arthritis[J]. Hand Clin, 2011,27(1):11-20.
[3] 缪成贵,黄成,黄艳,等.wnt调控类风湿性关节炎研究进展[J].中国药理学通报,2013,29(2):149-153.
[4] 杨立新,赵海誉,袁圣芬,等.华蟾素注射液中总蟾毒配基类成分的含量测定[J].中国实验方剂学杂志,2013,19(6):87-89.
[5] 王元清,严建业,喻林华.蟾皮的化学成分与临床应用研究进展[J].时珍国医国药,2009,20(5):1213-1214.
[6] 温丽丽,谢显彪,黄婉,等.蟾毒灵抗炎镇痛作用及其对NF-κB信号通路的影响[J].中山大学学报(医学科学版),2014,35(5):680-684.
[7] 孙康,秦建民.蟾毒灵诱导肝癌细胞凋亡机制的研究及意义[J].肝胆外科杂志,2014,22(5):396-398.
[8] 马玉琛,段斐,孟明,等.改良弗氏完全佐剂制备大鼠类风湿性关节炎模型[J].现代预防医学,2008,35(10):1989-1991.
[9] 缪珠雷,杨鸣泽,张康,等.不同采收法对蟾衣水溶性和脂溶性浸出物含量的影响和比较[J].中国实用医药,2012,7(27):14-15.
[10] 许键炜,舒莉萍,申长清,等.骨髓间充质干细胞上清液对大鼠佐剂性关节炎防治作用的实验研究[J].中国现代医学杂志,2013,23(14):5-10.
[11] 陈俊伟,张少然,闫成兰,等.T辅助细胞亚型细胞相关因子在类风湿性关节炎发病中的作用[J].中国药物与临床杂志,2012,12(4):420-423.
[12] 尹纪伟,赵福涛.间充质干细胞在类风湿性关节炎中的研究进展[J].医学综述,2011,17(5):644-646.
[13] 吕社民,孟列素,朱文华.Toll样受体参与类风湿性关节炎发病机制的研究进展[J].西安交通大学学报(医学版),2014,35(4):423-428.
[14] Rudnicka W, Burakowski T, Warnawin E, et al. Functional TLR9 modulates bone marrow B cells from rheumatoid arthritis patients[J]. Eur J Immunol, 2009,39(5):1211-1220.
[15] 刘旭.中医辨证治疗类风湿性关节炎的临床观察[J].中国当代医药,2012,19(24):120-121.
[16] 李锦开.中国基本药材[M].北京:中国医药科技出版社,2013:507-509.
(收稿日期:2015-11-12)
中图分类号:R593.22
文献标志码:A
文章编号:1002-266X(2016)11-0030-03
doi:10.3969/j.issn.1002-266X.2016.11.011
通信作者:许键炜(E-mail: 363912577@qq.com)
基金项目:贵州省中医药管理局中医药、民族医药科学技术研究课题计划(QZYY2013-91);黔南医专科研基金项目(QNYZ201412)。
