CYP3A4* 1G基因多态性与紫杉醇不良反应的关系①
2016-05-11季方茹宋元清雷力力沈庆明荆洪英
季方茹,宋元清,雷力力,沈庆明,荆洪英
(1.佳木斯大学附属第一医院药剂科,黑龙江佳木斯154003;2.鸡西市人民医院药剂科,黑龙江鸡西158100)
CYP3A4* 1G基因多态性与紫杉醇不良反应的关系①
季方茹1,宋元清2,雷力力1,沈庆明1,荆洪英1
(1.佳木斯大学附属第一医院药剂科,黑龙江佳木斯154003;2.鸡西市人民医院药剂科,黑龙江鸡西158100)
摘要:目的:观察分析CYP3A4* 1G基因多态性与紫杉醇不良反应发生率的关系。方法:选择2013-01~2015-09经病理或细胞学检查确诊为乳腺癌130个病例作为入选试验对象,检测其CYP3A4* 1G基因型并观察、收集、记录其不良反应发生情况,分析患者的不良反应发生和基因多态性的相关性。结果: CYP3A4* 1G基因多态性与紫杉醇不良反应发生率没有统计学差异。结论: CYP3A4* 1G基因多态性与紫杉醇不良反应发生率没有关联。
关键词:CYP3A4* 1G ;基因多态性;紫杉醇;不良反应
近年来随着药物基因组学的发展,药物基因多态性与药物疗效和不良反应的关系越来越被重视,相关的研究也很多,很多研究成果已被批准应用到临床中,对指导临床合理用药,达到精准医疗起了很重要的作用。在细胞色素P450酶(CYP)的研究中,CYP1B1和CYP3A4作为新的药物靶点日益受到关注[1]。基于CYP1B1和CYP3A4在多种肿瘤组织中(前列腺、结直肠等)[2]特异性高表达,而在相应的正常组织中不表达这一特点,认为CYP1B1和CYP3A4为一个抗癌治疗、耐药逆转的新靶点。紫杉醇是目前治疗卵巢癌、非小细胞肺癌、乳腺癌的有效药物。然而,与其他抗肿瘤药物一样,由于紫杉醇的骨髓抑制作用、心血管毒性、神经毒性、肝脏毒性及胃肠道反应等不良反应个体差异的存在,在一定程度上限制了它的应用。笔者对我院肿瘤科应用紫杉醇注射液治疗乳腺癌的130例患者,进行了基因型检测和其不良反应观察、收集、统计和分析,研究二者的关联性,为临床医生使用紫杉醇时减少不良反应的发生提供依据。
1 仪器与材料
1.1仪器
Thermo公司微量移液器;日本岛津公司AUW220D电子分析天平;美国Bio-Rad公司S1000 Thermal Cycler PCR仪、PowerPac Universal通用型电泳仪、ChemiDoc XRS凝胶成像系统;上海沪誉贸易有限公司H2500R-2高速冷冻离心机。
1.2试药
Fermentas公司生产的Genomic DNA Purification Kit、Star pcr Taq、100 bp DNA Ladder、Oli I内切酶。CYP3A4* 1G扩增引物由生工生物工程(上海)股份有限公司合成,DNA测序由生工生物工程(上海)股份有限公司北京测序部完成。紫杉醇注射液: 5mL: 30mg哈药集团生物工程有限公司生产。
1.3研究对象、血样采集方法及给药方法
选择经病理或细胞学检查确诊为乳腺癌的病例作为入选试验对象,预计生存期不少于6个月,1个月内未用任何药物作过抗肿瘤治疗,血常规及肝、肾功能、心电图相关检查正常者。检测CYP3A4* 1G位点基因型,根据基因型将患者分为CC型(野生纯合子) ; CT + TT型(杂合子+突变纯合子) 2组,然后按患者体表面积计算每个患者静脉输注紫衫醇注射液的剂量(175mg/m2),入选的患者不再同时使用其他抗肿瘤药。给药方法:用紫杉醇前30min静脉滴注地塞米松注射液20mg,及雷尼替丁200mg,同时肌注50mg异丙嗪,紫杉醇注射液用专用输液管静脉滴入,时间不少于3h,每3周一次。每一疗程4次。
2 方法
2.1 CYP3A4* 1G基因检测
上游引物5'...AATAGAAAGCAGATGAACCAGAGCC...3',下游引物5'...CACCCTGATGTCCAGCAGAAACT...3'; PCR组分及条件: Maxima Hot Start Green PCR Master Mix (2X) 12.5μL,上、下游引物各1μL,模板DNA 1μL,双蒸水9.5μL; 94℃预变性4min,94℃变性30s,54℃退火30s,72℃延伸30s,35个循环后,72℃延伸5min。酶切及电泳: 10 ×green buffer 2μL,PCR产物10μL,Rsa I内切酶1.0μL,双蒸水17μL;水浴37℃,酶切5 min,水浴65℃,灭活5min。使用2.0%琼脂糖凝胶电泳30min,电压140V。
PCR扩增产物片段长度为287bp。限制性内切酶RsaI酶切后判断基因型,当出现215和72bp两个片段时为CC纯合子型,当出现287,215和72bp三条片段时为CT型杂合子,当只有287bp一条片段时为TT型纯合子。检测结果经焦磷酸测序方法验证。
2.2不良反应观察时限
第一次用药开始至疗程结束后15d。
2.3不良反应判断标准
依据我国国家药物不良反应监测中心采用的判断方法[3]
3 结果
3.1基因测序结果
按2.1方法进行试验并经焦磷酸测序验证,两种方法检测结果,两者完全相符。CYP3A4* 1G扩增酶切见图1,焦磷酸测序见图2。

M为50bp DNA Marker; 1、2、8、9泳道为CC型野生纯合子,4、5、6泳道为CT型杂合子,3、7泳道为TT型突变纯合子。图1 CYP3A4* 1G扩增酶切后电泳结果图
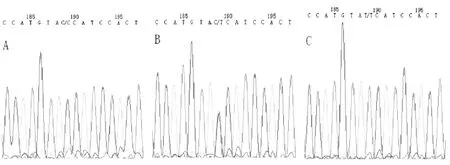
图A、B、C分别为CC、CT、TT基因型,突变位点在189位图2 CYP3A4* 1G 3种基因型毛细管电泳测序图
3.2基因型分布与不良反应
2013-01~2015-09共收集符合要求的作紫杉醇化疗的乳腺癌患者血样130例,经检测,CC型59例,CT型65例,TT型6例,由于TT基因型例数太少,因而将CT型与TT型合并计算,其基因型分布及不良反应情况经卡方检验见表1。

表1 CYP3A4* 1G基因多态性与紫杉醇不良反应关系发生率
由表1可见,两组不良反应差异没有显著性(P>0.05)。
4 讨论
我国的乳腺癌患者逐年上升,如何在化疗时减少不良反应的发生是医生和药师的责任。有文献报道紫杉醇血药浓度与肿瘤治疗效果及不良反应有关[4]。而CYP3A4* 1G基因多态性与紫杉醇药物代谢无关[5]。本研究显示CYP3A4* 1G基因多态性与紫杉醇的不良反应也无关。因此我们应从其他方面研究个体血药浓度与肿瘤治疗效果及不良反应的关系,通过其他措施的应用来探讨和减少不良反应的发生,比如可以进一步探讨用紫杉醇注射液之前,用止吐药与减轻患者的不良反应的关系,以此来降低不良反应的发生率、提高患者的生存质量,延长生存期。
参考文献:
[1]肖昌琼,周宏濒.细胞色素P450药物氧化酶基因多态性与乳腺癌易感性研究进展[J].中国肿瘤,2009,18(1) : 38
[2]Maria P,Elisa G,Aldo C,et al.Cytochrome 450 1B1 (CYP1B1) polymorphisms associated with response to docetaxel in Castration-resistant prostate cancer (CRPC) patients[J].BMC Cancer,2010 (10) : 511
[3]李俊主编.临床药理学[M].北京:人民卫生出版社,2013: 150
[4]刘加涛,孙国平,陈小欢,等.紫杉醇用于非小细胞肺癌的药代动力学与疗效、毒性反应的关系研究[J].安徽医药,2012,16(9) : 1253
[5]荆洪英,国玉芝.CYP3A4* 1G基因多态性与紫杉醇血药浓度的关系研究[J].中国药房,2015,26(8) : 1063-1065
(收稿日期:2015-12-17)
通讯作者:荆洪英(1965~)女,黑龙江鸡西人,硕士,主任药师,硕士研究生导师。E-mail : Wjinghongying@126.com
作者简介:季方茹(1963~)女,黑龙江望奎人,学士,主管药师。
基金项目:①2013年度黑龙江省教育厅科学技术研究项目,编号: 12531683。
中图分类号:R285
文献标识码:A
文章编号:1008-0104(2016) 02-0007-02
