大黄游离蒽醌对重症急性胰腺炎大鼠肠道免疫功能的影响及其作用机制
2016-05-10陈立范玲谭小勇王璐璐刘媛琪熊玉霞
陈立,范玲,谭小勇,王璐璐,刘媛琪,熊玉霞
(四川医科大学药学院,四川泸州646000)
大黄游离蒽醌对重症急性胰腺炎大鼠肠道免疫功能的影响及其作用机制
陈立,范玲,谭小勇,王璐璐,刘媛琪,熊玉霞
(四川医科大学药学院,四川泸州646000)
目的 观察大黄游离蒽醌对重症急性胰腺炎(SAP)大鼠肠道免疫功能的影响,并探讨其作用机制。方法 将24只健康雄性SD大鼠随机分为假手术组、模型组、大黄游离蒽醌组及生大黄水煎液组,每组6只。模型组、大黄游离蒽醌组及生大黄水煎液组经胰胆管逆行注射牛磺胆酸钠制作SAP模型,假手术组经胰胆管逆行注射等量灭菌生理盐水。大黄游离蒽醌组、生大黄水煎液组建模前12 h及建模2 h分别给予大黄游离蒽醌200 mg/kg和生大黄水煎液6.6 g/kg灌胃,假手术组、模型组不予处理。建模24 h,取各组肠系膜淋巴结(MLN),采用HE染色法观察MLN组织病理形态变化,ELISA法检测MLN组织匀浆上清液TNF-α、IL-1,免疫荧光法检测核苷酸结合寡聚化结构域样模式识别受体(NLRP3)、凋亡相关斑点样蛋白(ASC)表达,流式细胞仪检测CD4+、CD4+CD25+Foxp3+细胞及Th1、Th2细胞数量,计算Treg比例、Th1/Th2。结果 与假手术组比较,模型组淋巴小结增大,皮质区增厚,皮质区淋巴小结数量增加;与模型组比较,大黄游离蒽醌组、生大黄水煎液组皮质区淋巴小结数量少、体积小;大黄游离蒽醌组、生大黄水煎液组淋巴小结大小相当。TNF-α、IL-1和NLRP3、ASC水平:模型组明显高于假手术组(P<0.05),游离蒽醌组及生大黄组明显低于模型组(P<0.05)。CD4+CD25+Foxp3+、CD4+、Treg比例:模型组明显高于假手术组(P均<0.05),除大黄游黄蒽醌组CD4+外,大黄游离蒽醌组、生大黄水煎液组均明显低于模型组(P均<0.05)。Th1、Th2及Th1/Th2:模型组Th1、Th1/Th2均高于假手术组(P均<0.05),Th2低于假手术组(P<0.05);大黄游离蒽醌组、生大黄水煎液组Th1、Th1/Th2较模型组均明显降低(P均<0.05),而Th2较模型组明显升高(P<0.05)。大黄游离蒽醌组、生大黄水煎液组上述各检测指标比较差异均无统计学意义(P均>0.05)。结论 大黄游离蒽醌能减轻SAP大鼠肠道的免疫炎性反应,其效果与生大黄水煎液相当;其机制可能是通过抑制炎性小体的表达和调节Th1/Th2失衡,干预SAP早期的免疫过激反应,继而调节机体的免疫平衡。
急性胰腺炎;肠道免疫;大黄游离蒽醌;大鼠
重症急性胰腺炎(SAP)发病机制复杂,病情凶险,可引发多器官功能衰竭[1]。肠道是SAP发生应激反应的中心器官,炎性细胞因子“瀑布样”释放是病情加剧的关键环节。目前对炎性细胞因子调控的研究多集中于肠黏膜免疫,对肠黏膜周围免疫器官——肠系膜淋巴结(MLN)免疫功能状态及其对炎性细胞因子调控的研究较少。大黄及其复方制剂治疗SAP已得到广泛认可,但由于其成分复杂、口感差、用量大且无统一标准等使其临床应用受到限制[2]。本课题组前期研究发现,大黄游离蒽醌对SAP所致的多器官损伤具有一定治疗作用,但其能否改善SAP患者MLN免疫功能状态尚不明确。2014~2015年,我们观察了大黄游离蒽醌对SAP大鼠肠道免疫功能的影响,旨在为其临床治疗SAP提供依据。
1 材料与方法
1.1 材料 SPF级、雄性SD大鼠24只,6周龄,体质量(200±20)g,由四川医科大学实验动物中心提供,许可证号:SCXK(川)2013-17。VERSE流式细胞仪,美国BD公司;EVOS fl无目镜荧光倒置显微镜,美国Life Technologies公司;伯乐680酶标检测仪,美国Bio-Rad公司。大黄游离蒽醌,淮安市巍伟植化研究所,游离蒽醌含量≥50%;抗大鼠APC-CD4、PE-CD25、FITC-Foxp3、FITC-IFN-γ、PE-IL-4抗体,美国BioLegend公司;牛胆酸钠,美国Sigma公司;核苷酸结合寡聚化结构域样模式识别受体(NLRP3)、凋亡相关斑点样蛋白(ASC)抗体,美国Santa Cruz公司;FITC-抗兔IgG、TRITC-抗山羊IgG抗体,北京中杉金桥生物技术有限公司;TNF-α、IL-1试剂盒,美国RD公司。
1.2 模型制备及干预 所有大鼠适应性饲养1周,试验前禁食12 h、不禁水。随机将大鼠分为假手术组、模型组、大黄游离蒽醌组、生大黄水煎液组,每组6只。模型组、大黄游离蒽醌组、生大黄水煎液组经胰胆管逆行注射牛磺胆酸钠制作SAP模型。大黄游离蒽醌组、生大黄水煎液组建模前12 h及建模2 h分别给予大黄游离蒽醌200 mg/kg和生大黄水煎液6.6 g/kg灌胃。假手术组经胰胆管逆行注射等量灭菌生理盐水。假手术组、模型组不予任何处理。各组建模24 h开腹采集MLN组织。
1.3 相关指标观察
1.3.1 MLN组织病理形态 各组均取部分MLN组织,10%多聚甲醛固定,常规石蜡包埋,5 μm厚切片,脱蜡,HE染色。光镜下观察MLN组织病理形态变化。
1.3.2 MLN组织匀浆上清液TNF-α、IL-1 取MLN组织约0.2 g,按质量/容积1∶10加入冰生理盐水,冰上充分匀浆,4 ℃ 3 000 r/min离心10 min,取上清液,制成10%组织匀浆。采用ELISA法检测匀浆上清液TNF-α、IL-1。
1.3.3 MLN组织NLRP3和ASC表达 采用免疫荧光法。取MLN组织切片,65 ℃烘片2 h,二甲苯脱蜡,乙醇梯度水化,3% H2O2去内源性酶。将切片置于枸橼酸溶液中高温修复,自然冷却至室温,滴加0.3% TritonX-100打孔,5% BSA封闭。滴加一抗,4 ℃过夜。次日复温,滴加荧光二抗,37 ℃避光孵育,甘油封片,上机拍照。NLRP3阳性表达呈绿色,ASC阳性表达呈红色。光镜(×400)下每张切片选取10个视野,计数NLRP3、ASC阳性细胞数量。
1.3.4 MLN组织 Treg细胞比例 采用流式细胞仪检测。取MLN组织约0.2 g,制备单细胞悬液,1 000 r/min离心5 min,去上清。加入完全培养基重悬MLN细胞,调整细胞密度为1×106/mL,置于1.5 mL离心管中,每管100 μL;分别对应加入5 μL CD4抗体和5 μL CD25抗体,避光孵育20 min,PBS重悬,离心去上清,破膜液重悬;分别加入Foxp3抗体5 μL,室温避光孵育30 min,PBS洗涤2次,加300 μL PBS混匀,上机检测。选定CD4+T细胞群,将CD4+CD25+Foxp3+标记为阳性细胞,以CD4+CD25+Foxp3+细胞占CD4+T细胞的比例作为Treg比例。
1.3.5 MLN组织Th1、Th2及Th1/Th2 采用流式细胞仪检测。取MLN组织约0.2 g,制备单细胞悬液,置于2个1.5 mL离心管中,每管100 μL;每管加入2 μL莫能霉素,5% CO2、37 ℃培养箱孵育5 h,350 g离心5 min,去上清;加入2 mL PBS,350 g离心5 min,去上清。分别加入相应的表面标记抗体CD4 5 μL,混匀,室温避光孵育15 min。PBS重悬,离心去上清。固定液固定,混匀,室温避光孵育,离心去上清。PBS重悬,4 ℃避光保存。次日离心去上清。破膜液重悬,离心去上清。分别加入5 μL IL-4和20 μL IFN-γ,避光室温孵育20 min。用PBS洗涤2次,离心去上清。PBS重悬后上机检测。选定CD4+T细胞群,以CD4+IFN-γ+和CD4+IL-4+分别表示Th1和Th2细胞,二者比值即为Th1/Th2。

2 结果
2.1 各组MLN组织病理形态变化 与假手术组比较,模型组淋巴小结增大,皮质区增厚,皮质区淋巴小结数量增加。与模型组比较,大黄游离蒽醌组、生大黄水煎液组皮质区淋巴小结数量少、体积小。大黄游离蒽醌组、生大黄水煎液组淋巴小结大小相当,但大黄游离蒽醌组淋巴小结数量稍多。
2.2 各组MLN组织匀浆上清液TNF-α、IL-1水平比较 见表1。
2.3 各组NLRP3、ASC表达比较 免疫荧光显示,NLRP3阳性表达定位于细胞质,且大部分与ASC阳性表达具有共定位。假手术组NLRP3、ASC几乎无阳性表达,模型组NLRP3、ASC呈阳性表达,大黄游离蒽醌组、生大黄水煎液组二者阳性表达较模型组明显减弱。各组MLN组织ASC、NLRP3阳性细胞数量比较见表2。
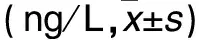
表1 各组MLN组织匀浆上清液IL-1、TNF-α水平比较
注:与假手术组比较,*P<0.05;与模型组较,#P<0.05。
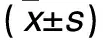
表2 各组MLN组织ASC、NLRP3阳性细胞数量比较
注:与假手术组比较,*P<0.05;与模型组较,#P<0.05。
2.4 各组CD4+CD25+Foxp3+、CD4+及Treg比例比较 见表3。
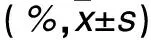
表3 各组MLN组织CD4+CD25+Foxp3+、CD4+及Treg比例比较
注:与假手术组比较,*P<0.05;与模型组比较,#P<0.05。
2.5 各组Th1、Th2及Th1/Th2比较 见表4。
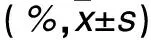
表4 各组MLN组织Th1、Th2及Th1/Th2比较
注:与假手术组比较,*P<0.05;与模型组较,#P<0.05。
3 讨论
SAP的发病机制目前尚不完全清楚,大多数学者认为,免疫细胞过度激活-炎性因子过度释放是其发病的关键环节[3]。肠道淋巴免疫系统在SAP的发生、发展过程中具有重要作用。TNF-α、IL-1是固有免疫中巨噬细胞分泌的炎性因子,在SAP初期即明显升高[4,5]。TNF-α可使毛细血管通透性增加,诱导氧自由基产生,导致局部缺血坏死;IL-1的主要作用是诱导黏附分子分泌,激活中性粒细胞并使其黏附、脱颗粒,释放氧自由基及蛋白水解酶[6]。NLRP3炎性复合体为固有免疫的重要组成部分,主要存在于细胞内。该复合体由NLRP3、ASC和caspase-1组成,ASC是NLRP3与caspase-1的桥梁,参与caspase-1的活化;caspase-1能将IL-1β的前体裂解为IL-1β,使其活化并分泌。当IL-1β分泌到细胞外,与IL-1受体结合,可引起炎症反应。如NLRP3炎性复合体调控失衡,可诱发一系列“瀑布样”炎性反应,对机体造成严重伤害[7]。有研究表明,缺乏ASC和NLRP3的胰腺炎模型大鼠胰腺水肿和炎症反应明显减轻[8,9]。在特异性免疫中,SAP初期患者体内Th1分泌大量的促炎性因子,导致Th1/Th2动态失衡,产生一系列“瀑布样”炎症反应,加重组织细胞损伤,使SAP患者出现全身炎症反应综合征等[10]。此时,IFN-γ分泌达到高峰,Treg细胞开始活跃,通过抑制INF-γ分泌、促进IL-4分泌抵抗过度的炎性反应,发挥免疫抑制作用[11]。Treg细胞是CD4+T细胞亚群之一,转录因子Foxp3是目前发现最具特异性的Treg细胞内标志物。脂多糖能与Treg细胞内选择性高表达的TLR4受体结合,进而增强Treg细胞的增殖和生存能力,提高Treg细胞的免疫抑制功能[12]。熊泽翼等[13]研究发现,SAP大鼠外周血Treg细胞显著增加,胰腺病理评分显著升高,提示Treg细胞对SAP大鼠的免疫功能有重要影响。因此,Treg细胞比例增加、Th1/Th2失衡都被认为是肠道免疫失衡的表现。
目前中西结合治疗SAP已被广泛认可,其中大黄是最常用的中药。大黄游离蒽醌是大黄的主要活性成分,其成分有大黄素、大黄酸、大黄酚等,具有清热解毒、抗菌消炎等作用[14]。研究发现,大黄游离蒽醌进入体内后各成分含量在正常大鼠胰腺组织与其他组织器官存在一定差异,但并不明显,而在SAP大鼠胰腺组织中大黄素、大黄酸等含量明显高于其他组织器官,说明大黄素、大黄酸等大黄游离蒽醌在SAP大鼠胰腺组织具有靶向分布的特点[15]。动物研究发现,大黄游离蒽醌对机体炎症反应和肠黏膜上皮细胞损伤的抑制以及对肠道微循环功能的改善作用是其保护犬SAP早期肠道损伤的重要机制[16]。本课题组前期研究发现,大黄游离蒽醌对SAP大鼠肺、肾等多器官损伤同样具有较好的保护作用。
本研究结果显示,模型组、大黄游离蒽醌组、生大黄水煎液组TNF-α、IL-1和NLRP3均明显高于假手术组,提示SAP早期固有免疫的过度激活能够破坏肠道免疫平衡,产生过度的炎性反应。大黄游离蒽醌和生大黄水煎液干预后上述指标较模型组明显降低,说明大黄游离蒽醌和生大黄水煎液对SAP大鼠肠道固有免疫具有一定调节作用。本研究造模早期Th1/Th2严重失衡,Treg细胞比例增加,而在大黄游离蒽醌和生大黄水煎液干预后,Treg细胞比例有所降低,Th1/Th2失衡有所改善,说明在大黄游离蒽醌和生大黄水煎液对SAP大鼠肠道特异性免疫也有一定调节作用。
综上所述,大黄游离蒽醌、生大黄水煎液均能通过抑制SAP大鼠早期过激的免疫反应发挥作用,在一定程度上减轻SAP所致的多器官功能损伤,且两者对免疫系统的调节作用相当。而大黄游离蒽醌具有成分相对清楚、质量可控和用量小等优点。本研究为大黄游离蒽醌的临床应用提供了理论依据。
[1] Hua J, He ZG, Hai D, et al. Angiopoietin-1 gene-modified human mesenchymal stem cells promote angiogenesis and reduce acute pancreatitis in rats[J]. Int J Clin Exp Pathol, 2014,7(7):3580-3595.
[2] 胡铭洋,彭燕.大黄治疗重症急性胰腺炎的研究进展[J].现代消化及介入诊疗,2013,18(5):305-309.
[3] 张代义,陈卫昌.免疫细胞在急性胰腺炎发病机制中的作用[J].国际消化病杂志,2015,35(1):35-38.
[4] Weng YC, Fan JQ. Protective effect of TMP on pancreas function of acute pancreatitis rats[J]. Asian Pac J Trop Med, 2015,8(6):474-478.
[5] Yu C, Huang L, Li X, et al. Spatial and temporal differences of HMGB1 expression in the pancreas of rats with acute pancreatitis[J]. Int J Clin Exp Pathol, 2015,8(6):6928-6935.
[6] 郭婧芸,朱人敏.白细胞介素-1β在急性胰腺炎中的作用[J].胃肠病学,2008,13(10):635-637.
[7] 李翔,田湉,张艳.NLRP3炎性复合体在抗感染免疫中的作用[J].细胞与分子免疫学杂志,2012,28(4):439-441.
[8] Ren JD, Ma J, Hou J, et al. Hydrogen-rich saline inhibits NLRP3 inflammasome activation and attenuates experimental acute pancreatitis in mice[J]. Mediators Inflamm, 2014,2014:930894.
[9] Hoque R, Sohail M, Malik A, et al. TLR9 and the NLRP3 inflammasome link acinar cell death with inflammation in acute pancreatitis[J]. Gastroenterology, 2011,141(1):358-369.
[10] 周玉,喻华,张春平,等.重症急性胰腺炎患者早期免疫功能的变化及临床意义[J].国际检验医学杂志,2014,35(10):1270-1274.
[11] 汪琪,韩真.CD4+CD25+Treg细胞在急性胰腺炎中作用的研究进展[J].国际消化病杂志,2013,33(1):35-38.
[12] Lewkowicz P, Lewkowicz N, Sasiak A, et al. Lipopolysaccharid activated CD4+CD25+T regulatory cells inhibit neutrophil function and promote their apoptosis and death[J]. J Immunol, 2006,177(10):7155-7163.
[13] 熊泽翼,李文星,范晓彬,等.重症急性胰腺炎大鼠Treg及内毒素的变化[J].中国医疗前沿,2012,7(4):15-16.
[14] 黄娟,张庆莲,皮凤娟,等.大黄的药理作用研究进展[J].中国医院用药评价与分析,2014,14(3):282-284.
[15] 竹林,赵健蕾,彭小航,等.大黄中游离蒽醌类化合物在实验性急性胰腺炎大鼠的组织药理学研究[J].中国中药杂志,2014,39(2):304-308.
[16] 张燕,王平,杨永茂,等.大黄游离蒽醌对犬重症急性胰腺炎早期肠损伤的保护作用[J].中国实验方剂学杂志,2013,19(5):172-176.
Effects of free anthraquinone of rhubarb on immune function of mesenteric lymph nodes in rats with severe acute pancreatitis
CHENLi,FANLing,TANXiaoyong,WANGLulu,LIUYuanqi,XIONGYuxia
(DepartmentofParmacology,SichuanMedicaluniversity,Luzhou, 646000)
Objective To observe the effects of free anthraquinones of rhubarb on immune function in mesenteric lymph nodes (MLN) of severe acute pancreatitis (SAP) rats. Methods Twenty-four healthy male SD rats were randomly divided into the sham operation group, model group, free rhubarb anthraquinone group and rhubarb decoction group, 6 rats in each group. SAP model was made by retrograde pancreatic duct injection of sodium taurocholate in the model group, free rhubarb anthraquinone group and rhubarb decoction group. The sham operation group was injected with equal volume of sterilized normal saline by retrograde injection of pancreatic duct. Rhubarb decoction group and free rhubarb anthraquinone group were respectively administrated by intragastric administration with 200 mg/kg free anthraquinone of rhubarb and 6.6 g/kg rhubarb decoction at 12 hours before and 2 hours after the inducement of SAP. Sham operation group and model group were not treated. MLN was collected 24 hours after molding. The histopathological changes of MLN were observed under light microscope after HE staining. The levels of TNF-α and IL-1 in MLN homogenate were detected by ELISA. The expression of NLRP3 and ASC was tested in the MLN by immunoflurescence. The number of CD4+, CD4+CD25+Foxp3+, Th1, Th2, Th1/Th2 ratio and Treg percentage were tested by flow cytometry. Results Lymphoid nodules appeared to be enlarged, cortex was thickened, the quantity of lymphoid nodules was increased in the cortex area of the model group as compared with those of the sham operation group. The quantity and size of lymphoid nodules in the cortex area were smaller in free rhubarb anthraquinone group and rhubarb decoction group than that of the model group. No difference was found in the lymph nodule volume between the free rhubarb anthraquinone group and rhubarb decoction group. Expression level of NLRP3, IL-1 and TNF-α: the model group was significantly higher than the sham operation group (P<0.05), the free rhubarb anthraquinone group and rhubarb decoction group was significantly lower than the model group (P<0.05). CD4+CD25+Foxp3+, CD4+and Treg ratio: the model group was significantly higher than the sham operation group (P<0.05), except for CD4+in the free rhubarb anthraquinone group, the free rhubarb anthraquinone group and rhubarb decoction group was significantly lower than the model group (allP<0.05). Th1, Th2 and Th1/Th2: Compared with the sham operation group, Th1 and Th1/Th2 was higher, and the Th2 in the model group was significantly lower (allP<0.05). Th1 and Th1/Th2 was significantly lower in the free rhubarb anthraquinone group and rhubarb decation group than in the model group, and the Th2 in free rhubarb anthraquinone group and rhubarb decoction group was significantly higher than that of the model group (P<0.05). No statistically significant difference was found in the above indicators between the free rhubarb anthraquinone group and rhubarb decoction group (allP>0.05). Conclusions Free anthraquinone of rhubarb can significantly reduce immune inflammatory response in intestine, and its effect is similar to rhubarb decoction. The mechanism may be that free anthraquinone of rhubarb may regulate the body′s immune balance through inhibiting the expression of inflammasome, regulating Th1/Th2 imbalance and intervening the immune response in early stage of acute pancreatitis.
severe acute pancreatitis; intestinal immune; free anthraquinone of rhubarb; rats
国家自然科学基金资助项目(81102868)。
陈立(1986-),男,硕士在读,研究方向为抗炎免疫药理。E-mail: 153619478@qq.com
熊玉霞(1975-),女,副教授,研究方向为抗炎免疫药理,多次主持国家级、省部级科研课题。E-mail: xyx_cell@163.com
10.3969/j.issn.1002-266X.2016.24.004
R285.5
A
1002-266X(2016)24-0013-04
2015-12-08)
