人肺腺癌A549细胞上清液对人脐静脉内皮细胞增殖、迁移和侵袭能力的影响
2016-05-10曹月诚羡海英陈登峰吴刚
曹月诚,羡海英 ,陈登峰,吴刚
(1衡水市哈励逊国际和平医院,河北衡水053000;2中国医科大学附属第一医院)
人肺腺癌A549细胞上清液对人脐静脉内皮细胞增殖、迁移和侵袭能力的影响
曹月诚1,羡海英1,陈登峰1,吴刚2
(1衡水市哈励逊国际和平医院,河北衡水053000;2中国医科大学附属第一医院)
目的 探讨人肺腺癌A549细胞上清液对人脐静脉内皮细胞(HUVECs)增殖、迁移和侵袭能力的影响。方法 取对数生长期HUVECs,分别加入培养24、48 h的A549细胞上清液(分别记为 24 h组和 48 h组),对照组仅加入高糖DMEM培养基。采用MTS法检测各组细胞增殖活性,Transwell试验检测各组细胞迁移及侵袭能力。结果 与对照组比较,24 h组和 48 h组HUVECs增殖、迁移和侵袭能力均升高,且24 h组升高更明显(P<0.05或<0.01)。结论 A549细胞上清液可增强HUVECs的增殖、迁移和侵袭能力,以培养24 h的A549细胞上清液作用较强。
人脐静脉内皮细胞;人肺腺癌A549细胞;增殖;迁移;侵袭
肿瘤细胞的生长、转移需要大量的营养物质,这些营养物质均由血管提供[1]。内皮细胞完成迁移、降解基质、侵袭并形成新生的血管,这一系列过程不仅受全身神经体液的影响,同样也受其所处微环境的调控[2, 3]。癌细胞分泌的各类因子会影响其周围的内皮细胞,使其向肿瘤组织的方向生长,完成萌芽期和发育期。肿瘤组织一旦与毛细血管接触,就会快速增生甚至转移至其他部位[4]。2013年1月~2014年10月,本研究观察不同时段人肺腺癌A549细胞上清液对人脐静脉内皮细胞(HUVECs)增殖、迁移和侵袭能力的影响。现报告如下。
1 材料与方法
1.1 材料 人肺腺癌A549细胞及HUVECs均购自中国医学科学院细胞中心。高糖DMEM培养基、FBS、0.25% EDTA胰酶、双抗均购自美国Gibco公司,细胞增殖和毒性检测试剂盒购自美国Promega公司,Transwell培养板购自美国Corning公司。
1.2 细胞培养 采用含10% FBS、1%双抗的高糖DMEM培养基,于37 ℃、5% CO2培养箱中培养A549细胞及HUVECs,2~3天换液,至80%~90%融合时传代培养,取对数生长期细胞进行研究。
1.3 不同时段A549细胞上清液制备 取对数生长期A549细胞接种在10 cm2培养皿中,采用含10% FBS、1%双抗的高糖DMEM培养基,于37 ℃、5% CO2培养箱中培养,2~3天换液。至90%融合时,换10 mL的无血清DMEM培养基分别培养24、48 h。收集上清液,2 000 r/min离心10 min,去除死细胞及杂质,滤器过滤,-80 ℃保存备用。
1.4 细胞分组与处理 取饥饿处理后的HUVECs以5 000/孔密度接种于96孔板中,分别加入含5% FBS的培养24 h A549细胞上清液(24 h组)、48 h A549细胞上清液(48 h组)和高糖DMEM培养基(对照组),培养24 h。
1.5 相关指标观察
1.5.1 细胞增殖活性 采用MTS法。按照MTS细胞增殖和毒性检测试剂盒说明书操作,取对数生长期的各组细胞,将100 μL MTS加入各组孔板中,孵育4 h,495 nm测定各孔吸光度值。计算细胞增殖活性,每组设5个复孔。
1.5.2 细胞迁移能力 采用Transwell迁移试验。取对数生长期的HUVECs,0.25%胰酶消化后1 000 r/min离心5 min,采用含1% FBS的DMEM培养基悬浮HUVECs,均匀接种在Transwell培养板上室,每个小室2×104个细胞。下室内分别为含有20% FBS的培养24 h、48 h A549细胞条件培养基和对照DMEM培养基,分别记为24 h组、48 h组和对照组。16 h后取出上室,使用棉签小心擦除膜上面的细胞,90%乙醇固定20 min,0.1%龙胆紫染色15 min。镜下观察,随机计数5个视野下的细胞数,取平均值。
1.5.3 细胞侵袭能力 采用Transwell侵袭试验。上室加入稀释Matrigel胶(1∶5 DMEM稀释)50 μL,放入培养箱2 h以上,凝固待用。取对数生长期的HUVECs,参照1.5.2的方法均匀接种在预先处理好的Transwell板上室,每个小室5×104个细胞。下室内分别为含有20% FBS的培养24 h、48 h A549细胞条件培养基和对照DMEM培养基,分别记为24 h组、48 h组和对照组。24 h后取出上室,使用棉签小心擦除膜上面的细胞,90%乙醇固定20 min,0.1%龙胆紫染色15 min。镜下观察,随机计数5个视野下的细胞数,取平均值。
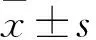
2 结果
与对照组比较,24 h组和48 h组HUVECs增殖、迁移和侵袭能力均升高,且24 h组升高更明显(P<0.05或<0.01)。见表1。
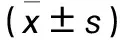
表1 三组细胞增殖、迁移和侵袭能力比较
注:与对照组比较,*P<0.05,#P<0.01;与48 h组比较,△P<0.05,▲P<0.01。
3 讨论
肿瘤细胞可以通过自分泌和旁分泌的方式产生大量的生长因子,作用于本身或邻近细胞,从而引起本身或邻近细胞的应答,造成肿瘤细胞增殖、新生血管形成以及免疫应答减弱等[5]。由于血管生成在肿瘤的侵袭、转移中发挥了重要作用,故以肿瘤血管为目标的抗血管生成治疗成为抗肿瘤研究的热点[6]。体外研究表明,肿瘤细胞分泌的上清液可以产生多种作用。肖衡等[7]研究发现,肝癌细胞分泌的上清液可以使成纤维细胞转化为肌成纤维细胞,有利于肿瘤基质的形成,并能促进血管的生长。牛云等[8]发现,脑胶质瘤细胞上清液可以诱导骨髓间充质干细胞向神经元方向分化。
肺癌病死率居各种恶性肿瘤之首[8]。A549细胞系不但是体外研究Ⅱ型肺泡上皮细胞药物代谢的模式细胞,也是体外研究肺腺癌治疗效果的常用细胞。研究发现,A549细胞上清液不但可以影响树突状细胞的增殖,降低机体对肿瘤的免疫杀伤作用;也可以诱导基质细胞转化为更利于肿瘤血管生成的肌成纤维细胞,最重要的是可以直接作用于内皮细胞而促进血管生成,从而为肿瘤的生长转移提供营养支持[9]。
迁移是细胞从不利于生长的环境向有利于生长的环境转移的化学趋向性,侵袭是细胞分泌基质金属蛋白酶等酶类以分解组织基质的能力,二者都是内皮细胞形成血管的必备能力。有报道显示,HUVECs与肿瘤细胞上清液混合培养的生长环境类似于细胞在人体肿瘤内的生长环境[10]。本研究结果发现,与对照组比较,24 h组和48 h组HUVECs增殖、迁移和侵袭能力均升高,且24 h组升高更明显;说明A549细胞上清液可增强HUVECs增殖、迁移和侵袭能力,以培养24 h的A549细胞上清液作用较强。分析原因,可能是A549细胞可以分泌大量的生长因子,如血管内皮生长因子、粒细胞集落刺激生长因子、成纤维细胞生长因子等,可以促进血管的生成。
综上所述,A549细胞上清液可增强HUVECs的增殖、迁移和侵袭能力,以培养24 h的A549细胞上清液作用较强,但是其具体机制仍有待于进一步研究。
[1] 邓海滨,王中奇,徐振晔.肺岩宁方对人脐静脉内皮细胞增殖、迁移及管腔形成的影响[J].中西医结合学报,2009,7(3):255-260.
[2] 李迎春,田菁,张文琪,等.HMGB1对肿瘤血管生成体外调节作用的观察[J].山东医药,2013,53(45):8-9.
[3]刘延霞,郭其森.血管生成抑制剂治疗肺癌的研究现状[J].山东医药,2005,45(20):68-69.
[4] Kim DH, Choe YS, Jung KH, et al. Synthesis and evaluation of 4-[(18)F]fluorothalidomide for the in vivo studies of angiogenesis[J]. Nucl Med Biol, 2006,33(2):255-262.
[5] Fukumura D, Duda DG, Munn LL, et al. Tumor microvasculature and microenvironment: novel insights through intravital imaging in pre-clinical models[J]. Microcirculation, 2010,17(3):206-225.
[6] 郭其森,刘秀菊.非小细胞肺癌的内科治疗[J].山东医药,2011,51(3):102-104.
[7] 肖衡,杜成友,罗诗樵,等.不同浓度肿瘤细胞上清液对成纤维细胞生长及表型转化的影响[J].第三军医大学学报,2011,33(23):2454-2458.
[8] 牛云,何旭,王心蕊,等.鼠胶质瘤细胞上清液诱导人骨髓间充质干细胞向神经元样细胞的分化[J].吉林大学学报:医学版,2007,33(4):634-637.
[9] 韩建群,秦伟伟,李宏伟,等.氯化钴致低氧诱导肺癌细胞系A549 DLL4表达上调并分泌促HUVEC迁移物[J].基础医学与临床,2012,32(3):317-321.
[10] 蒋力,何勇,蒋耀光.Endostar对肿瘤血管内皮细胞生长及功能的抑制作用[J].第三军医大学学报,2009,31(21):2069-2072.
10.3969/j.issn.1002-266X.2016.16.010
R734.2
A
1002-266X(2016)16-0033-02
2015-08-20)
