大鼠脑胶质瘤模型的建立及意义
2016-05-10轩亚茹张春春王亚华彭曦闫荷露李霞应雪唐辉
轩亚茹,张春春,王亚华,彭曦,闫荷露,李霞,应雪,唐辉
(1新疆石河子大学药学院,新疆石河子832000;2新疆石河子大学医学院第一附属医院)
大鼠脑胶质瘤模型的建立及意义
轩亚茹1,张春春1,王亚华1,彭曦2,闫荷露1,李霞1,应雪1,唐辉1
(1新疆石河子大学药学院,新疆石河子832000;2新疆石河子大学医学院第一附属医院)
目的 建立稳定可靠、简便易行的大鼠脑胶质瘤模型,为深入研究脑胶质瘤提供理想的动物模型。方法 选择24只大鼠作为模型组,采用立体定向仪,将1×106个/10 μL的C6脑胶质瘤细胞悬液接种于大鼠大脑右侧尾状核区,建立脑胶质瘤动物模型。选择6只大鼠作为正常组,颅内钻孔后不接种C6脑胶质瘤细胞。模型组随机选择6只,比较两组生长状况、活动饮食情况及体质量变化。模型组剩余大鼠分别于建模第7、14、21天各随机处死6只,病理解剖观察肿瘤体积变化及脏器转移情况;取模型组建模第7天的脑组织,正常组同期处死,取脑组织行HE染色,观察肿瘤组织病理学变化。结果 正常组生长状况良好,活动饮食均正常,体质量逐渐升高。模型组荷瘤后逐渐出现精神萎靡、反应迟钝、食欲不振、腹泻、出血甚至死亡,体质量逐渐下降。与建模第7天比较,建模第14、21天肿瘤体积体明显增大(P均<0.05),且建模第21天肿瘤体积明显大于建模第14天(P<0.05)。模型组脑组织HE染色后可见肿瘤细胞呈纺锤形,核大深染,核分裂相多见,生长活跃,密集成群,排列紊乱;正常组脑组织HE染色后可见细胞分布均匀,无异常现象。结论 成功建立大鼠脑胶质瘤模型;该模型成瘤周期短,肿瘤细胞生长稳定,可为脑胶质瘤的基础研究提供理想的动物模型。
脑胶质瘤;立体定向;病理特征;大鼠
脑胶质瘤恶性程度高,患者平均生存时间仅14.6个月,5年生存率不超过5%[1,2]。脑胶质瘤呈浸润性生长,手术难以完全切除,且对放射治疗不敏感[3];由于血脑屏障的存在,大部分化疗药物无法到达病灶部位[4]。多数患者预后较差,复发率较高。为研究脑胶质瘤的发病机制,必须建立一种稳定、良好的脑胶质瘤动物模型。2015年4~5月,我们建立了一种大鼠脑胶质瘤动物模型,并对该模型进行评价。现报告如下。
1 材料与方法
1.1 材料 健康雄性Wistar大鼠30只,6~8周龄,体质量200~220 g,购自新疆地方病防治研究所,动物许可证号:SXSK(新)-20150001。C6胶质瘤细胞株,中国科学院上海细胞库。CO2恒温培养箱,美国Thermo Fisher Scientific公司;台式离心机,美国贝克曼库尔特公司;电子恒温水浴锅,北京长安科学仪器厂;倒置显微镜,日本Olympus公司;脑立体定向仪,深圳市瑞沃德生命科技有限公司。DMEM高糖培养基、0.25%胰蛋白酶,美国Gibco公司;FBS,杭州四季青生物科技有限公司;青霉素与链霉素混合液,北京索莱宝生物技术有限公司;PBS缓冲溶液,上海生工生物工程科技有限公司;骨蜡,上海三友医疗器械有限公司。
1.2 细胞培养 取C6脑胶质瘤细胞2×106个,置于DMEM高糖培养基(含10% FBS、100 U/mL青霉素和100 μg/mL链霉素),37 ℃、5% CO2细胞培养箱中培养。培养48 h,细胞融合80%时,加入0.25%胰蛋白酶消化。倒置显微镜下观察到细胞回缩变圆时,加入完全培养基终止消化。1 000 r/min离心3 min,收集细胞,用无血清培养液吹打成单细胞悬液,采用血球计数板计数,将单细胞悬液密度调整为1×106个/10 μL,置于37 ℃恒温振荡水浴中存放待用。
1.3 动物模型制备 随机选取24只大鼠(模型组),禁食12 h、不禁水,采用20%氨基甲酸乙酯1 g/kg腹腔注射麻醉,并固定于脑立体定向仪上,两耳针深入外耳道对称固定。颅顶备皮,75%乙醇消毒后铺洞巾,沿正中矢状线,纵向切开头皮约1.5 cm,分离暴露颅骨。根据大鼠头部解剖图谱确定前囟中点前0.4 mm,中线右侧3.0 mm,牙科钻钻孔。用10 μL微量注射器抽吸10 μL单细胞悬液,沿骨孔缓慢垂直进针至硬脑膜下6.0 mm,退针1 mm后固定。缓慢注射10 min(1 μL/min),注射完毕后留针5 min,缓慢拔针,骨蜡封闭骨窗。缝合切口后消毒皮肤,肌注青霉素1万U。剩余6只大鼠作为正常组,颅内钻孔后不接种C6脑胶质瘤细胞。所有大鼠常规单笼饲养[5~7]。
1.4 相关指标观察 ①基本情况:模型组随机取6只,观察两组生长状况、饮食活动情况,以及建模第0、7、14、21天体质量变化。②病理解剖学检查:模型组剩余大鼠分别于建模第7、14、21天各随机处死6只,4% PBS多聚甲醛经心脏灌注固定后获取大鼠全脑标本,取心、肝、脾、肺、肾、脊髓等主要脏器,检查有无脏器转移灶。大鼠在处死后或自然死亡时,获取全脑标本。按脑表面的接种穿刺点作一冠状交叉切口,观察肿瘤生长情况,计算肿瘤体积=a×b×c(a为肿瘤的最大径,b为与最大径垂直的最宽径,c为肿瘤的高)[8]。③组织病理学检查:取模型组建模第7天的脑组织,正常组同期处死,取脑组织进行固定,脱水;常规石蜡切片,片厚4 μm,HE染色,光镜下观察组织病理学变化。
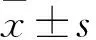
2 结果
2.1 两组基本情况观察结果 正常组生长状况良好,活动、饮食均正常。模型组接种第2天开始,大鼠活动基本正常,少量进食,头部手术切口均无感染,大部分大鼠眼周有出血症状;接种7天开始,大鼠开始出现精神萎靡、反应迟钝、食欲不振、腹泻;接种第14天开始,上述症状明显加重,皮毛失去光泽,眼周淤血,进食量明显减少,体质量下降,部分出现偏瘫、昏迷,甚至死亡。两组体质量变化见表1。
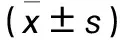
表1 两组体质量变化
注:与正常组同期比较,*P<0.05;与同组0天比较,#P<0.05;与同组7天比较,△P<0.05;与同组14天比较,▲P<0.05。
2.2 肿瘤的病理解剖观察结果及其体积变化 模型组肉眼可见肿瘤呈浸润性生长,较周围正常组织颜色深,切面可见肿瘤内出血和组织坏死。未见其他脏器转移。接种第7、14、21天,肿瘤体积分别为(5.38±1.32)、(41.57±9.68)、(155.48±31.96)mm3。与建模第7天比较,建模第14、21天肿瘤体积明显增大(P均<0.05),且建模第21天肿瘤体积明显大于建模第14天(P<0.05)。
2.3 肿瘤的组织病理学观察结果 模型组脑组织HE染色后可见肿瘤细胞呈纺锤形,核大深染,核分裂相多见,生长活跃,密集成群,排列紊乱;正常组脑组织HE染色后可见细胞分布均匀,无异常现象。肿瘤向脑组织呈浸润性生长,与正常组织交界处仍能见到一个较明显的界线;在正常组织内散布多个肿瘤细胞簇,多呈椭圆形,围绕血管快速分裂增殖,见插页Ⅲ图7。肿瘤组织内有出血和坏死区域,伴有丰富的微血管,这些膨胀的微血管内充斥着大量的红细胞,并被坏死区域包围。
3 讨论
脑胶质瘤为常见的颅内肿瘤,因其呈浸润性生长,无明显边界,手术不能完全切除[9,10],故临床治愈率低,患者生存时间短、病死率高[11]。胶质瘤是由于先天的遗传高危因素和环境中的致癌因素相互作用所导致的,其发病机制目前仍不十分清楚。为了更详细地了解脑胶质瘤的发病机制,寻找新的治疗方法,建立可靠的脑胶质瘤动物模型成为重中之重。
本研究选择C6/Wistar模型,其中C6脑胶质瘤细胞在各种大鼠中均有较好的组织相容性,在大鼠脑内接种后肿瘤形成快,成活率较高;其生物学特性与人脑胶质瘤较为接近,有浸润性生长、新生血管形成的特性[12],建立模型的瘤体特征及生长方式更接近于人脑恶性胶质瘤[3],呈现多形性、高有丝分裂指数、瘤内局灶坏死出血和脑实质浸润的特点[13],适合用来研究脑胶质瘤的发病机制和治疗方法。
本研究将C6脑胶质瘤细胞悬液置于37 ℃恒温振荡水浴中,可避免细胞死亡和沉积底部,造成细胞密度不均匀。在皮层接种脑胶质瘤细胞时借助于立体定向仪对S1区进行准确定位,确定进针深度为6 mm、退针深度为1 mm,创建一个细胞悬液暂时存储空间,并防止其沿针道扩散;接种完毕后,留针5 min再缓慢拔针,防止细胞溢出,使细胞充分沉积,延长肿瘤细胞与靶点脑组织的接触时间,从而提高成瘤率[7];用生理盐水冲洗术野、无菌骨蜡封闭骨窗,缝合切口;术后静脉注射青霉素,有效防止动物模型术后感染,确保模型的成功率和标准化,有利于准确评估实验效果。
本研究结果显示,模型组建模7天后可表现出进食减少、腹泻、萎靡不振等明显的症状,随时间延长,症状逐渐加重;建模14天内体质量呈轻微的上升趋势,之后呈下降趋势,提示接种2周后,肿瘤的生长已严重影响大鼠的进食及活动;建模第21天后大多呈濒死状态,甚至死亡。本研究中,建模第14天肿瘤体积已达(41.57±9.68)mm3,建模第21天达到(155.48±31.96)mm3,结合大鼠体质量变化,推测大鼠体质量一旦开始下降,意味着肿瘤已进入快速生长阶段。根据本研究动物模型肿瘤的生长特点,考虑本模型的治疗时间为建模第14天左右。模型组大鼠大脑全脑标本可见,形成的脑胶质瘤大小和形状相似,由于大脑右侧肿瘤生长,导致脑中线向左偏,占位效应明显;左侧正常的大脑皮层和纹状体部分,颜色都较浅,侧脑室明显,而右侧大脑部分可观察到肿瘤组织颜色较深,在大脑尾状核处向周围脑组织浸润,无包膜,肿瘤区有出血、坏死以及丰富的新生血管。HE染色显示,C6/Wistar模型所形成的脑胶质瘤表现出明显的侵袭性,肿瘤呈不定性生长,单个迁移的C6脑胶质瘤细胞或C6脑胶质瘤细胞簇分布在整个中枢神经系统内[11],本研究建立的动物模型结果与上述说法呈现一致性。大鼠脑内的人异种移植肿瘤细胞和人脑内的恶性胶质瘤细胞同大多数肿瘤细胞一样,通常沿着血管和神经纤维周围生长和迁移,C6脑胶质瘤细胞倾向于围绕血管生长,表现出亲内皮基底膜的性质,提示C6脑胶质瘤细胞生长、成瘤与内皮细胞有紧密联系[12,13]。
总之,本研究成功建立大鼠脑胶质瘤模型,该模型成瘤周期短,肿瘤细胞生长稳定,可为脑胶质瘤的基础研究提供理想的动物模型。
[1] Mangiola A, Anile C, Pompucci A, et al. Glioblastoma therapy: going beyond hercules columns[J]. Expert Rev Neurother, 2010,10(4):507-514.
[2] Dolecek TA, Propp JM, Stroup NE, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2005-2009[J]. Neuro Oncol, 2013,14(Suppl 5):v1-v49.
[3] Zhang P, Hu L, Yin Q, et al. Transferrin-modified c-paclitaxel loaded hybrid micelle for sequential blood-brain barrier penetration and glioma targeting therapy[J]. Mol Pharm, 2012,9(6):1590-1598.
[4] Chaichana KL, Zadnik P, Weingart JD, et al. Multiple resections for patients with glioblastoma: prolonging survival[J]. J Neurosurg, 2013,118(4):812-820.
[5] Stakleff KS, Sloan T, Blanco D, et al. Resveratrol exerts differential effects in vitro and in vivo against ovarian cancer cells[J]. Asian Pac J Cancer Prev, 2012,13(4):1333-1340.
[6] Valable S, Barbier EL, Bernaudin M, et al. In vivo MRI tracking of exogenous monocytes/macrophages targeting brain tumors in a rat model of glioma[J]. Neuroimage, 2008,40(2):973-983.
[7] Doblas S, Saunders D, Kshirsagar P, et al. Phenyl-tert-butylnitrone induces tumor regression and decreases angiogenesisin a C6 rat glioma model[J]. Free Radic Biol Med, 2008,44(1):63-72.
[8] Ying X, Wen H, Lu WL, et al. Dual-targeting daunorubicin liposomes improve the therapeutic efficacy of brain glioma in animals[J]. J Control Release, 2010,141(2):183-192.
[9] 王法勤,孙金龙.脑胶质瘤的治疗进展[J].山东医药,2009,49(38):112-113.
[10] Meyers JD, Doane T, Burda C, et al. Nanoparticles for imaging and treating brain cancer[J]. Nanomedicine (Lond), 2013,8(1):123-143.
[11] Ferlay J, Shin HR, Bray F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. Int J Cancer, 2010,127(12):2893-2917.
[12] Cretu A, Fotos JS, Little BW, et al. Human and rat glioma growth, invasion, and vascul arization in a novel chick embryo brain tumor model[J]. Clin Exp Metastasis, 2005,22(3):225-236.
[13] Grobben B, De Deyn PP, Slegers H. Rat C6 glioma as experimental model system for the study of glioblastoma growth and invasion[J]. Cell Tissue Res, 2002,310(3):257-270.
·作者·编者·读者·
声 明
近年来,一些不法分子假冒《山东医药》中介、代理甚至编辑的名义发布稿约,承诺发稿,并高额收取相关费用,已致部分作者受骗。在此,我社郑重声明,《山东医药》无任何中介、代理机构或个人,务请作者提高警惕。需向《山东医药》杂志投稿者,请查阅《山东医药》杂志上标明的电子邮箱及投稿须知,严防被骗。同时,正告不法分子停止非法行为,否则将负法律责任。
山东卫生报刊社
国家自然科学基金资助项目(81160396,81460540);新疆生产建设兵团社会发展科技攻关与成果转化计划项目(2015AD007);石河子大学杰出青年科技人才培育计划项目(2012ZRKXJQ07)。
应雪(E-mail: yingxue2011@qq.com)
10.3969/j.issn.1002-266X.2016.16.009
R739.4
A
1002-266X(2016)16-0030-03
2015-09-18)
