1,25-(OH)2D3对大鼠特发性肺纤维化的影响及机制
2016-05-10董洪亮刘乃国苗双郑静倪娜王楠
董洪亮,刘乃国,苗双,郑静,倪娜,王楠
(1滨州医学院附属医院,山东滨州256600;2滨州医学院)
1,25-(OH)2D3对大鼠特发性肺纤维化的影响及机制
董洪亮1,刘乃国1,苗双2,郑静1,倪娜1,王楠1
(1滨州医学院附属医院,山东滨州256600;2滨州医学院)
目的 观察1,25-(OH)2D3对大鼠特发性肺纤维化(IPF)发生、发展的影响,探讨其作用机制。方法 90只雄性SD大鼠随机分为模型组、治疗组和对照组,每组30只。模型组和治疗组经气管内注射博来霉素5 mg/kg建立IPF模型,对照组注射生理盐水200 μL/只。自注射后第2天开始,模型组腹腔注射1,25-(OH)2D3溶剂(0.1%乙醇、99.9%丙二醇,200 μL/只),治疗组腹腔注射1,25-(OH)2D32 μg/kg,对照组腹腔注射生理盐水200 μL/只,均隔天1次。各组于给药后第14、21、28天分别处死10只大鼠,检测肺组织羟脯氨酸含量;分离培养肺成纤维细胞,采用Fluo-3AM荧光负载,激光共聚焦显微镜检测细胞内Ca2+浓度;采用Real-time PCR法检测肺成纤维细胞PI3K、AKT、mTOR mRNA表达。结果 给药第14、21、28天,模型组肺组织羟脯氨酸含量、肺成纤维细胞内Ca2+浓度及PI3K、AKT、mTOR mRNA表达均高于对照组,治疗组上述指标在各时间点均低于模型组,组间比较P<0.05或<0.01。模型组和治疗组肺成纤维细胞内Ca2+浓度与PI3K、AKT、mTOR mRNA表达均呈正相关(r分别为0.784、0.647、0.805,P均<0.01)。结论 1,25-(OH)2D3可抑制IPF的发生、发展;降低肺成纤维细胞内Ca2+浓度、抑制PI3K-AKT-mTOR通路可能是其作用机制。
特发性肺纤维化;1,25-(OH)2D3;钙离子;PI3K-AKT-mTOR信号通路;肺成纤维细胞
特发性肺纤维化(IPF)是由多种原因引起的病因尚不明确的致死性疾病,目前缺乏有效的治疗手段[1~3]。成纤维细胞异常增殖在IPF发生过程中发挥重要作用[4,5]。研究发现,1,25-(OH)2D3能够抑制TGF-β1刺激的肺成纤维细胞和上皮细胞发生纤维化[6];可改善博来霉素所致的小鼠肺纤维化[7];提示1,25-(OH)2D3可能对IPF具有潜在的治疗作用。PI3K-AKT-mTOR信号通路作为细胞内重要的信号转导途径,具有调节细胞生长、增殖、蛋白合成及转录等重要生理作用[8],可能参与IPF的发生[9]。细胞外Ca2+内流和内质网Ca2+释放均可激活PI3K-AKT-mTOR通路[10]。2015年5~6月,本研究观察了1,25-(OH)2D3对IPF大鼠不变通路的影响,现分析结果,探讨其对IPF的治疗作用及机制。
1 材料与方法
1.1 材料 90只6~8周龄SPF级雄性SD大鼠,购自鲁抗医药实验中心(许可证号:SCXK鲁2013000)。博来霉素购自日本化学株式会社(15 mg/支,批号:030201),1,25-(OH)2D3购自Sigma公司(lot#074M4028V,≥99%)。HiFiScript Qμick gDNA Removal cDNA Kit、Maxima SYBR Green/Fluorescein qPCR Master Mix购自康为世纪有限公司。Fluo-3AM-DMSO购自北京索莱宝科技有限公司。羟脯氨酸检测试剂盒购于南京建成生物工程研究所。根据大鼠PI3K、AKT、mTOR的基因序列,应用Primer(version5.0)软件设计特异性引物,并由上海生工技术有限公司合成。内参基因 GAPDH引物由上海生工技术有限公司提供。引物序列见表1。
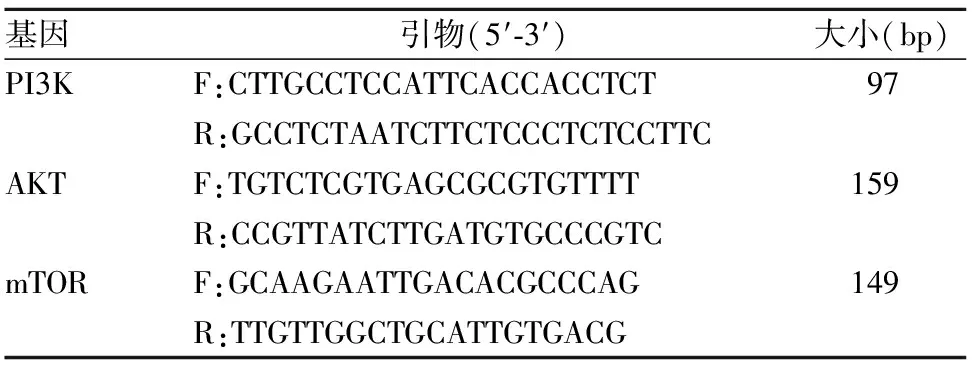
表1 PI3K、AKT、mTOR基因引物序列
1.2 模型制作及处理 90只SD大鼠随机分为模型组、治疗组、对照组,每组30只。三组均腹腔注射4%水合氯醛(200~300 μL/只)麻醉,模型组、治疗组采用单次气管内注射博来霉素5.0 mg/kg建立肺纤维化模型[11],对照组气管内注射生理盐水200 μL/只。自注射后第2天起,模型组腹腔注射1,25-(OH)2D3溶剂(0.1%乙醇、99.9%丙二醇)200 μL/只,隔天1次;治疗组腹腔注射1,25-(OH)2D3(溶于0.1%乙醇、99.9%丙二醇)2 μg/kg[12],隔天1次;对照组腹腔注射生理盐水200 μL/只,隔天1次。各组于给药第14、21、28 天分别处死10只大鼠,取肺组织进行后续观察。
1.3 肺组织水解液羟脯氨酸含量检测 精确称取各组各时间点肺组织30 mg放入试管中,参照试剂盒说明书步骤制备组织水解液。取组织水解液在波长550 nm处检测吸光度值(A值),计算羟脯氨酸含量。羟脯氨酸(μg/mg)=(测定管A值-空白管A值)/(标准管A值-空白管A值)×标准管含量(5 μg/mL)×水解液总体积(10 mL)/组织湿重(mg)。
1.4 肺成纤维细胞分离及细胞内Ca2+浓度检测 取各组肺组织,剪成1 mm3大小组织块,放入培养皿,组织块之间距离约为1 cm,37 ℃、5% CO2细胞培养箱内培养4 h,加入含10% FBS的DMEM培养液1 mL培养12 h,再加入2 mL培养液培养60 h,取出组织块,去除未贴壁细胞,更换4~5 mL培养液继续培养,光镜下观察细胞形态均为梭形或多角形,表明分离到的细胞为成纤维细胞。继续培养2 h,用0.25%胰蛋白酶消化后转入激光共聚焦培养皿培养6~8 h,加入终浓度为5 μmol/L的Fluo-3AM-DMSO,混匀,37 ℃避光孵育30 min;D-hanks缓冲液洗3遍,加入600 μL D-hanks缓冲液。采用激光共聚焦显微镜观察细胞内Ca2+荧光吸光度。Fluo-3AM的激发波长和发射波长分别为488 nm 和526 nm。利用图像处理软件计算各组细胞平均荧光强度。
1.5 肺成纤维细胞PI3K、AKT、mTOR mRNA表达 采用Real-time PCR法。采用TRIzol法提取各组肺成纤维细胞总RNA,分光光度计测定RNA浓度及纯度,琼脂糖凝胶电泳检测RNA完整性。用HiFiScript Qμick gDNA Removal cDNA Kit进行反转录。合成的cDNA保存于-80 ℃冰箱以备用。以GADPH作为内参基因,采用Real-time PCR法对各组肺成纤维细胞内PI3K、AKT、mTOR基因表达进行相对定量(对照组表达量设为1)检测。反应体系:2×Maxima SYBR Green Mix 12.5 μL,Forward Primer 1 μL,Reverse Primer 1 μL,模板1 μL,RNase-free Water补足至25 μL。扩增反应条件:95 ℃ 10 min;95 ℃变性15 s、55 ℃退火20 s、72 ℃延伸20 s,35个循环。所得数据用2-ΔΔCT法进行统计分析。
2 结果
2.1 各组不同时间肺组织羟脯氨酸含量比较 给药第14、21、28天,模型组和治疗组肺组织羟脯氨酸含量均高于对照组(P<0.05或<0.01),治疗组均低于模型组(P<0.05或<0.01)。见表 2。

表2 三组给药第14、21、28天肺组织羟脯氨酸含量比较
注:与对照组同时间点比较,aP<0.05,bP<0.01;与模型组同时间点比较,cP<0.05,dP<0.01。
2.2 各组不同时间肺成纤维细胞内Ca2+浓度比较 给药第14、21、28 天,模型组和治疗组肺成纤维细胞内Ca2+荧光强度均高于相应时间点的对照组,且治疗组均低于模型组,组间比较P<0.05或<0.01。三组Ca2+荧光强度均随给药时间增加逐渐增高(P均<0.05)。见表3。

表3 三组给药第14、21、28天肺成纤维细胞内Ca2+荧光强度比较
注:与对照组同时间点比较,aP<0.05,bP<0.01;与模型组同时间点比较,cP<0.05,dP<0.01;同组各时间点比较,P均<0.05。
2.3 肺成纤维细胞PI3K、AKT、mTOR mRNA表达比较 给药第14、21、28天,模型组肺成纤维细胞PI3K、AKT、mTOR mRNA相对表达量均高于对照组(P<0.05或<0.01);在给药第21、28天时,治疗组肺成纤维细胞PI3K、AKT、mTOR mRNA相对表达量均高于对照组(P均<0.01);治疗组各时间点三种基因mRNA相对表达量均低于模型组(P<0.05或<0.01)。见表4。

表4 三组给药第14、21、28天肺成纤维细胞PI3K、AKT、mTOR mRNA相对表达量比较
注:与对照组同时间点比较,aP<0.05,bP<0.01;与模型组同时间点比较,cP<0.05,dP<0.01。
2.4 肺成纤维细胞内Ca2+浓度与PI3K、AKT、mTOR mRNA表达的相关性 模型组和治疗组肺成纤维细胞内Ca2+浓度与PI3K、AKT、mTOR mRNA表达均呈正相关(r分别为0.784、0.647、0.805,P均<0.01)。
3 讨论
IPF是以弥漫性肺泡炎和肺泡结构紊乱为特征, 最终导致肺间质纤维化的慢性进行性疾病。目前其发病机制仍不清楚,尚缺乏有效的治疗措施和治疗药物。气管内注射博来霉素是建立肺纤维化模型的常用方法,羟脯氨酸含量是反映IPF程度的金标准。本研究模型组各时间点肺组织羟脯氨酸含量均明显高于对照组,且随建模时间延长其含量逐渐增高;治疗组各时间点肺组织羟脯氨酸含量均明显低于模型组。上述结果提示,本研究成功建立了大鼠IPF模型,1,25-(OH)2D3对大鼠IPF的发生、发展有明显的抑制作用。
Ca2+作为重要的第二信使参与调节细胞的生理活动,如细胞的生长分化、增殖与凋亡等[13,14]。细胞内钙稳态一旦被破坏会引发一系列病理改变。本研究发现,在大鼠IPF发生过程中,模型组肺成纤维细胞内Ca2+浓度明显高于对照组,且随药物作用时间延长逐渐增高;说明IPF发生过程中,肺成纤维细胞内Ca2+调控系统出现异常,导致细胞内Ca2+浓度逐渐增高。治疗组肺成纤维细胞内Ca2+浓度明显低于模型组、明显高于对照组;说明1,25-(OH)2D3对肺成纤维细胞内Ca2+浓度升高有抑制作用,但不足以将Ca2+浓度降低到正常水平,提示1,25-(OH)2D3具有一定的稳定Ca2+稳态的作用。
PI3K是磷脂激酶家族中的重要一员,其活化产物PI3K作为第二信使能够与AKT蛋白的PH结构域作用,激活AKT蛋白,使活化的AKT从胞膜释放,转位到胞质中或胞核内,进一步磷酸化mTOR的Ser2448位点,激活mTOR,促进与细胞生长、分化相关蛋白的表达[15]。本研究发现,在IPF发生过程中,模型组肺成纤维细胞内PI3K、AKT、mTOR mRNA表达水平明显高于对照组,提示PI3K-AKT-mTOR信号通路与IPF发生相关。治疗组肺成纤维细胞中上述三种基因的mRNA表达量在给药21、28天时明显高于对照组,且在三个不同时间点均明显低于模型组;说明1,25-(OH)2D3在IPF发生、发展过程可抑制PI3K-AKT-mTOR信号通路。相关性分析结果表明,模型组和治疗组中肺成纤维细胞内Ca2+浓度与PI3K、AKT、mTOR三种基因的mRNA表达之间均存在显著正相关,说明在IPF发生过程和1,25-(OH)2D3治疗过程中Ca2+与PI3K-AKT-mTOR信号通路之间均具有一定的联系。
综上所述,1,25-(OH)2D3可抑制IPF的发生、发展;降低肺成纤维细胞内Ca2+浓度、抑制PI3K-AKT-mTOR通路可能是其作用机制。
[1] Sergew A, Brown KK. Advances in the treatment of idiopathic pulmonary fibrosis[J]. Expert Opin Emerg Drugs, 2015,20(4):537-552.
[2] 赵静,刘瑞娟.特发性肺间质纤维化的相关研究进展[J].山东医药,2014,54(7):88-90.
[3] 孔勤,陈民利.IPF发病机制的研究进展[J].中国比较医学杂志,2012,22(8):74-80.
[4] Jin X, Dai H, Ding K, et al. Rapamycin attenuates bleomycin-induced pulmonary fibrosis in rats and the of metalloproteinase-9 and tissue inhibitors of metalloproteinase-1 in lung tissue[J]. Chin Med J, 2014,127(7):1304-1309.
[5] 黄莺,叶燕青,施娟娟,等.肺纤维化形成过程中大鼠成纤维细胞对肺泡Ⅱ型上皮细胞的影响[J].武汉大学学报,2008,29(4):467-471.
[6] Mert H, Yoruk I, Ertekin A, et al. Vitamin levels in lung tissue of rats with bleomycin induced pulmonary fibrosis[J]. J Nutr Sci Vitaminol (Tokyo), 2009,55(2):186-190.
[7] 张宗梅,顾盼,易祥华,等.骨化三醇对博来霉素诱导的小鼠肺纤维化的影响[J].中华结合和呼吸杂志,2013,36(11):814-820.
[8] Nicolini A, Ferrari P, Kotlarova L, et al. The PI3K-AKt-mTOR pathway and new tools to prevent acquired hormone resistance in breast cancer[J]. Curr Pharm Biotechnol, 2015,16(9):804-815.
[9] Buschhausen L, Kamm M, Arns W, et al. Successful treatment of a severe case of idiopathic pulmonary fibrosis with rapamycin[J]. Med Klin, 2005,100(3):161-164.
[10] Gulati P, Gaspers LD, Dann SG, et al. Amino acids activate mTOR complex 1 via Ca2+/VCaM signaling to hVps34[J]. Cell Metab, 2008,7(5):456-465.
[11] Ramirez A, Ramadan B, Ritzenthaler JD, et al. Extracellular cysteinecystine redox potential controls lung fibroblast proliferation and matrix through upregulation of transforming growth factor-beta[J]. Am J Physiol Lung Cell Mol Physiol, 2007,293(4):972-981.
[12] Matheu V, Bäck O, Mondoc E, et al. Dual effects of vitamin D-induced alteration of TH1/TH2 cytokine: enhancing IgE production and decreasing airway eosinophilia in murine allergic airway disease[J]. J Allergy Clin Immunol, 2003,112(3):585-592.
[13] Armant DR. Intracellular Ca2+signaling and preimplantation development[J]. Adv Exp Med Biol, 2015,843(10):151-171.
[14] Chandra V, Albagli-Curiel O, Hastoy B, et al. RFX6 regulates insulin secretion by modulating Ca2+homeostasis in human β cells[J]. Cell Rep, 2014,9(6):2206-2218.
[15] Fruman DA, Rommel C. PI3K and cancer: lessons, challenges and opportunities[J]. Nat Rev Drug Discov, 2014,13(2):140-156.
Effects of 1, 25-(OH)2D3on idiopathic pulmonary fibrosis of rats and its mechanism
DONGHongliang1,LIUNaiguo,MIAOShuang,ZHENGJing,NINa,WANGNan
(1TheAffiliatedHospitalofBinzhouMedicalUniversity,Binzhou256600,China)
Objective To observe the effects of 1, 25-(OH)2D3on idiopathic pulmonary fibrosis (IPF) of rats, and to investigate its mechanism. Methods Ninety male SD rats were randomly divided into the model group, treatment group and control group (n=30 each). Bleomycin (5 mg/kg) was injected to the trachea of rats to establish the model of pulmonary fibrosis in the model group and treatment group, while the control group was injected with normal saline (200 μL in each). From the following day, rats in the treatment group and model group received 1, 25-(OH)2D3(2 μg/kg) and solvant (200 μL for each), respectively and once every other day. The control group was treated with normal saline (200 μL for each). Ten mice in each group were killed randomly on day 14, 21 and 28. The hydroxyproline content of lung tissues was measured by basic-hydrolysis method. Lung fibroblasts were separated from lung tissues and labeled by Fluo-3AM, then we used Laser scanning confocal microscope to detect the concentration of Ca2+. The mRNA levels of PI3K, AKT and mTOR in the lung fibroblasts were tested by real-time PCR. Results The hydroxyproline content of lung tissues, the Ca2+concentration and expression of PI3K, AKT and mTOR in lung fibroblasts were increased in the model group as compared with that of the control group on day 14, 21 and 28. The above indicators of treatment group were reduced significantly as compared with those of the model group (P<0.05 orP<0.01). Ca2+concentration was positively correlated with mRNA expression levels of three genes in the model group and treatment group (r=0.784, 0.647, 0.805, allP<0.01). Conclusion 1, 25-(OH)2D3inhibits the occurrence and development of IPF in rats, and its mechanism may be the reduction of Ca2+concentration and inhibition of PI3K-AKT-mTOR pathway.
idiopathic pulmonary fibrosis; 1, 25-(OH)2D3; calcium ion; PI3K-AKT-mTOR signaling pathway; lung fibroblasts
山东省自然科学基金资助项目(ZR2011HM062);滨州医学院科技计划项目(BY2015KJ39)。
董洪亮(1987-),男,初级检验师,研究方向为间质性肺病的分子生物学机制。E-mail: hongliang.234@163.com
刘乃国(1966-),男,教授,研究方向为间质性肺病的分子生物学机制。E-mail: liunaiguo1966@163.com
10.3969/j.issn.1002-266X.2016.28.006
R563
A
1002-266X(2016)28-0019-04
2016-03-15)
