玫瑰花蕾萃取物对嗅球毁损大鼠梨形皮质神经元损伤修复的影响及机制
2016-05-10卞林翠王敏贺利敏徐金勇李光武
卞林翠,王敏,贺利敏,徐金勇,李光武
(安徽医科大学神经生物学研究所,合肥230032)
玫瑰花蕾萃取物对嗅球毁损大鼠梨形皮质神经元损伤修复的影响及机制
卞林翠,王敏,贺利敏,徐金勇,李光武
(安徽医科大学神经生物学研究所,合肥230032)
目的 观察玫瑰花蕾萃取物对嗅球毁损大鼠梨形皮质神经元损伤修复的影响,探讨其作用机制。方法 将60只成年健康雄性SD大鼠随机分为对照组(10只)、模型组(40只)及玫瑰花蕾组(10只)。对照组不做任何处理。模型组及玫瑰花蕾组采用探针破坏嗅球。嗅球毁损后1天,玫瑰花蕾组行玫瑰花蕾萃取物吸嗅,每次持续吸嗅1 h、2次/d,连续14天。分别取对照组、模型组嗅球毁损后24 h、72 h、7 d、14 d(每个时间10只)及玫瑰花蕾组吸嗅14天后脑组织,常规切片,采用尼氏染色法检测各组梨形皮质神经元损伤修复情况,采用免疫组化法检测梨形皮质谷氨酸(Glu)、γ-氨基丁酸(GABA)表达。结果 对照组梨形皮质神经元尼式小体灰度值为87.32±3.14,模型组毁损24 h、72 h、7 d、14 d时灰度值分别为101.76±4.52、110.76±2.78、98.35±2.69、94.26±3.01,玫瑰花蕾组为88.47±4.33;模型组毁损72 h时尼式小体灰度值大于对照组和玫瑰花蕾组(P均<0.05)。与对照组比较,模型组毁损72 h、7 d时梨形皮质Glu表达减少、GABA表达增加;与模型组毁损72 h、7 d 比较,玫瑰花蕾组Glu表达增加、GABA表达减少;两组比较P均<0.05。结论 玫瑰花蕾萃取物吸嗅对嗅球毁损大鼠梨形皮质神经元损伤修复具有促进作用,抑制Glu释放、促进GABA释放可能是其作用机制。
玫瑰花蕾萃取物;嗅球毁损;梨形皮质;神经递质;嗅觉通路;神经元再生
梨形皮质是哺乳动物嗅觉皮质中最大的一个区域,可以接收来自嗅球和其他二级嗅觉皮层的传入纤维[1]。从嗅球发出的僧帽细胞和丛毛细胞通过外侧嗅束投射至梨形皮质,形成树状分支。研究发现,神经递质参与嗅觉的形成与传导,其中谷氨酸(Glu)和γ-氨基丁酸(GABA)在嗅觉系统中发挥重要作用[2,3]。当嗅球毁损后嗅觉信息传导受到阻滞,嗅觉神经发生溃变,神经回路发生改变。玫瑰花蕾萃取物具有提神醒脑、活血化瘀、通经活络、促进血液循环等功效。2013年10月~2015年11月,本研究观察了玫瑰花蕾萃取物吸嗅对嗅球毁损大鼠梨形皮质神经元损伤修复的影响,现分析结果并探讨其机制。
1 材料与方法
1.1 材料 成年健康雄性SD大鼠60只,体质量220~250 g,由安徽医科大学动物中心提供,动物合格证号:SCXK(皖)2011-002。脑立体定位仪(型号NARISHIGE,TYPE:SN-2,NO:8208,日本),生物组织石蜡包埋机(中国湖北),切片机(Leica石蜡切片机,型号RM2135,德国),显微镜(Nikon80i型,日本)等。玫瑰花蕾萃取物(安徽澳德瑞生物科技有限公司),浓缩型DAB试剂盒(北京中杉金桥生物技术有限公司),兔抗Glu抗体试剂盒、兔抗GABA抗体试剂盒(北京博奥森生物技术有限公司)。
1.2 模型制作及处理 将60只SD大鼠随机分为三组,分别为对照组10只、模型组40只及嗅球毁损后玫瑰花蕾萃取物吸嗅组(玫瑰花蕾组)10只。对照组不做任何处理。模型组及玫瑰花蕾组建立嗅球毁损模型:大鼠经10%水合氯醛腹腔注射麻醉(3 mL/kg),将头部固定于脑立体定位仪,于鼻额缝部位沿头颅正中切开头部皮肤、皮下软组织及骨膜,暴露颅骨、前囟,参考《The Rat Brain》(第三版,George Paxinos, Charles Watson)[4]定位嗅球,用电钻在对应嗅球的颅骨处钻一孔(直径25 mm左右),探针搅动破坏嗅球,并将残余组织吸出,创口用可吸收性明胶海绵填塞止血,缝合创口。嗅球毁损后1天,玫瑰花蕾组行玫瑰花蕾萃取物吸嗅:将玫瑰花蕾萃取物放入吸嗅桶底部,上面放置带有很多小孔的薄塑料隔板,让玫瑰花蕾萃取物充分挥发弥漫在整个吸嗅桶中,再将大鼠放在隔板上。每次持续吸嗅1 h,2次/d,连续14天。
分别取对照组、玫瑰花蕾组(吸嗅14天)所有大鼠,模型组于模型制作24 h、72 h、7 d、14 d分别取大鼠10只,用10%水合氯醛腹腔注射麻醉(3 mL/kg),打开胸腔暴露心脏,自左心室插管至升主动脉,剪开右侧心耳,快速滴注生理盐水至右心房流出无色液体为止。迅速开颅取出整个大脑,放入4%多聚甲醛溶液中持续固定48 h。将固定好的脑组织分别进行脱水、透明、浸蜡、包埋。对照大鼠脑立体定位图谱[4],用切片机进行连续冠状切片,片厚5 μm,每3片取1片,90 ℃烤片15 min,收储备用。
1.3 相关指标观察
1.3.1 梨形皮质神经元损伤修复情况 采用尼氏染色法。取各组脑组织切片脱蜡至水,将切片置于5 g/L硫瑾水溶液,然后置入37 ℃温箱20 min,取出切片冷却,蒸馏水洗涤,乙醇分色,伊红乙醇溶液染色,脱水,透明,封片,拍片。显微镜下观察各组梨形皮质尼式小体的形态及数量,采用Image-Pro-Plus6.0彩色图像分析系统分析各组尼式小体灰度值。
1.3.2 梨形皮质Glu、GABA表达 采用免疫组化法。取各组脑组织切片脱蜡至水,抗原修复,加入一抗(兔抗Glu抗体/兔抗GABA抗体,稀释浓度均为1∶150)4 ℃过夜,滴加PV-6004于37 ℃孵育30 min,DAB溶液显色(镜下控制),苏木素复染5 min,梯度乙醇脱水,二甲苯透明,封片,镜下观察。Glu、GABA阳性细胞呈棕色,胞体呈圆形或椭圆形。显微镜下定位梨形皮质,使用Image-Pro-Plus6.0彩色图像分析系统准确分割阳性区域,检测各组脑组织梨形皮质Glu、GABA灰度值。
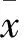
2 结果
2.1 各组梨形皮质神经元损伤修复情况 尼氏染色结果显示,对照组梨形皮质神经元形态正常,核膜、核仁清晰。模型组嗅球毁损24、72 h,梨形皮质神经元尼氏染色逐渐减弱,提示神经元发生溃变;嗅球毁损7天,梨形皮质神经元尼氏染色较毁损24、72 h逐渐增强,提示神经元开始重建;玫瑰花蕾组梨形皮质神经元尼氏染色程度接近对照组水平。对照组梨形皮质神经元尼式小体灰度值为87.32±3.14,模型组毁损24 h、72 h、7 d、14 d时灰度值分别为101.76±4.52、110.76±2.78、98.35±2.69、94.26±3.01,玫瑰花蕾组为88.47±4.33;模型组毁损72 h时尼式小体灰度值大于对照组和玫瑰花蕾组(P均<0.05)。见插页Ⅱ图1。
2.2 各组梨形皮质Glu、GABA表达比较 与对照组比较,模型组毁损72 h、7 d时梨形皮质Glu表达减少、GABA表达增加;与模型组毁损72 h、7 d 比较,玫瑰花蕾组Glu表达增加、GABA表达减少;两组比较P均<0.05。见表1。

表1 各组梨形皮质Glu、GABA表达比较(灰度值,
注:与对照组比较,#P<0.05;与模型组7 d比较,*P<0.05;与模型组72 h比较,△P<0.05。
3 讨论
嗅球与多个嗅觉高级中枢之间存在广泛的纤维联系,从嗅球发出的僧帽细胞和丛状细胞的轴突以嗅束的方式投射到初级嗅皮质的嗅前核、嗅结节、梨形皮质、扣带回前区、内侧嗅皮层[5]。梨形皮质是哺乳动物嗅觉信息处理过程中到达的第一层皮质,是感知气味至关重要的旧皮质。梨形皮质与周围脑区的广泛纤维联系是其发挥正常生理功能和参与各种嗅觉信息处理的结构基础[6],一旦出现病变,将严重影响嗅觉信息的传递和处理[7,8];神经退行性疾病如阿尔茨海默病患者对气味识别障碍即源于梨形皮质功能紊乱。神经元的功能和尼氏小体密切相关。正常情况下各种神经元的尼氏小体均有其特定的数量和特征性的形态分布,而在病理状态下(如神经元发生溃变时)尼氏小体减少甚至消失[9]。目前达成共识的成年哺乳动物神经系统中神经元再生重建的区域是室管膜下区和海马齿状回。Sahay等[10]认为,齿状回神经再生对一系列依赖海马的认知功能非常重要。Lepousez等[11]研究表明,室管膜下区神经再生可调节嗅觉,修复皮层损伤,防御溃变向更高的嗅觉处理中心扩散。梨形皮质具有神经再生的潜能,嗅球毁损后出现的新生神经元可能会在梨形皮质第二层最终分化为锥体神经元。与海马和室管膜下区相比,嗅觉皮质区域的梨形皮质神经元再生受到的关注较少,但其在嗅觉传导过程中的重要作用无可替代。在癫痫和退行性神经病变的病理过程中常伴随嗅觉的损伤和梨形皮质形态的改变。有研究指出,梨形皮质中联合突触的可塑性存在于小鼠的整个生命历程中,无论是在早期关键期还是在关键期之外,联合突触的可塑性都未曾改变[12]。本研究采用探针破坏大鼠嗅球,通过尼氏染色发现损伤后24、72 h梨形皮质(尤其是第二层)大量锥体细胞发生溃变,尼式染色减弱,尼式小体数量减少;损伤7 d时梨形皮质锥体细胞溃变后重建,尼式小体染色逐渐增强,尼式小体数量有所增加;上述结果提示,损毁嗅球可导致梨形皮层神经元发生损伤,但损伤神经元可再生、自行修复,说明梨形皮层神经元具有损伤后再生能力。
芳香疗法是通过芳香物质中的小分子物质(芳香小分子)刺激嗅觉来达到对嗅觉的调节及对嗅觉信息传递的促进作用。精油是从芳香植物中蒸馏萃取出来的,是分子量很小的活性混合物,具有高渗透性、高挥发性、高流动性等特点,可通过呼吸进入动物和人体内。玫瑰花蕾萃取物为芳香疗法常用芳香物质,是由多种芳香族化合物组成的混合物,其主要成分为芳樟醇、香茅醇甲酸酯、牻牛儿醇、玫瑰醚、乙酸乙酯、苯甲醇、甲基丁香油脂、十五烷、β-苯乙醇、橙花醇、α-白苏烯、β-突厥酮等[13,14]。芳香小分子可以通过嗅觉通路直接刺激下丘脑垂体,进而分泌激素及神经调节物质等,以调节机体功能。Igarashi等[15]研究发现,玫瑰精油(主要成分为玫瑰花蕾萃取物)可使人在生理和心理上感到放松,增加大脑皮质活动。Kiecolt Glaser等[16]研究发现,芳香小分子可恢复刺激诱导的免疫抑制,调节神经内分泌。本实验室前期研究发现,芳香物质吸嗅对改善嗅觉通路有益[17]。本研究中玫瑰花蕾组梨形皮质神经元尼氏染色程度接近对照组水平,提示玫瑰花蕾萃取物吸嗅能促进嗅球毁损后梨形皮质神经元再生,对嗅球损伤后的嗅觉通路修复具有一定的促进作用。
中枢神经系统中含有多种神经递质,其相互协调、相互作用,构建神经递质平衡系统,维持机体各种生理活动的稳定。其中兴奋性神经递质Glu和抑制性神经递质GABA参与嗅觉的形成与传导[18],二者在嗅球和梨形皮质发挥正常生理功能和可塑性方面非常重要[19]。嗅球毁损可引起嗅觉通路的改变及神经递质的变化,嗅球毁损后不同脑区Glu、GABA神经元对刺激的反应各不相同。本研究结果显示,模型组嗅球毁损24、72 h梨形皮质Glu表达减少、GABA表达增加,原因主要为嗅球受损导致邻近神经组织兴奋性增强,促进Glu释放、抑制GABA释放,诱导兴奋性毒性损伤,进一步加重梨形皮质神经元的损伤;与毁损嗅球24、72 h比较,毁损嗅球7、14 d时梨形皮质Glu表达逐渐增加、GABA表达逐渐降低,提示随着神经元的再生修复,Glu释放逐渐减少、GABA释放逐渐增多,兴奋性毒性损伤逐渐降低;玫瑰花蕾组Glu及GABA表达与对照组比较无统计学差异,且GABA表达高于模型组嗅球毁损14 d、GABA表达低于模型组嗅球毁损14 d,提示玫瑰花蕾萃取物吸嗅可抑制Glu释放、促进GABA释放。
综上所述,玫瑰花蕾萃取物吸嗅对嗅球毁损大鼠梨形皮质神经元损伤修复具有促进作用,抑制Glu释放、促进GABA释放可能是其作用机制。
[1] Dan DS, Axel R. Representations of odor in the piriform cortex[J]. Neuron, 2009,63(6):854-864.
[2] Kim J, Son Y, Kim J, et al. Developmental and degenerative modulation of GABAergic transmission in the mouse hippocampus[J]. Int J Dev Neurosci, 2015,47(Part B):320-332.
[3] Norimitsu S, Bekkers J M. Inhibitory interneurons in the piriform cortex[J]. Clin Exp Pharmacol Physiol, 2007,34(10):1064-1069.
[4] Zhang F, Tang MH, Chen LJ, et al. Simultaneous quantitation of aconitine, mesaconitine, hypaconitine, benzoylaconine, benzoylmesaconine and benzoylhypaconine in human plasma by liquid chromatography-tandem mass spectrometry and pharmacokinetics evaluation of "SHEN-FU" injectable powd[J]. J Chromatogr, 2008,873(2):173-179.
[5] Sosulski DL, Bloom ML, Cutforth T, et al. Distinct representations of olfactory information in different cortical centres.[J]. Nature, 2011,472(7342):213-216.
[6] Spors H, Albeanu DF, Murthy VN, et al. Illuminating vertebrate olfactory processing[J]. J Neurosci, 2012,32(41):14102-14108.
[7] Bekkers JM, Suzuki N. Neurons and circuits for odor processing in the piriform cortex[J]. Trends Neurosci, 2013,36(7):429-438.
[8] Uchida N, Poo C, Haddad R. Coding and transformations in the olfactory system.[J]. Annu Rev Neurosci, 2014, 37(Suppl):363-385.
[9] 郭以河,赵梅兰,彭瑞云,等.尼氏小体染色方法的改进及其在神经病理学研究中的应用[J].实用医技杂志,2003,10(6):605-606.
[10] Sahay A, Scobie KN, Hill AS, et al. Increasing adult hippocampal neurogenesis is sufficient to Improve pattern separation[J]. Nature, 2011,472(7344):466-470.
[11] Lepousez G, Valley MT, Lledo PM. The impact of adult neurogenesis on olfactory bulb circuits and computations[J]. Annu Rev Physiol, 2013,75(1):339-363.
[12] Petr Znamenskiy AMZ. Corticostriatal neurones in auditory cortex drive decisions during auditory discrimination[J].Nature, 2013, 497(7450):482-485.
[13] 蔡芳,孙素琴,闫文蓉,等.红外光谱法与药用玫瑰真伪的分析与鉴定[J].光谱学与光谱分析,2009,29(9):2429-2433.
[14] Jalali-Heravi M, Parastar H, Sereshti H. Development of a method for analysis of Iranian damask rose oil: combination of gas chromatography-mass spectrometry with chemometric techniques[J]. Analytica Chimica Acta, 2008,623(1):11-21.
[15] Igarashi M, Ikei H, Song C, et al. Effects of olfactory stimulation with rose and orange oil on prefrontal cortex activity[J]. Complement Ther Med, 2014,22(6):1027-1031.
[16] Kiecolt Glaser JK, Graham JE, Malarkey WB, et al. Olfactory influences on mood and autonomic, endocrine, and immune function[J]. Psychoneuroendocrinology, 2008,33(3):328 -339.
[17] 陈军,徐金勇,徐蓉,等.花梨木精油通过嗅觉通路改善小鼠抑郁样行为及其神经递质[J].江苏医药,2012,38(6):657-659.
[18] Yoshimura RF, Tran MB, Hogenkamp DJ, et al. Limited central side effects of a β-subunit subtype-selective GABAA receptor allosteric modulator[J]. J Psychopharmacology, 2014,28(5):472-478.
[19] Suzuki N, Bekkers JM. Neural coding by two classes of principal cells in the mouse piriform cortex.[J]. J Neurosci, 2006, 26(46):11938-11947.
Effect of rosebud extracts on piriform cortical neuronal damage and repair in olfactory bulb damaged rats and its mechanism
BIANLincui,WANGMin,HELimin,XUJinyong,LIGuangwu
(InstituteofNeurobiologyofAnhuiMedicalUniversity,Hefei230032,China)
Objective To investigate the effect of rosebud extracts on piriform cortical neuronal damage and repair in olfactory bulb damaged rats and its mechanism. Methods Healthy adult male SD rats were randomly divided into three groups, namely the control group (n=10), model group (n=40) and rosebud group (n=10). Rats in the control group were not treated. Using probes agitation to damage the olfactory bulb of rats in the model group and rosebud group. One day after the damage of the olfactory bulb, rats in the rosebud group were prepared to smell rosebud extracts, each time for 1 h, twice a day and for 14 d. The brain tissues were collected from rats in the model group after the damage of the olfactory bulb 24 h, 72 h, 7 d and 14 d (each time, ten rats) as well as the rosebud group 14 d after the damage. After conventional section, we used Nissl staining to detect the piriform cortical neuronal damage and repair. Immunohistochemical staining was carried out to detect the Glu and GABA expression of piriform cortex. Results The Nissl body gray value of the control group was 87.32±3.14, and they were respectively 101.76±4.52, 110.76±2.78, 98.35±2.69 and 94.26±3.01 after olfactory bulb damage of 24 h, 72 h, 7 d and 14 d. The rosebud group was 88.47±4.33, and the Nissl body gray value in 72 h after olfactory bulb damage was higher than that of the control group (allP<0.05). Compared with the control group, the Glu expression gray value of piriform cortex at 72 h and 7 d after olfactory bulb damage was decreased, but the GABA expression gray value was increased in the model group. The Glu expression gray value of piriform cortex was increased and the GABA expression gray value was decreased in the rosebud group as compared with that of the model group at 72 h and 7 d after olfactory bulb damage. Significant difference was found between these two groups (allP<0.05). Conclusion Rosebud extracts play an important role in promoting the piriform cortical neuronal damage and repair in olfactory bulb damaged rats, and its mechanism may be associated with the inhibiting release of Glu, and promoting release of GABA.
rosebud extracts; olfactory bulb damage; piriform cortical; neurotransmitter; olfactory pathway; neurogenesis
国家自然科学基金资助项目(81000589)。
卞林翠(1991-),女,在读硕士,研究方向为嗅觉通路与芳香疗法。E-mail: Lincuibian@163.com
李光武(1962-),男,副教授,研究方向为嗅觉通路与芳香疗法、神经药理学等。E-mail: guangwuli@sina.com
10.3969/j.issn.1002-266X.2016.28.002
R493
A
1002-266X(2016)28-0005-04
2016-01-19)
