大黄酸对马兜铃酸A引起的斑马鱼肾脏损伤的保护作用
2016-05-10刘可春王希敏韩利文张姗姗何秋霞陈锡强王荣春
王 雪,刘可春,王希敏,韩利文,张姗姗,何秋霞,陈锡强,韩 建,王荣春
(山东省科学院生物研究所,山东省科学院斑马鱼药物筛选平台,山东省生物传感器重点实验室,山东济南 250014)
大黄酸对马兜铃酸A引起的斑马鱼肾脏损伤的保护作用
王 雪,刘可春,王希敏,韩利文,张姗姗,何秋霞,陈锡强,韩 建,王荣春
(山东省科学院生物研究所,山东省科学院斑马鱼药物筛选平台,山东省生物传感器重点实验室,山东济南 250014)
目的 观察大黄酸在马兜铃酸A引起的斑马鱼肾脏损伤中的作用。方法 将肾脏发育完成的斑马鱼仔鱼(4dpf)用马兜铃酸A处理24 h,造成马兜铃酸肾病模型,同时加入大黄酸处理,然后观察仔鱼的表型变化情况,并用肌酐检测试剂盒测定仔鱼组织中的肌酐含量,利用qPCR对仔鱼组织中的炎性相关因子(cox2a)和致纤维化因子(TGFβ-1)进行定量检测。结果 马兜铃酸A处理24h后,部分仔鱼出现眼周水肿及血循环系统异常,表现为心跳微弱,心腔缩小,血流缓慢甚至停滞,发生率具有剂量相关性,马兜铃酸处理组仔鱼组织中的肌酐含量比对照组明显升高,cox2a和TGFβ-1表达量也比对照组明显上升,同时加入大黄酸能降低异常仔鱼所占比例,降低组织肌酐含量,并下调cox2a的表达,但对马兜铃酸引起的TGFβ-1的上升无影响。结论
大黄酸对马兜铃酸引起的斑马鱼肾脏损伤有一定的保护作用。
马兜铃酸;斑马鱼;仔鱼;肾脏;大黄酸;肌酐
大黄酸(rhein,Rhe)属单蒽核类1,8-二羟基蒽醌衍生物,是大黄、何首乌、虎杖等多种中药的主要有效成分之一,药理作用广泛。在糖尿病肾病大鼠,大黄酸能下调血清中IL-1β、IL-12和TNF-α等细胞因子的浓度,减轻炎症反应,减少糖尿病肾病大鼠尿蛋白泄漏,改善血脂异常,在糖尿病肾病各期发挥多靶点、多层次的治疗作用[1]。大黄酸对肾脏纤维化形成的多个环节有治疗作用。病理状态下,以转化生长因子TGF-β1为主导的细胞因子网络激活成纤维细胞为肌成纤维细胞,并能将许多肾脏固有细胞如肾小管上皮细胞、内皮细胞等转化为肌成纤维细胞,导致肾脏纤维化发生。大黄酸能抑制促纤维化因子TGF-β1的表达,阻止间质成纤维细胞的激活,阻断肾间质的纤维化进程,在多种肾脏疾病中发挥肾保护作用[2]。在亚慢性镉染毒小鼠,大黄酸对肝脏及肾损伤表现出一定的保护作用[3]。
马兜铃酸(aristolochic acid,AA)对多种动物种属具有肾毒性,主要损伤肾小管上皮细胞,导致肾间质纤维化及肾萎缩,并出现低分子蛋白尿、严重贫血症状,被称为“马兜铃酸肾病”。实验中用马兜铃酸处理发育早期的斑马鱼,会引起仔鱼水肿和肾脏形态功能异常,引起不可逆性肾脏损伤并终至仔鱼死亡[4]。目前,临床上对“马兜铃酸肾病”仅以预防为主,尚未找到有效的治疗药物和方法。本研究在利用马兜铃酸A进行染毒处理造成斑马鱼肾脏损伤的基础上,加用大黄酸进行干预,通过检测肾脏功能相关指标的变化,研究大黄酸在马兜铃酸肾病中的作用,并为利用斑马鱼模型筛选具有潜在治疗肾脏损伤活性的化合物提供方法和思路。
1 材料
1.1 实验动物 实验所用为AB系野生型斑马鱼,在水温28.5℃,保持14 h光照/10 h黑暗光照周期条件下养殖,每日于9:00 am和3:00 pm喂食两次颗粒饲料。排卵前日将♀♂斑马鱼成鱼按2∶1放入具筛板的产卵缸内,中间放置隔板,次日亮灯前抽去隔板,在光照刺激下排卵后,收集鱼卵,用培养水冲洗3遍,然后放入新培养水中,在28.5℃,相同光照条件下发育至4 d大小。
1.2 试剂 马兜铃酸A(MW:341.27,纯度≥99.0%)与大黄酸(MW:284.22,纯度≥99.0%),均购自于中国食品药品检定研究院,分别用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解配制成储液。TR-Izol试剂(美国Invitrogen公司),PrimeScriptTM1st Strand cDNA合成试剂盒(大连宝生物工程有限公司),iTaq Universal SYBR Green Supermix(美国Bio-Rad公司),Creatinine Assay kit ab65340与10 ku Spin Column ab93349(Abcam),其余试剂均为国产分析纯。
胚胎培养水成分为:NaCl 5 mmol·L-1,KCl 0.17 mmol·L-1,CaCl20.4 mmol·L-1,MgSO40.16 mmol·L-1,用去离子水配制。
荧光定量PCR仪CFX96(美国Bio-Rad);倒置显微镜IX51(日本Olympus),Spectra MR型酶标仪(美国Dynex),MICCRA D-1匀浆器(德国ART)
2 方法
2.1 斑马鱼分组与给药 选用6孔细胞培养板进行实验。吸取适量马兜铃酸A储液至孔内,加入培养水进行稀释,分别得到20 μmol·L-1和40 μmol ·L-1马兜铃酸A溶液作损伤组;向孔内同时加入马兜铃酸A与大黄酸储液,用培养水稀释得到含上述浓度马兜铃酸A与40 μmol·L-1大黄酸的混合液作为治疗组;马兜铃酸A与大黄酸浓度由预实验结果确定。向孔内加入含DMSO的培养水(DMSO含量≤0.5%V/V)作为溶剂对照组,小心混匀各孔溶液。随机选取发育4dpf的斑马鱼仔鱼,移入上面各孔溶液内,每孔中放置30尾仔鱼,每孔同时做3个平行重复,然后放于恒温控光培养箱内,孵育24 h。
处理结束后,在倒置显微镜下观察各组仔鱼形态,记录仔鱼异常情况并计数,拍照。
2.2 斑马鱼仔鱼组织中肌酐含量检测 肌酐是肌肉的代谢产物,由前体化合物磷酸肌酸转化而成,正常情况下,每日产生的肌酐主要由肾小球滤过排出体外。肌酐的含量变化主要由肾脏滤过能力决定,肾功能受损时,肌酐在体内蓄积,含量升高。
实验中收集各处理组与对照组中存活仔鱼,用纯净水充分冲洗后,移入2 mL离心管,尽量吸净水分,然后向每管加入500 μL去离子水,冰浴匀浆。将匀浆样品加入10 ku Spin Column中,4℃,10 000 ×g,离心10min,除去样品中的蛋白成分,收集滤液。然后按Creatinine Assay kit操作步骤,吸取滤液与肌酐反应液混合,37℃,反应1 h,于570 nm处读取OD值。根据肌酐标准曲线回归方程,计算各样品中的肌酐含量,进一步计算得到各组斑马鱼仔鱼组织中的肌酐含量。
2.3 qPCR检测斑马鱼仔鱼组织TGFβ-1、cox2a基因的表达量 马兜铃酸导致肾脏损害的重要特征是肾间质纤维化,同时伴有炎症反应发生。在利用斑马鱼为模型进行马兜铃酸肾病研究中,已检测到促炎性因子cox2a与致纤维化因子TGFβ-1表达量上升,说明TGFβ-1与cox2a这两种因子的表达水平与马兜铃酸肾病发病机制及病程进展密切相关。
实验中收集对照组和处理组的存活斑马鱼仔鱼,用灭菌水冲洗后,分别加入TRIzol试剂提取仔鱼组织的总RNA,逆转录成cDNA,取1 μL cDNA产物进行qPCR,检测各组斑马鱼仔鱼组织中TGFβ-1、cox2a基因的表达情况,以β-actin作为内参基因。qPCR反应体系为20 μL,反应条件为:95℃30 s,95℃5 s,60℃40 s,40个循环。采用2-△△Cq法分析基因的相对表达量:△Cq(处理组)=Cq(处理组目的基因)-Cq(对照组内参基因),△Cq(对照组)=Cq(对照组目的基因)-Cq(对照组内参基因),△△Cq=△Cq(处理组)-△Cq(对照组),以2-△△Cq表示处理组目的基因的表达倍数。
β-actin:forward 5′AGAGCTATGAGCTGCCT-GACG 3′;reverse 5′CCGCAAGATTCCATACCCA 3′;cox2a:forward 5′ATCCTGTTGTCAAGGTCCCA 3′;re-verse 5′CAAGGGTGCGGGTGTAAT 3′;TGFβ-1:for-ward 5′GAACTCGCTTTGTCTCCA 3′;reverse 5′TACAGTCGCAGTATAACCTCA 3′。
2.4 统计学分析 采用SPSS 13.0对实验数据进行分析,各组均值用±s表示,采用独立样本t检验法比较组间差异的显著性。
3 结果
3.1 不同处理组斑马鱼仔鱼的表型与存活情况发育4 dpf的斑马鱼仔鱼经马兜铃酸A处理24 h后,部分仔鱼出现明显的眼周水肿表现,发生率与马兜铃酸A浓度呈相关性。当马兜铃酸A浓度升高至40μmol·L-1时,除眼周水肿外,斑马鱼仔鱼的血循环系统也出现中毒症状,表现为心跳微弱、心腔缩小,血流缓慢甚至停滞(Fig 1),仔鱼的活动能力明显降低。用40 μmol·L-1大黄酸与马兜铃酸A同时对斑马鱼仔鱼进行处理,24 h后,出现上述异常的仔鱼比例较损伤组均有显著降低。处理时间为24 h时,各处理组仔鱼的死亡率与对照组比较差异无显著性(Tab 1)。
3.2 斑马鱼仔鱼组织中肌酐含量 在发育5 dpf时,正常对照组斑马鱼仔鱼组织中的肌酐含量值为每50尾(153.51±7.1)nmoL。4 dpf的斑马鱼仔鱼经马兜铃酸A(20 μmol·L-1)和大黄酸(40 μmol· L-1)处理24 h后,损伤组与治疗组仔鱼组织中肌酐含量值与对照组相比无明显变化。在40 μmol· L-1马兜铃酸A处理组,斑马鱼仔鱼组织肌酐含量值升高至每50尾(183.30±8.2)nmoL,高于对照组,差异有显著性。大黄酸治疗组仔鱼组织肌酐值为每50尾(159.23±5.6)nmoL,比损伤组有明显降低。

Tab 1 Defective phenotypes and mortality of zebrafish larvae after exposure to aristolochic acid and rhein
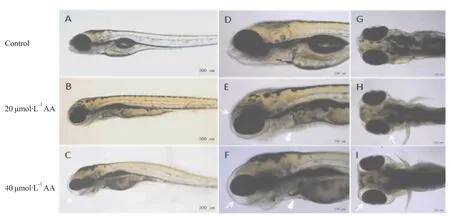
Fig 1 Phenotypes of zebrafish larvae after aristolochic acid treatment

Fig 2 Creatinine value in zebrafish larvae of different treatment groups
3.3 斑马鱼仔鱼TGFβ-1、cox2a基因的表达 经20 μmol·L-1马兜铃酸A处理24 h后,斑马鱼仔鱼组织中cox2a表达水平为对照组的(4.43±0.475)倍,差异有显著性,同时加入大黄酸能明显降低cox2a表达水平,但与对照组相比,仍有明显升高。在马兜铃酸A浓度为20 μmol·L-1时,损伤组与大黄酸治疗组TGFβ-1的表达量与对照组均无明显差异。马兜铃酸A浓度为40 μmol·L-1时,处理24 h后,仔鱼组织中cox2a、TGFβ-1的表达量比对照组均有明显升高,分别为对照组的(9.55±0.407)和(1.59±0.074)倍,大黄酸治疗组cox2a的表达仍保持在较高水平,与损伤组差异无显著性。见Fig 3。
4 讨论
目前已知,服用含马兜铃酸成分的中药材会严重损害肾脏功能,并导致肾脏癌变发生。马兜铃酸引起肾脏损伤的机制随剂量不同而有差别,在大剂量下,马兜铃酸直接引起肾小管上皮细胞急性坏死,进而发生肾间质纤维化;长期小剂量摄入时,马兜铃酸与细胞DNA形成AA-DNA加合物,引起DNA断裂,导致肾小管损伤和肾间质纤维化。实验中发现,用马兜铃酸处理发育早期的斑马鱼胚胎,会引起胚胎肾脏形态发育异常和肾脏功能受损[4]。斑马鱼发育周期短,受精72 hpf时,肾脏发育已经完成,具备成熟的滤过排泄功能。在胚胎期,斑马鱼肾脏在进化阶段上属于前肾,前肾结构相对简单,仅由一对肾单位组成,但在分子水平和生物功能上与哺乳动物类相似,是进行化合物肾脏毒性研究的理想模型。
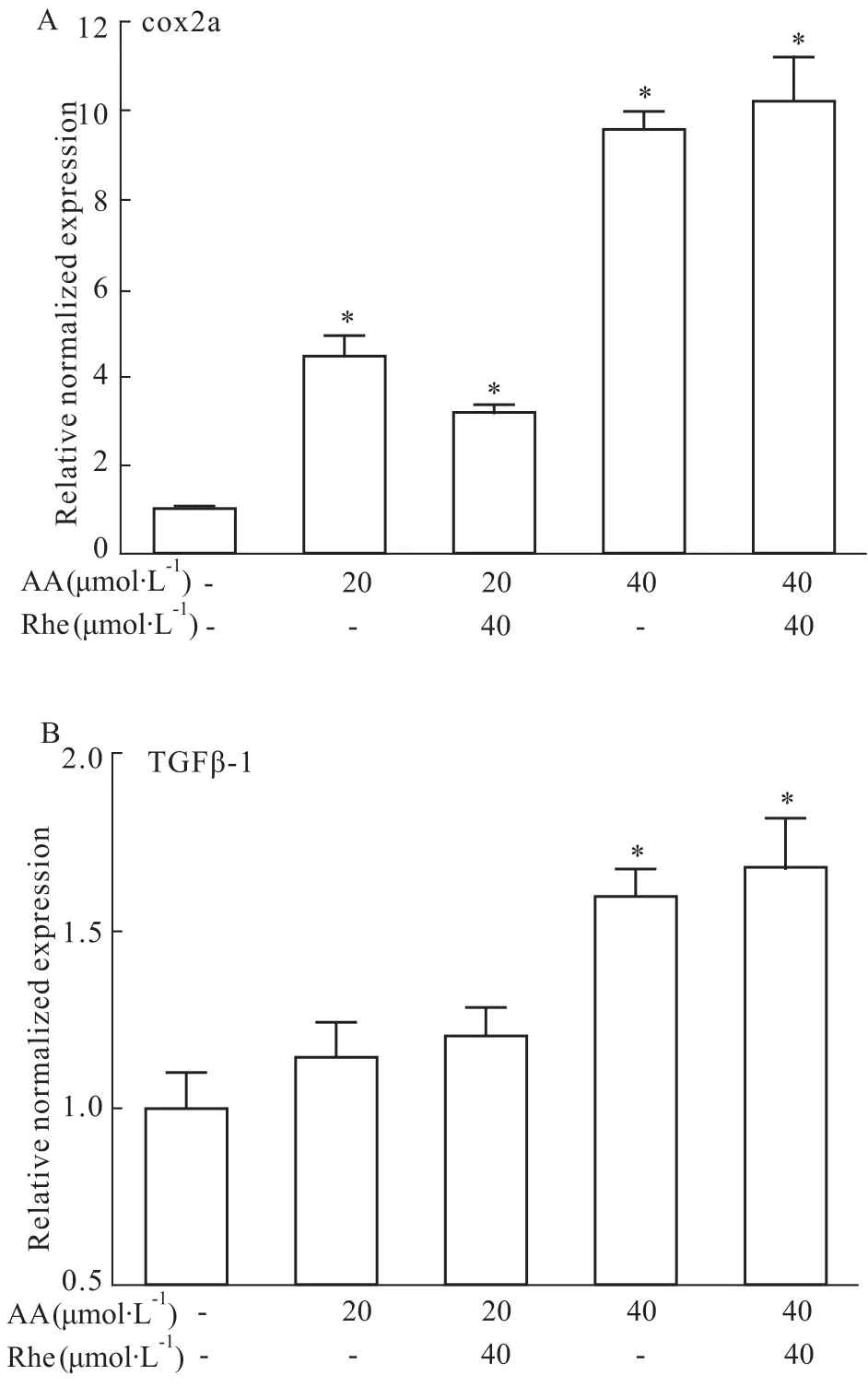
Fig 3 Expression levels of TGFβ-1 and cox2a genes in zebrafish larvae of different treatment groups
本实验中,发育4dpf的斑马鱼仔鱼经马兜铃酸A处理24 h后,仔鱼出现明显的眼周水肿。水肿是肾脏疾病患者的常见症状,是由于肾功能受损致使水分无法排出,潴留在组织间隙引起。已有实验发现,在肾脏功能发生损伤时,斑马鱼也会出现局部或全身水肿表现。在Zhou等[5]实验中,用甲硝唑处理Tg(pod::NTR-mCherry)斑马鱼,诱导肾脏足细胞发生凋亡,导致肾脏功能受损后,胚胎出现明显的眼周水肿表现。但另一方面,在基于斑马鱼模型进行的化合物毒性实验中,水肿是一种较为常见的表型改变,可继发于多种器官毒性损伤,而非肾脏损伤特异。为进一步确认肾脏损伤情况,实验中选取了与肾脏功能相关的特异指标进行检测。肌酐是肌肉组织的代谢产物,每日产生的肌酐均由肾脏排出体外,肾脏功能受损时,肌酐在体内蓄积。在临床上,检测血肌酐值是诊断肾脏疾病的常用手段。由于斑马鱼仔鱼体积小,不易获取血液样本,本实验中对仔鱼组织中的肌酐进行提取检测。结果发现,在40 μmol ·L-1马兜铃酸A处理组,斑马鱼仔鱼组织中肌酐含量值较正常组有明显提高,说明仔鱼的肾脏功能受到损害,肌酐排泄受阻,致使肌酐在体内出现蓄积。
作为多种中药材的有效成分之一,大黄酸具有抗炎、降低纤维化等药理活性,能降低糖尿病肾病鼠的尿蛋白水平,减轻肾脏肥大。为观察大黄酸对斑马鱼马兜铃酸肾病中的保护作用,在本实验中,在用马兜铃酸A处理造成肾脏损伤的同时加入大黄酸作为治疗组,结果发现,治疗组仔鱼眼周水肿和血循环系统异常的发生率较相应损伤组均有明显降低,同时,大黄酸能降低马兜铃酸A处理组仔鱼组织的肌酐值,说明大黄酸在马兜铃酸所致的肾脏损伤中具有肾脏保护作用。马兜铃酸导致肾脏损害的一个重要特征是肾间质发生纤维化,同时伴有炎症反应的发生,因此,本实验中对各组仔鱼组织的炎性相关因子cox2a和致纤维化因子TGF-β1的基因表达量进行了检测。发现马兜铃酸A处理组cox2a和TGF-β1基因的表达水平较对照组有明显升高,并具有剂量相关性。在马兜铃酸A低浓度(20 μmol· L-1)处理组,合并加入大黄酸后能明显降低cox2a的表达水平,但在马兜铃酸A高浓度(40 μmol· L-1)组,大黄酸对cox2a表达量的影响并不明显,损伤组与治疗组cox2a的表达水平均明显高于对照组。以往在糖尿病肾病大鼠模型中观察到大黄酸能够下调TGF-β1表达水平,抑制肾小管上皮细胞的转分化,阻止纤维化发生。但本实验结果显示,在马兜铃酸引起的肾脏损伤中大黄酸对TGF-β1的表达水平几乎没有影响。苏健等[6]用慢性移植肾肾病(CAN)大鼠模型研究大黄酸对抗纤维化因子的影响,发现随着CAN病程的进展,肾组织TGF-β1的表达明显增加,加入大黄酸未影响CAN进展过程中TGF-β1的表达。由此可见,在不同类型的肾脏疾病中,大黄酸对TGF-β1产生不同作用,这也提示我们,大黄酸对TGF-β1的下调及阻抑并不是其发挥抗纤维化活性的唯一机制。
综上所述,在斑马鱼马兜铃酸肾病模型中,加入大黄酸进行处理,能减少异常发生率,降低仔鱼组织中的肌酐含量,显示出一定的肾脏保护作用。大黄酸安全性高、药理活性广泛,尤其在糖尿病肾病治疗中的独特疗效已得到实验验证,目前国内已将单体大黄酸列为一类新药进行重点研究,相信经过体内活性实验及临床疗效确证,大黄酸将能在肾脏功能保护及肾脏损伤治疗方面得到更为广泛的应用。本实验利用斑马鱼肾脏损伤模型评价化合物的活性,充分利用了斑马鱼产卵量大、发育周期短的优势,可以快速筛选获得具有肾脏保护作用的活性成分,极大提高了新药发现和研发效率。
(致谢:本实验全部于山东省科学院生物研究所药物筛选研究室完成,在此表示衷心感谢!)
[1] 李晓红,李 蒙,陶艳蓉.大黄酸及其衍生物药理作用研究新进展[J].现代药物与临床,2010,25(6):417-52.
[1] Li X H,Li M,Tao Y R.Development of pharmacological effects of rhein and its derivatives[J].Drugs Clin,2010,25(6):417-52.
[2] 许 科,张 犁.大黄酸抗肾脏纤维化研究进展[J].新中医,2012,44(5):119-21.
[2] Xu K,Zhang L.Progression in study on the anti-renal fibrosis effect of rhein[J].J New Chin Med,2012,44(5):119-21.
[3] 付静波,付丽红,潘 飞,等.大黄酸对亚慢性镉染毒小鼠肝和肾损伤的保护作用[J].中国煤炭工业医学杂志,2013,16(7):1158-61.
[3] Fu J B,Fu L H,Pan F,et al.Protective effect of rheinonliver and kidney for sub-chronic cadmium ium toxicityin mice[J].Chin J Coal Ind Med,2013,16(7):1158-61.
[4] Ding Y J,Chen Y H.Developmental nephrotoxicity of aristolochic acid in a zebrafish model[J].Toxicol Appl Pharmacol,2012,261 (1):59-65.
[5] Zhou W,Hildebrandt F.Inducible podocyte injury and proteinuria in transgenic zebrafish[J].J Am Soc Nephrol,2012,23(6):1039 -47.
[6] 苏 健,殷立平,张 鑫,等.大黄酸对慢性移植肾肾病大鼠肾组织抗纤维化因子表达的影响[J].中国临床药理学与治疗学,2011,16(10):1114-20.
[6] Su J,Yin L P,Zhang X,et al.Influenc of rhein intervention on the expression of HGF and BMP7 in renal tissue of rats with chron-ical allograft nephropathy[J].Chin J Clin Pharmacol Ther,2011,16(10):1114-20.
Protective effect of rhein on aristolochic acid-induced renal injury in zebrafish
WANG Xue,LIU Ke-chun,WANG Xi-min,HAN Li-wen,ZHANG Shan-shan,HE Qiu-xia,CHEN Xi-qiang,HAN Jian,WANG Rong-chun
(Biology Institute of Shandong Academy of Sciences,Zebrafish Drug Screening Platform of Shandong Academy of Sciences,Key Laboratory for Biosensors of Shandong Province,Jinan 250014,China)
Aim To study the effect of rhein on renal damage induced by aristolochic acid.Methods Ze-brafish model of aristolochic acid nephropathy,genera-ted by treating zebrafish larvae with aristolochic acid for 24 h,was treated with rhein simultaneously.Mor-pholigical changes were observed and the creatinine level in larvae tissue was measured.And mRNA ex-pression levels of inflammatory factor cox2a and fibrosis factor TGF-β1 in larvae tissue were detected using qPCR.Results Some larvae show periocular edema and circulation system defection e.g.weak heart beat,narrow cardiac vesicle,decreased blood flow and even blockage,with a dose-response relationship after expo-sure to aristolochic acid for 24 h.The creatinine level in larvae tissue of the treated group was significantly higher than that of the control larvae.And the expres-sion levels of cox2a and TGF-β1 in larvae tissue of the treated group were also significantly increased.Per-centage of abnormal larvae and creatinine level in lar-vae tissue were decreased when treated with rhein sim-ultaneously.And the expression levels of cox2a was down-regulated by rhein compared with the aristolochic acid treated group.But rhein had no effect on TGF-β1 expression.Conclusion To some extent rhein can protect renal from damage induced by aristolochic acid.
aristolochic acid;zebrafish;larvae;kid-ney;rhein;creatinine
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.026.html
10.3969/j.issn.1001-1978.2016.03.013
A
1001-1978(2016)03-0361-05
R-332;R284.1;R322.61;R692.01
2015-10-09,
2015-12-24
国家自然科学基金资助项目(No 81202584,31400979);山东省自主创新重大专项(No 2014ZZCX0215)
王 雪(1978-),女,硕士,高级工程师,研究方向:药物毒性评价及活性筛选,E-mail:wangxue8809@163.com;刘可春(1964-),男,博士,研究员,通讯作者,Tel:0531-82605352,E-mail:hliukch@sdas.org
