2型糖尿病大鼠主动脉Wnt/β-catenin信号通路的变化及SIRT1的调节作用
2016-05-10尹茂山许淑红孙晓慧牟艳玲
尹茂山,许淑红,王 燕,孙晓慧,梁 辰,李 杰,牟艳玲
(1.山东省医学科学院药物研究所,山东济南 250062;2.济南大学山东省医学科学院医学与生命科学学院,山东济南 250062;3.中国药科大学,江苏南京 211198)
2型糖尿病大鼠主动脉Wnt/β-catenin信号通路的变化及SIRT1的调节作用
尹茂山1,2,许淑红3,王 燕1,孙晓慧1,2,梁 辰1,2,李 杰1,牟艳玲1
(1.山东省医学科学院药物研究所,山东济南 250062;2.济南大学山东省医学科学院医学与生命科学学院,山东济南 250062;3.中国药科大学,江苏南京 211198)
目的 检测Wnt/β-catenin信号通路相关蛋白及沉默信息调节因子(SIRT1)在2型糖尿病大鼠主动脉中的表达变化,探究SIRT1对Wnt/β-catenin信号通路的调节作用,明确二者在糖尿病主动脉病变发生发展中的作用。方法 高脂饮食联合链脲佐菌素建立2型糖尿病大鼠模型,实验将大鼠分为空白对照组、糖尿病2、4、8和12周模型组,血清检测空腹血糖(FBG),总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C),空腹胰岛素(FINS),HE染色法观察主动脉病理结构变化,RT-PCR法和Western blot法检测主动脉Wnt2、β-catenin、TCF4、SIRT1和sFRP2等相关蛋白基因转录及表达变化。结果 与正常组比较,2型糖尿病大鼠TC、TG、LDL-C水平明显升高,HDL-C水平明显降低,随着时间延长,糖尿病大鼠各时间点模型组与2周模型组相比较,TC、TG、LDL-C水平升高越来越明显,HDL-C水平降低更明显,差异均具有显著性(P<0.01);显微镜下糖尿病组大鼠主动脉可见不同程度局灶性内皮细胞空泡变性、甚至坏死。糖尿病组大鼠相对于正常对照组主动脉Wnt2和β-catenin的表达在2周及4周明显增加(P<0.01),4周后维持在较高水平;而TCF4、SIRT1的表达与正常对照组相比表现为持续的增加(P<0.01);sFRP2的表达在持续的降低(P<0.01)。结论 2型糖尿病大鼠主动脉病变发生发展过程中,SIRT1通过调节sFRP2的表达来调控Wnt/β-catenin信号通路的激活,参与糖尿病主动脉损伤的发生发展过程,进一步研究其在糖尿病主动脉损伤中的作用机制可能为糖尿病主动脉病找到新的治疗靶点。
Wnt2;β-catenin;TCF4;SIRT1;sFRP2;2型糖尿病;主动脉损伤
糖尿病(diabetes mellitus,DM)的发病率和死亡率呈逐年上升趋势,心血管并发症是DM患者死亡的主要原因。Wnt/β-catenin信号通路作为一条保守的信号传导通路广泛存在于各生物体中,参与调控细胞增殖、迁移、分化等细胞发育过程。近年来研究表明,Wnt/β-catenin信号通路参与主动脉内皮细胞生长和分化[1],在心血管疾病中起重要作用[2]。此外,Wnt/β-catenin信号通路的异常可能引起代谢综合征[3]。沉默信息调节因子1(silent information-regulator1,SIRT1)为哺乳动物Sirtuins家族成员之一,是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的去乙酰化酶,成人组织中广泛表达。研究显示[4-5],SIRT1通过去乙酰化相关因子调节作用Wnt/β-catenin在内的多个细胞信号通路,参与血管内皮细胞的保护作用,但在糖尿病主动脉病变过程中的作用仍不清楚。本文通过检测Wnt/β-catenin信号通路相关蛋白及SIRT1在2型糖尿病大鼠主动脉中的表达变化,探讨SIRT1对该信号通路在DM主动脉中的表达调节作用,为糖尿病主动脉病变的治疗提供理论基础。
1 材料与方法
1.1 实验动物及模型建立 健康♂SD大鼠50只,SPF级,体质量150~180 g,购自山东鲁抗医药股份有限公司实验动物中心。大鼠适应性喂养1周后,按体重均衡的原则随机分为正常对照组(A)10只,糖尿病模型组(B)40只。A组始终饲以普通饮食,B组采用高脂流质(猪油30%,胆固醇2.5%,脱氧胆酸钠1%,常规饲料66.5%)灌胃,两组动物均自由饮水。5周后,B组大鼠禁食12 h,颈静脉窦取血检测血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)等生化指标,确定形成高脂模型,诱导出大鼠胰岛素抵抗(insulin resistance,IR)状态,联合链脲菌素造模。B组大鼠一次性腹腔注射1%链脲菌素(30 mg·kg-1,pH=4.5柠檬酸-柠檬酸三钠缓冲液,4℃配制,现配现用),A组正常大鼠注射同体积柠檬酸-柠檬酸三钠缓冲液。造模后72 h尾静脉采血检测空腹血糖值(fasting blood glu-cose,FBG),以FBG≥11.1 mmol·L-1,胰岛素敏感指数降低,认为糖尿病大鼠模型成功。B组造模成功大鼠随机分为2、4、8和12周模型组,继续高脂饮食灌胃。A组继续以普通饲料喂养4周。
1.2 材料与试剂 链脲佐菌素、戊巴比妥钠(美国Sigma公司);血糖试纸(强生中国医疗器材有限公司);TG试剂盒、TC试剂盒、低密度脂蛋白-胆固醇(low density lipoprotein-cholesterol,LDL-C)试剂盒、高密度脂蛋白-胆固醇(high density lipoprotein-cholesterol,HDL-C)试剂盒(四川迈克生物科技股份有限公司);胰岛素(insulin,INS)试剂盒(Lengton生物上海公司);生物素标记山羊抗兔IgG/小鼠IgG二抗试剂盒(北京中杉金桥生物技术有限公司);Western blot一抗、二抗去除液、Western blot细胞裂解液、Western blot转膜液、BCA蛋白浓度测定试剂盒(增强型)、SDS-PAGE凝胶配制试剂盒和SDS-PAGE电泳液均购自碧云天生物技术研究所;ProS-ieve Color ptrotein makers(美国Lonza Rockland公司);PVDF膜(0.45 μm;美国SERVA公司);增强型化学发光试剂(美国Millipore公司);所用单克隆抗体为:Wnt2(美国Epitomics公司),β-catenin(美国Cell Signaling Technology公司),TCF4(英国Ab-cam公司),sFRP2(美国Cell Signaling Technology公司),β-actin(美国Ambobio公司);PCR引物(中国BioSune);逆转录试剂盒(美国ThermoFisher公司)。
1.3 空腹血糖及胰岛素检测 高脂灌胃5周后,大鼠一次性腹腔注射链脲菌素后72 h,禁食12 h,颈静脉窦取血,离心分离血清,检测空腹血糖及胰岛素(fasting insulin,FINS)水平,计算胰岛素敏感指数(insulin sensitive index,ISI),检测胰岛素敏感性变化,公式为ISI=ln[1/(FINS×FBG)]。
1.4 标本收集 造模结束后,各模型组大鼠高脂灌胃,分别喂养至实验设定的2、4、8和12周。大鼠麻醉,仰位固定,开胸,腹主动脉取血,5 ml/只,3 000 r ·min-1离心10 min,取上清,分装,-20℃保存待测。生化仪检测TC、TG、HDL-C、LDL-C水平。迅速取出主动脉,用预冷生理盐水洗净,滤纸吸干,剔除血管周围脂肪组织,分为两部分:一部分用4%多聚甲醛固定,经脱水、透明、包埋,制成主动脉组织石蜡块;另一部分置于EP管,于液氮中保存待用。
1.5 HE染色 取正常对照组及各时间点模型组主动脉组织,制作石蜡切片,常规脱蜡至水,苏木精染色10 min,流水稍洗,体积分数1%的盐酸酒精分化,流水冲洗数分钟,伊红染色5 min,流水稍洗,梯度酒精常规脱水,中性树胶封片。Eclipse TE 2000-S免疫荧光显微镜拍照(日本Nikon),观察主动脉组织病理结构的改变。
1.6 Western blot 取正常组及各模型组大鼠主动脉组织,制备组织匀浆,每20 mg组织加入100~200 μL含1 mmol·L-1PMSF的裂解液,4℃下14 000×g离心10 min,取匀浆上清,用BCA蛋白浓度测定试剂盒测定总蛋白浓度。20~50 μg总蛋白上样量以浓度为8%的凝胶电泳进行分离。冰浴下恒流(300 mA)湿法转膜2 h,体积分数5%的脱脂奶粉封闭1 h后与相应一抗4℃共孵育过夜。TBS-T洗液洗涤,与辣根过氧化物标记的二抗共孵育,用增强型化学发光试剂进行显色,并利用灰度分析软件定量分析。
1.7 逆转录-聚合酶链式反应(RT-PCR) 取各组主动脉组织100~150 mg,均匀粉碎后按TRIzol提取程序(说明书)提取组织总RNA;按AMV逆转录试剂盒操作说明进行逆转录后,4℃保存。各目的基因的扩增引物序列,如Tab 1所示;扩增条件:94℃预变性3 min,然后94℃变性30 s,55℃变性30 s,72℃延伸60 s,共35个循环,最后72℃延伸5 min,快速冷却至4℃保存。2%琼脂糖凝胶电泳后,凝胶成像仪观察,用BandScan 5.0软件测定条带灰度值,将mRNA、分别与β-actin mRNA灰度值的比值作为观察指标,进行统计学分析。
1.8 统计学分析 应用SPSS19.0统计软件进行数据处理,数据以±s表示,组间差异比较采用方差分析及t检验。
2 结果

Tab 1 Primers used for qRT-PCR
Tab 2 The general characteristics of rats after DM model established(±s)

Tab 2 The general characteristics of rats after DM model established(±s)
ΔBW=Body Weight(after 2 wks)-Body Weight(before);*P<0.05,**P<0.01 vs control
Group n ΔBW/g FBG/mmol·L-1 FINS/mU·L-1ISI Control 10 29.360±2.336 5.776±0.267 19.712±0.836 -4.735±0.465 DM Model 36 -3.552±0.426** 32.150±0.997** 29.545±1.342* -6.856±0.761**
Tab 3 Changes of biochemical parameters in DM rats(±s)

Tab 3 Changes of biochemical parameters in DM rats(±s)
*P<0.05,**P<0.01 vs control;△P<0.05 vs 2 week DM
Group n FBG/mmol·L-1 TG/mmol·L-1 TC/mmol·L-1 HDL-C/mmol·L-1 LDL-C/mmol·L -1 .225 0.638±0.077 0.117±0.021 2 week DM 9 30.612±4.375** 1.211±0.076** 2.323±0.167* 0.555±0.109* 0.178±0.029**4 week DM 9 34.078±6.715**△ 1.299±0.098** 2.776±0.096**△ 0.506±0.023* 0.221±0.016**△8 week DM 9 36.676±6.112**△ 1.374±0.097** 2.998±0.116**△ 0.499±0.036* 0.240±0.009**△12 week DM 9 36.118±5.733**△ 1.394±0.108** 3.332±0.109**△ 0.421±0.034*△ 0.249±0.015 Control 10 5.776±0.2671 1.107±0.023 2.151±0**△

Fig 1 HE staining of aorta of DM rats(×400)
2.1 大鼠模型建立情况 实验期间,正常对照组大鼠状态良好、健壮、皮毛油亮有光泽,自主活动正常,对外界反应灵敏,无死亡。与正常对照组大鼠相比较,DM组大鼠逐渐消瘦,精神萎靡,皮毛无光泽,腥臊臭味加重等;且随着时间延长,多饮、多食、多尿和消瘦表现加重,大鼠生存状态越来越差,造模成功大鼠36只,成功率为90%。
2.2 造模后大鼠体重变化及FBG、FINS、ISI情况注射STZ造模72 h后,正常对照组大鼠体重增加,糖尿病组大鼠糖尿病模型组大鼠与对照组大鼠比较血清FBG、FINS明显升高,ISI下降,差异有统计学意义(P<0.01),表明2型糖尿病大鼠造模成功。见Tab 2。
2.3 大鼠血生化指标检测 与正常对照组比较,模型组大鼠血清中FBG、TG、TC、LDL-C明显升高(P <0.05)。而4、8周模型组与2周DM模型组相比较,大鼠血清TG含量略有升高,HDL-C略有降低,二者之间比较差异无统计学意义(P>0.05),8周和12周DM模型组各生化指标变化不大;FBG、TC、LDL-C继续升高,差异有统计学意义(P<0.05)。见Tab 3。
2.4 大鼠主动脉内皮病理观察结果 正常对照组大鼠主动脉内皮细胞形态正常,内皮细胞排列整齐,细胞核均匀分布,无变性、坏死等病理结构改变。DM组大鼠主动脉内皮细胞,胞质丰富,细胞核由正常的圆形或椭圆形不同程度的出现变为长杆状,排列紊乱,8周和12周DM大鼠内皮细胞出现局部的细胞变性、细胞空泡化,甚至坏死(Fig 1)。
2.5 Wnt/β-catenin信号通路及SIRT1相关蛋白在大鼠主动脉中的表达 Westem blot实验结果表明,糖尿病组大鼠相对于正常对照组主动脉Wnt2 和β-catenin的表达在2周及4周明显增加(P<0.01),4周后维持在较高水平,8周及12周相关蛋白表达变化差异没有显著性(P>0.05);糖尿病大鼠从2周到12周过程中,TCF4、SIRT1蛋白表达与正常对照组相比表现为持续的增加(P<0.05),sFRP2蛋白的表达在持续的降低(P<0.01)(Fig 2、3)。
2.6 Wnt/β-catenin信号通路及SIRT1 mRNA在大鼠主动脉中的转录水平 正常组大鼠主动脉组织细胞有一定量的Wnt2、β-catenin、TCF4及SIRT1 mRNA的表达,但表达量不随时间的变化而变化(P >0.05),而sFRP2 mRNA始终维持在较高的转录水平。与正常组相比,各糖尿病组大鼠主动脉组织中Wnt2,β-catenin mRNA明显增高(P<0.01),且各模型组中,2周和4周组mRNA表达持续增加,8周和12周组维持在高表达水平,二者之间差异没有显著性(P>0.05);与此同时,各模型组中SIRT1和TCF4 mRNA的表达持续增高,sFRP2 mRNA表达水平持续降低,各组别之间差异也具有显著性(P<0.05)。见Fig 4。
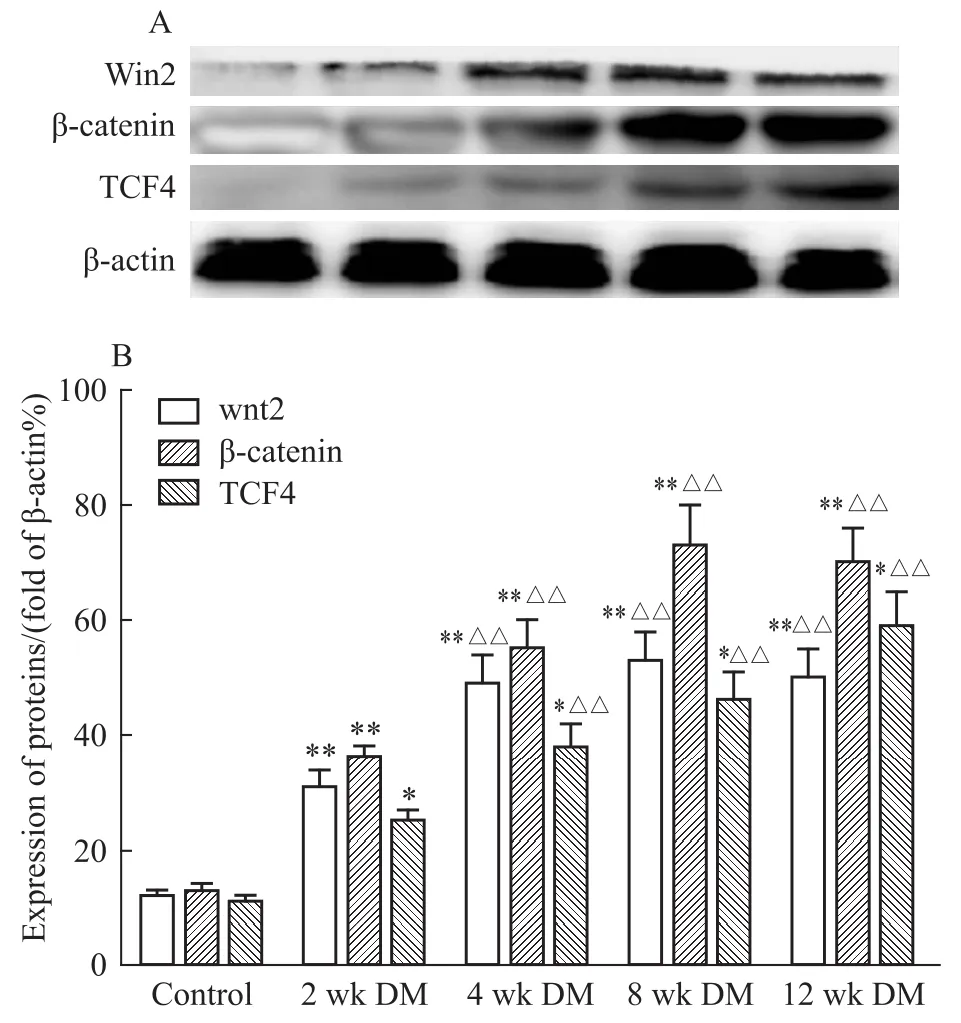
Fig 2 The protein levels of Wnt2,β-catenin and TCF4 in total protein extracts of aorta from control and DM rats analyzed by Western blot(±s,n=9)
3 讨论
糖尿病可引起机体多个脏器的损害,主动脉等大血管疾病是2型糖尿病致死或致残的主要原因。糖尿病主动脉内皮细胞病变的发病机制及相关信号通路的研究也较少,探索血管内皮功能异常的病理生理机制,并有效改善血管内皮功能,可能是防治2型糖尿病心血管事件的靶点。
本实验采用了高脂饮食联合链脲佐菌素建模方法[6],建立2型DM大鼠模型,与正常对照组相比,DM大鼠血清TC、TG、LDL-C值有明显升高,并呈现持续的高血糖,胰岛素抵抗出现,糖尿病状态形成。本研究中,DM大鼠FBG明显升高,体重明显低于正常对照组,DM大鼠主动脉出现局灶性内皮细胞空泡变性、甚至坏死,表明DM大鼠主动脉出现不同程度的大血管损伤。
Wnt/β-catenin信号通路在大血管损伤中的作用也被广泛关注[7]。Dabernat等[8]研究Wnt/β-catenin信号通路的异常会引起糖代谢的异常,增加2型糖尿病的风险,参与高糖介导的肾上皮细胞转分化过程[9]。Xi等[10]在对1型糖尿病大鼠模型的研究中发现,DM状态下,大鼠心肌Wnt/β-catenin信号通路被激活。因此,我们推测Wnt/β-catenin信号通路可能在DM主动脉损伤中起重要作用。

Fig 3 The protein levels of SIRT1 and sFRP2 in total protein extracts of aorta from control and DM rats analyzed by Western blot(±s,n=9)
SIRT1可以通过调节FOXOs、NF-κB、AMPK等相关信号通路,对多种心血管疾病的病理生理过程产生重要影响,发挥保护心肌、舒张血管、抑制动脉粥样硬化等作用[6]。Takeda等[11]认为,在单核-巨噬细胞中,SIRTl失活条件下,mTOR通路介导NF-κB信号激活,进而诱发动脉粥样硬化发生。Yang等[12]研究发现,Sirtl过表达时,去乙酰化并激活LKB1,随后AMPK的去磷酸化水平升高,进而正向调节细胞寿命和能量平衡,从而保护主动脉血管内皮细胞功能,降低了动脉粥样硬化的发生。另有研究[13]显示,肝缺血-再灌注损伤中,SIRT1通过调节抑制Wnt信号通路,减少氧化损伤和细胞凋亡来保护肝细胞。而Zhou等[14]在研究间充质干细胞时发现,SIRT1可以通过调节sFRP2的表达来调节Wnt/β-catenin信号通路。但是,SIRT1在心血管系统对Wnt/β-catenin信号通路的调节还不清楚。

Fig 4 The mRNA expression of Wnt/β-catenin signaling,SIRT1 andsFRP2 in total RNA extracts of aortic tissue from control and DM rats using qRT-PCR(±s,n=9)
Wnt/β-catenin信号通路转导过程中,Wnt蛋白与细胞膜上的跨膜受体结合,促使β-catenin降解复合体轴蛋白/结肠腺瘤样息肉蛋白/糖原合成酶激酶3β(Axin/APC/GSK-3β)解聚而失活,抑制β-catenin的磷酸化及降解,促进β-catenin发生核转移,与核内转录因子TCF/LEF结合,激活下游靶基因启动基因转录[15]。本研究中Western blot及RT-PCR结果表明2周和4周DM大鼠心肌Wnt2的表达增加,促进β-catenin发生核转移,核内转录因子TCF4的表达增加,显示Wnt/β-catenin信号通路的激活;与此同时,早期DM大鼠主动脉内皮细胞的空泡变性、晚期甚至出现坏死等病变。而SIRT1表达持续增加,Wnt/β-catenin信号通路内源性抑制剂sFRP2在DM早期高表达,持续期表达下降;可能是因为在DM早期,主动脉组织中Wnt/β-catenin信号通路的迅速激活,体内广泛存在的SIRT1合成增加,直接调节sFRP2抑制Wnt/β-catenin信号通路的β-catenin的表达;高血糖状态持续,Wnt/β-catenin信号通路持续激活状态,sFRP2则随之降低。而SIRT1如何作用于sFRP2而发挥作用的,还需要进一步研究。
糖尿病主动脉病变是糖尿病心血管严重并发症的重要组成部分,明确其发生发展机制,进而阻滞其发展成为研究热点。本实验揭示Wnt/β-catenin信号通路的激活与SIRT1的调节作用,共同参与DM主动脉的损伤过程,我们将进一步研究二者在DM主动脉病变发展过程中的作用机制,以期为糖尿病主动脉病变的治疗找到新的靶点。
(致谢:本实验全部由山东省医学科学院药物研究所药理学实验室牟艳玲老师课题组独立完成,感谢我的导师牟艳玲老师在实验设计思路上提出的建议和意见及实验技术上给予的指导。)
[1] Zhuang Y,Mao J Q,Yu M,et al.Hyperlipidemia induces vascu-lar smooth muscle cell proliferation involving Wnt/β-catenin signa-ling[J].Cell Biol Int,2016,40(2):121-30.
[2] Xi X H,Wang Y,Li J,et al.Activation of Wnt/β-catenin/GSK3β signaling during the development of diabetic cardiomyopa-thy[J].Cardiovasc Pathol,2015,24(3):179-86.
[3] Singh R,Smith E,Fathzadeh M,et al.Rare nonconservative LRP6 mutations are associated with metabolic syndrome[J].Hum Mutat,2013,34(9):1221-5.
[4] Wang W R,Liu E Q,Zhang J Y,et al.Activation of PPAR alpha by fenofibrate inhibits apoptosis in vascular adventitial fibroblasts partly through SIRT1-mediated deacetylation of FoxO1[J].Exp Cell Res,2015,338(1):54-63.
[5] Kim Y H,Bae J U,Lee S J,et al.SIRT1 attenuates PAF-in-duced MMP-2 production via down-regulation of PAF receptor ex-pression in vascular smooth muscle cells[J].Vascul Pharmacol,2015,72:35-42.
[6] Rhee K J,Lee C G,Kim S W,et al.Extract of Ginkgo Biloba A-meliorates streptozotocin-induced type 1 diabetes mellitus and high-fat diet-induced type 2 diabetes mellitus in mice[J].Int J Med Sci,2015,12(12):987-94.
[7] Blankesteijn W M,Hermans K.Wnt signaling in atherosclerosis [J].Eur J Pharmacol,2015,763(Part A):122-30.
[8] Dabernat S,Secrest P,Peuchant E,et al.Lack of beta-catenin in early life induces abnormal glucose homeostasis in mice[J].Dia-betologia,2009,52(8):1608-17.
[9] 闫 ?,姚 芳,张丽萍,等.厄贝沙坦对高糖诱导肾小管上皮细胞转分化中Wnt/β-catenin信号途径表达的影响[J].中国药理学通报,2009,25(12):1630-4.
[9] Yan Z,Yao F,Zhang L P,et al.Modulation of Wnt/β-catenin signaling pathway byirbesartan in high glucose induced tubular epi-thelial mesenchymal transition[J].Chin Pharmacol Bull,2009,25 (12):1630-4.
[10]席晓慧,王福文,王 燕,等.早期糖尿病大鼠心肌Wnt/β-catenin信号通路的变化[J].中国药理学通报,2015,31(3):363-6.
[10]Xi X H,Wang F W,Wang Y,et al.Alteration of Wnt/β-catenin signaling pathway in early diabetic rats′myocardium[J].Chin Pharmacol Bull,2015,31(3):363-6.
[11]Takeda W A,Kitada M,Kanasaki K,et al.SIRT1 in activation induces inflammation through the dysregulation of autophagy in hu-man THP-1 cells[J].Biochem Biophys Res Commun,2012,427 (1):191-6.
[12]Yang Z,Kahn B B,Shi H,et al.Macrophage alpha1 AMP-acti- vated protein kinase(alpha1 AMPK)antagonizes fatty acid-in-duced inflammation through SIRT1[J].J Biol Chem,2010,285 (25):19051-9.
[13]Liu B,Zhang R,Tao G,et al.Augmented wnt-signaling as a therapeutic tool to prevent ischemia and reperfusion injury in liver:preclinical studies in a mouse model[J].Liver Transpl,2015,21 (12):1533-42.
[14]Zhou Y,Zhou Z,Zhang W,et al.SIRT1 inhibits adipogenesis and promotes myogenic differentiation in C3H10T1/2 pluripotent cells by regulating Wnt signaling[J].Cell Biosci,2015,5:61.
[15]Dawson K,Aflaki M,Nattel S.Role of the wnt-frizzled system in cardiac pathophysiology:a rapidly developing,poorly understood area with enormous potential[J].J Physiol,2013,591(6):1409-32.
Alteration of Wnt/β-catenin signaling pathway in type2 diabetic rats’aorta and regulation of SIRT1
YIN Mao-shan1,2,XU Shu-hong3,WANG Yan1,SUN Xiao-hui1,2,LIANG Chen1,2,LI Jie1,MU Yan-ling1
(1.Institute of Materia Medica,Shandong Academy of Medical Sciences,Jinan 250062,China;2.School of Medicine and Life Sciences,University of Jinan-Shandong Academy of Medical Sciences,Jinan 250062,China;3.China Pharmaceutical University,Nanjing 211198,China)
Aim To investigate the alteration of Wnt/β-catenin signaling and sirtuins 1in type 2 diabetic rats’aorta and clarify its role in the development of di-abetes aortic disease.Methods The type 2 diabetes rat model was established by injection of streptozocin after five-week of high fat diet.The rats were randomly divided into control group,DM model group of 2 weeks,4 weeks,8 weeks and 12 weeks.Fasting blood glucose(FBG),total cholesterol(TC),triglyceride (TG),high density lipoprotein-cholesterol(HDL-C),low density lipoprotein-cholesterol(LDL-C)and fast-ing insulin(FINS)levels were tested.HE staining was used to observe the pathological changes of aortal struc-tures.The alteration of Wnt2,β-catenin,TCF4,SIRT1 and sFRP2in aortawas determined by Western blot and RT-PCR.Results Compared with control group,TC,TG,LDL-C levels of type 2 diabetic rats were significantly increased,HDL-C levels were signif- icantly reduced(P<0.01).Aortic histological analy-sis revealed that DM induced aortic endothelial cell vacuolar degeneration and necrosis.The expression of Wnt2 and β-catenin level increased significantly in the first 4 weeks of diabetic groups compared to control group,and that in model group of 8 weeks and 12 weeks kept in the high level and showed no significant alteration(P>0.05).But the expression of TCF4 and SIRT1was enhanced continuously in DM compared with control group while sFRP2 decreased in the duration of DM development.Conclusions Wnt/β-catenin signa-ling pathway was activated in diabetic aortal injury by regulation of SIRT1 via sFRP2.Further researches on its mechanism of actionin DM aorta injury may find a new therapeutic target for the disease.
Wnt2;β-catenin;TCF4;SIRT1;sFRP2;type 2 diabetes;aorta injury
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.018.html
10.3969/j.issn.1001-1978.2016.03.009
A
1001-1978(2016)03-0337-06
R-332;R322.121;R341;R394.2;R587.1
2015-11-18,
2015-12-28
国家自然科学基金资助项目(No 30701022);山东省优秀中青年科学家科研奖励基金计划(No BS2013SW008)
尹茂山(1987-),男,硕士生,研究方向:心血管药理学,E-mail:maoshanyin@126.com;牟艳玲(1975-),女,博士,副研究员,研究方向:心脑血管药理学,通讯作者,E-mail:myling501@hotmail.com
