脑转移瘤动物模型的制备方法及研究进展
2016-05-10崔白苹孙安阳
崔白苹,陈 平,孙安阳
(1.盐城卫生职业技术学院神经退行性疾病与修复实验室;2.盐城市第一人民医院肿瘤科,江苏盐城 224005)
脑转移瘤动物模型的制备方法及研究进展
崔白苹1,陈 平2,孙安阳1
(1.盐城卫生职业技术学院神经退行性疾病与修复实验室;2.盐城市第一人民医院肿瘤科,江苏盐城 224005)
脑转移瘤(brain metastasis)是指源于中枢神经系统以外的肿瘤细胞转移到脑组织的颅内常见恶性肿瘤。目前脑转移瘤造模有外周接种和直接脑内接种瘤细胞两大类方法。外周接种方法包括造模动物左心室或颈动脉内注射、原位接种等途径;脑内接种方法包括肿瘤细胞株直接接种于动物特定脑区的简化方法和临床脑转移瘤活检标本直接接种于裸大鼠脑内的新方法。该文综述了脑转移瘤模型的制备方法,包括可选用的接种动物、瘤细胞系、接种方法和模型的检测方法,并介绍这一领域的最新研究进展。
脑转移;肿瘤;动物模型;裸鼠;细胞接种;制备方法;检测方法
脑转移瘤是成年人最常见的颅内恶性肿瘤,外周肿瘤脑转移的发生率为10%~40%,患者数量大约是原发性脑肿瘤的10倍。未治疗的脑转移瘤患者中位生存期1~2月,治疗后延长为4~6月[1]。脑转移瘤的原发病灶以肺癌最多见,其次是乳腺癌、恶性黑色素瘤、消化道肿瘤和肾癌;以肿瘤发生脑转移的机率看,以黑色素瘤最易发生脑转移(50%左右),其次为小细胞性肺癌和乳腺癌。儿童脑转移瘤的原发肿瘤则以白血病、淋巴瘤多见。临床脑转移瘤虽已尝试多种治疗方法如手术切除、全脑放疗、立体定向放疗和化疗,但效果欠佳,尚缺乏有效的治疗手段。因此,迫切需要建立理想的脑转移瘤实验模型,以加强其分子机制与治疗措施的研究。
1 脑转移瘤的转移途径、部位与分子机制
肿瘤细胞向脑内转移的途径主要是通过血液,其中最多是通过动脉系统,通过静脉或淋巴系统转移并不常见。脑室内转移见于脊髓肿瘤的上行性侵犯。大多数患者的脑转移瘤为多发性,瘤细胞侵入附近的毛细血管网,由颈动脉和椎动脉系统到达脑内形成多个大小不一的转移灶,常位于大脑中动脉分布区,即额叶和顶叶区。脑转移瘤80%分布于大脑,15%小脑,5%脑干。另外,急性白血病可见软脑膜和蛛网膜转移;儿童恶性淋巴瘤等可见硬脑膜转移。与原发脑瘤不同,脑转移瘤与周围组织分界清楚。
肿瘤转移经历两个阶段:①局部侵袭(invasion)、渗入血管(intravasation)与散播(dissemination);②溢出血管(ex-travasation),进入组织,在组织内形成瘤细胞克隆(coloniza-tion)。脑转移瘤发生、发展是瘤细胞与脑内微环境(如基质)相互作用的结果[2],即“种子-土壤”学说。以乳腺癌脑转移为例,肿瘤细胞通过非开窗型毛细血管溢入脑组织,其中环氧合酶COX2、表皮生长因子受体配体HBEGF和α2,6-唾液酸转移酶ST6GALNAC5是瘤细胞通过血脑屏障的关键介导分子[3]。在上述一系列过程中起重要作用的分子尚有:血管内皮生长因子(VEGF)高表达促进肿瘤血管新生;表皮生长因子EGF促进肿瘤生长;基质金属蛋白酶(MMP-1)[4]、组织蛋白酶cathepsin S[5]促进肿瘤侵袭;黏附分子(E-cad-herin)参与脑转移瘤形成的多个步骤。DNA双链缺口修补基因BARD1、RAD51抵抗自由基毒性,促进脑转移瘤克隆形成。
2 脑转移瘤动物模型的类型
由于黑色素瘤自发性脑转移在临床较常见,在脑转移瘤模型研制初期试图从啮齿类动物中寻觅黑色素瘤的自发性模型。发现的第1个小鼠黑色素瘤细胞株B16-F1来自于C57BL/6小鼠耳部,经反复接种、筛选获得的亚系B16-B10b 与B16-B10-n左心室接种有明显的脑转移潜能[6]。通过紫外照射或致癌物暴露可诱发啮齿类或其他动物恶性肿瘤,再从中筛选出脑转移瘤细胞株。如瘤细胞与造模动物同系,所制备的模型称为同源性模型(syngeneic models)。同源性模型的优点为免疫功能保留,可研究瘤细胞宿主反应;缺点是瘤细胞为动物来源,与患者肿瘤细胞存在生物学差异。在80年代以后转向人-鼠异源性模型(xenograft models),即用人源性肿瘤细胞接种于鼠体内造模。异源性模型又以接种部位与原发肿瘤的异同而分为原位(orthotopic)模型与异位(ectopic)模型。各种异源性与同源性脑转移瘤模型的优点与局限性总结见Tab 1。
3 脑转移瘤动物模型的制备方法
3.1 造模常用动物 制备异源性脑转移瘤模型选用免疫缺陷动物,常用裸鼠[7]和(或)严重联合免疫缺陷小鼠(SCID小鼠)[9]等,一般在4~6周龄造模。制备同源性模型常用正常免疫功能的动物。
3.1.1 裸鼠 裸鼠包括裸小鼠(nu)和裸大鼠(rnu),是位于第11对染色体上的裸基因nu隐性突变所致。裸小鼠纯合子胸腺仅有残迹,没有T淋巴细胞正常分化,B淋巴细胞和NK细胞基本正常,因而缺乏成熟T淋巴细胞所执行的辅助与杀伤功能,不能产生细胞毒效应与移植排斥[7]。裸小鼠随月龄增长,T细胞会有所增加,故后述的瘤细胞接种实验常采用4~6周龄幼鼠。另外,裸小鼠正常的NK细胞功能也会制约瘤细胞的播散。裸大鼠T细胞缺陷的特征与裸小鼠相似,用于脑转移瘤造模[8]有转移瘤较大、成像或手术容易、组织与血标本量多的优点,但维持成本较高。
3.1.2 SCID小鼠 SCID小鼠(severe combined immune defi-ciency mice)是由常染色体隐性突变而来的另一种免疫缺陷动物。SCID小鼠外观有白毛,但胸腺、脾、淋巴结的重量是正常的30%以下,组织学上T细胞和B淋巴细胞严重缺乏[9],对人类肿瘤移植的存活率一般高于裸鼠。SCID小鼠的NK细胞、巨噬细胞和粒细胞功能正常,故仍一定程度地制约瘤细胞的散播。另需注意的是SCID小鼠有“渗漏”现象,大约15%的SCID小鼠血中仍可检测出有限数量的T细胞和B细胞以及一定水平的免疫球蛋白。SCID小鼠的渗漏现象不遗传,仅需在选种时对留种小鼠进行免疫球蛋白筛选。
SCID小鼠已发展一些变种,如与非肥胖性糖尿病小鼠NOD杂交获得NOD/SCID小鼠以及再合并白介素-2受体γ-链基因敲除的NOD/SCID/IL-2Rγ-/-(NSG)小鼠,其NK细胞活性明显降低,有利于瘤细胞的散播,适用于原位模型的制备[15,24,30]。
3.1.3 同源性模型可用免疫正常动物 同源性模型可用裸鼠或者常规动物造模,后者降低了动物可得性难度。同源性模型成模较快(2周左右),但缺陷是脑转移的特异性不高,脑实质转移率较低。Zhang等[10]将Lewis肺癌细胞经颈动脉内注射入4月龄C57BL/6NCrj小鼠,注射后12 d脑内即检测到大量瘤细胞,小鼠存活22 d。Hochman等[11]用近交系BALB/c乳鼠(出生后7 d)腹腔注射小鼠T细胞恶性淋巴瘤Rev-2-T-6细胞系,接种后9~14 d先转移至蛛网膜下腔、脉络丛、颅神经,但大脑皮质以及白质受累迟(>1月)而少(<30%)。
出于成像或注射方便,国内有研究者采用较大接种动物,如张贵祥等[12]采用新西兰大白兔颈总动脉注射兔VX2肝癌细胞制备脑转移瘤模型。该造模方法在注射瘤细胞前5 ~10 min先行注射20%甘露醇5 ml·kg-1以开放血脑屏障,接种瘤细胞数量大(约需106~108个),造模兔存活期短于1个月。该兔模型也有颅外与脑膜成瘤比例偏高、脑实质转移特异性低等缺点。
3.1.4 转基因或基因敲除小鼠 通过遗传技术导入癌基因或失活抑癌基因,可制备肿瘤的遗传性小鼠模型,但由于原发瘤发展过快而导致转移瘤的发生机率不高。仅少数通过转基因或基因敲除途径制备的小鼠肿瘤模型可发生多器官(包括脑)转移,例如癌基因Ret转基因产生的皮肤黑色素瘤;HCCR-2转基因产生的乳腺癌;肺上皮细胞Trp53与Rb1条件性基因敲除[13]产生的小细胞肺癌。另一方面,将转基因或基因敲除技术与瘤细胞心内注射方法结合起来[5,14-15]可用以研究特定基因或分子对肿瘤脑转移的调节作用或提高造模成功率。如前所述,裸鼠或SCID小鼠尚存NK细胞活性,而重组激活基因Rag2-/-与白介素-2受体γ链IL-2Rγ-/-双基因敲除小鼠则缺乏T细胞、B细胞和NK细胞活性,可替代裸鼠或SCID小鼠成功用于Her2阳性的乳腺癌细胞脑转移瘤造模[14]。总之,基因工程小鼠肿瘤模型或技术代表着脑转移瘤动物模型研制的一个新方向。
3.2 造模常用的肿瘤细胞系 制作脑转移瘤模型选用的细胞系因原发瘤不同而异,以乳腺癌和肺癌脑转移模型研究与应用得最多。
乳腺癌脑转移模型通常采用三阴性乳腺癌(triple-nega-tive breast cancer)细胞系造模。三阴性乳腺癌细胞不表达雌激素受体(ER)、孕酮受体(PR)和人表皮生长因子受体2 (Her2/neu),对于常规化疗不敏感。三阴性乳腺癌初始细胞系MDA-MB-231并无形成脑转移的特异性。Yoneda等[16]将MDA-MB-231母代细胞系经若干次“外周接种-脑转移-传代培养-外周接种”循环筛选后,筛出优先转移到脑(brain-seeking)的乳腺癌细胞亚系MDA-MB-231BR,在裸小鼠心内注射后仅产生脑转移。通过病理学或MRI成像显示,2%的注射细胞在脑内形成较大的转移灶,5%的注射细胞仍然呈休眠状态[17]。为了方便成像,231BR细胞又转染增强绿色荧光蛋白(eGFP)或者萤火虫荧光素酶,但转染荧光素酶可改变瘤细胞生物学特性,降低脑转移的特异性,转染eGFP则影响较小。因而,MDA-MB-231BR或再表达eGFP的细胞系是目前乳腺癌脑转移造模最常用的细胞系。其他的人乳腺癌细胞系如MA11、MCF-7等,因造模潜伏期过长或脑转移特异性不高已很少使用。
肺癌脑转移动物模型研制相对滞后,目前尚未建立肺癌特异性脑转移的模型。肺癌细胞系A549细胞为人肺泡基底上皮腺癌细胞,裸鼠心内注射A549细胞并不产生脑转移,因而需采用脑内直接注射的方法造模[17]。将A549细胞过表达金属蛋白酶ADAM9增加瘤细胞的侵袭性,注射后可产生脑内微转移灶[18]。非小细胞肺癌细胞系EBC-1经反复筛选之后获得高脑转移的细胞亚系EBC-1/brain,左心室注射后获得较高几率的脑转移[19]。雷贝等[20]从中国人肺腺癌细胞系CPA-Yang1通过体内外筛选获得较高脑转移潜能的亚系CPA-Yang1-BR,一次接种可有1/2的裸小鼠产生脑转移。用于转移瘤造模的其他非小细胞肺癌细胞系尚有PC-9、PC-14、A925LPE3等[21-22]。另一方面,有研究者采用的小细胞肺癌细胞系NCI-H187、DMS273肺内接种,以制备原位小细胞肺癌脑转移模型,脑转移发生几率(20%左右)与特异性均不高,但从DMS273筛选的G3H亚细胞系脑转移能力提高[23]。
人或小鼠的黑色素瘤细胞系很多,各实验室用于制备脑转移模型的细胞系也各不相同。Rozenberg等[24]比较了原位皮下接种11种黑色素瘤细胞系脑转移模型潜力的差别,发现其中A375、A2058、RPMI8322、WM2664细胞产生较高比例的脑转移。将人黑色素瘤多种细胞系用超顺磁性的氧化铁纳米颗粒标记后再左心室内接种[25],可方便成像追踪。人前列腺癌细胞DU145心内注射后并不能形成转移瘤,但其Ras突变亚系DU145/RasB1用于造模可形成骨和脑转移[26]。
3.3 瘤细胞接种方法 脑转移瘤异位模型的构建通常采取动物左心室内(Fig 1)或颈动脉注射;原位模型目前应用较多的是动物肺内、乳腺脂肪垫或皮下接种。
3.3.1 左心室内注射 左心室内注射是异位模型最常用的接种方法。以小鼠心内盲注射为例:小鼠适当麻醉后仰卧固定,胸部消毒备皮。注射瘤细胞数量大约为1×106,悬浮于100 μL磷酸盐缓冲液;用0.25~0.5 ml注射器,27~28 G针头。在胸骨上切迹与剑突的中点偏左标记注射点,从左心室腔正上方可垂直进针;也可将注射点向外下移动少许,以45°角朝左心室进针,以方便使用注射推进装置。待见到明显回血后即固定针头位置,分段间断推注。注射完毕后以轻微负压退针。
小鼠心内盲注射法为非直视下操作,有一定的注射失败几率,部分小鼠还可能在注射点附近的心壁和肺部形成肿瘤。有条件的实验室可采用小动物超声成像(如Vevo 770高分辨率小动物超声影像系统)辅助小鼠心室内注射[27-28]:动物麻醉后仰卧固定,先调节好超声影像探头位置以清晰显示左心室超声心动图像;再将注射器固定于可操纵的推进装置,在动态超声影像辅助下将针尖推进至左心室腔内,以准确注射。与盲注射方法相比,使用小动物超声成像辅助不仅注射准确,造模成功率提高,造模小鼠死亡率也从20%~25%大大降低到1%~2%,因手术引起的体重下降也有所缓解。另外,如果注射的瘤细胞有荧光素酶标记,可用小动物PET成像来检查心内注射的准确性,正确心内注射的小鼠其荧光素酶信号迅速分布于动物全身。
即使心内注射准确完成,仍然有一部分造模动物在注射瘤细胞后死亡。瘤细胞具有促凝血活性,可引起广泛的血栓形成与栓塞,可能是导致动物死亡的主因。Stocking等[29]报道在瘤细胞心内接种前10 min尾静脉注射低分子量肝素(enoxaparin)10 mg·kg-1可大大减少随后瘤细胞接种引起的造模动物死亡。瘤细胞操作应置于冰上。
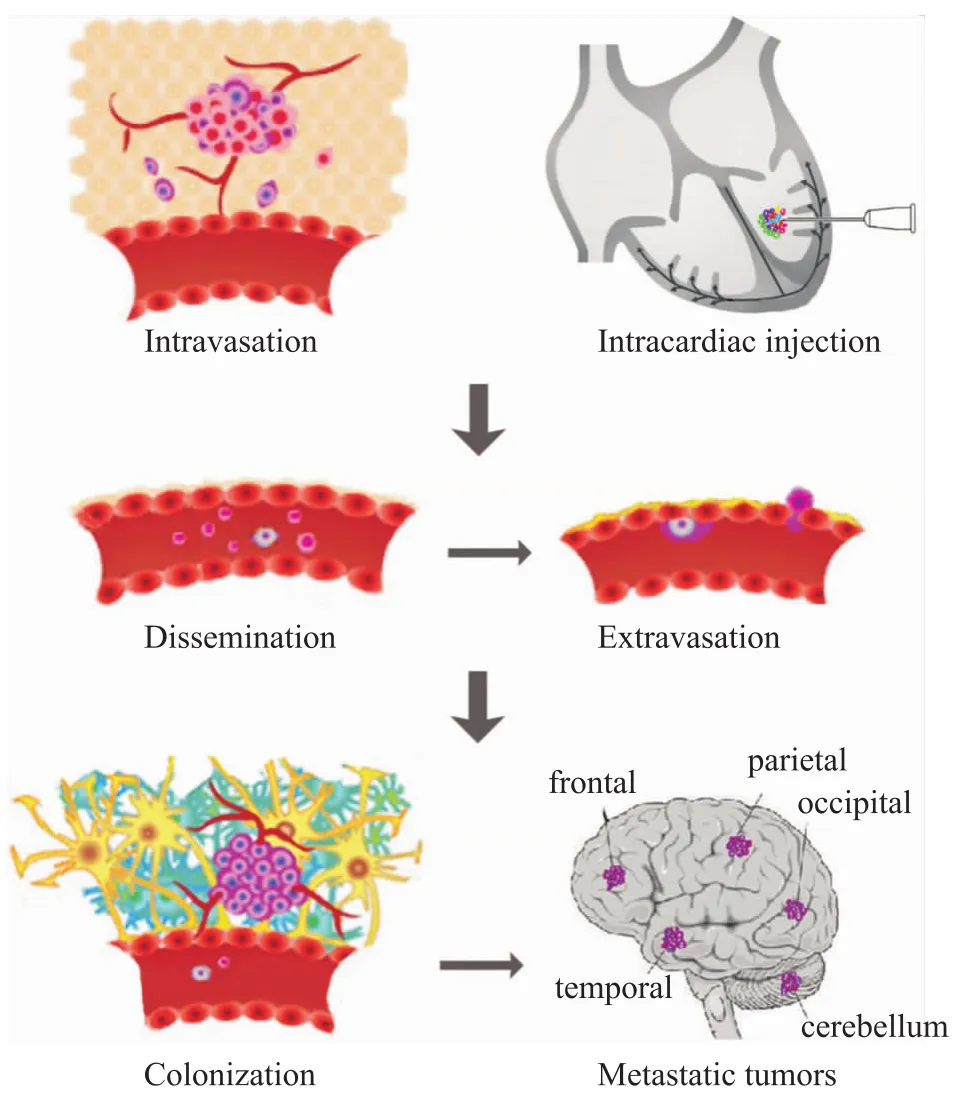
Fig 1 Brain metastasis formation following intracardiac injection of tumor cells
3.3.2 颈动脉接种 颈动脉接种也模拟瘤细胞血行脑转移。颈动脉注射虽在直视下操作,但注射技术要求高,注射瘤细胞数量与体积受限,易发生注射局部肿瘤生长,故较少应用。仍以小鼠颈动脉注射为例:小鼠麻醉后仰卧固定,颈部行正中切口,分离出一侧颈总动脉。注射瘤细胞数量通常在5×104上下,悬浮于5或10 μL磷酸盐缓冲液,用10~20 μL微量注射器,32~33G针头。于颈总动脉分叉下方5~6 mm处进针,可下垫小金属柄以方便进针。注射后用明胶海绵轻压或丝线结扎止血,缝合切口。
3.3.3 原发瘤原位接种 原发瘤原位接种模型(orthotopic models)与临床肿瘤转移发生情况最为接近,包括脑转移瘤发生发展的各个环节。早期研究发现,肿瘤细胞原位接种不同于临床晚期,难以形成转移灶。近些年,通过研制高转移特性的细胞株、基因工程技术改变接种的微环境等手段使原位接种模型研制取得明显的进展。受解剖特点、临床相关性等因素影响,肿瘤转移原位模型研究较多的是肺癌、乳腺癌和黑色素瘤。人小细胞肺癌细胞系NCI-H187、DMS273接种至裸鼠肺部,可以在骨、肾和脑形成转移[23]。人乳腺癌细胞MDA-MB-231[15,30]、小鼠乳腺癌细胞4T1亚系4TBM[31]也用于乳腺癌细胞脑转移原位模型的制备,通常将癌细胞接种于裸小鼠乳腺脂肪垫或乳腺导管。黑色素瘤原位接种为皮下注射,因较易操作而被广泛应用。人黑色素瘤细胞系WM239A的变异株131/4-5B1、131/4-5B2皮下注射后97~180 d检测到脑实质转移瘤[32]。裸小鼠皮下接种其他黑色素瘤细胞系YDFR.CB3、A375、A205890等[24],大于90 d后可见类似的脑实质转移。原位模型的缺点有成模潜伏期较长,常需要7~12周或以上,一般产生多个器官的转移。
3.3.4 其它外周接种途径 尾静脉注射易于操作,虽曾是小鼠瘤细胞接种的一个途径,但尾静脉注射后瘤细胞大部分滞留在肺部,肺部以外的器官如骨、脑发生转移瘤的概率不高,故现已少用。尾静脉注射尚因肺癌恶病质,易致小鼠在脑转移瘤形成之前死亡。另外,静脉注射造模方法与临床患者多由动脉血运产生转移瘤的情况不一致。
腹腔接种更易操作,也被个别研究者采用。Hochman等[11]用BALB/c小鼠腹腔接种鼠恶性淋巴瘤细胞Rev-2-T-6构建脑转移的同源性模型,发现瘤细胞主要经脉络丛和颅神经转移,较少转移至脑实质,说明腹腔接种造模也具有明显的局限性。
3.3.5 直接脑内接种 心内注射能模拟临床肿瘤血行脑转移的特点,但实验操作有一定难度,且成模率有限制,一部分研究者采用肿瘤细胞直接接种到特定脑区的简化方法,以快速成模,尤其适用于一些无明显脑转移特性的肿瘤细胞株。当然,这种模型非严格意义上的转移瘤模型,而称之局部生长模型更为准确。这种造模方法借助于脑立体定位仪,采用裸大鼠等较大免疫缺陷动物,接种部位有尾状核、丘脑腹后内侧核等。人肺腺癌细胞株A549没有脑转移特性,Pishko等[33]将A549细胞直接接种于裸大鼠脑尾壳核内,来作为肺癌脑转移的大鼠模型,用于VEGF单克隆抗体疗效的研究。
有一些研究者为了避开应用瘤细胞株,而将临床脑转移瘤活检标本直接种于裸大鼠脑内[34]。这种模型的优点是很大程度上保留了临床肿瘤的原有特性,并部分保留了肿瘤基质成分,适用于治疗方法研究。
4 脑转移瘤动物模型的检测方法
4.1 影像学检测 临床脑转移瘤检查方法有CT、正电子发射成像(PET)和磁共振成像(MRI)等,而动物模型脑转移瘤很小,影像学检测方法主要为磁共振成像,且需采用高分辨率仪器与多模式成像(multimodal imaging)等技术。早期3.0T磁共振成像多用于较大动物模型如裸大鼠模型,用于裸小鼠检测灵敏度不足,后者需要应用7.0T或以上的小动物磁共振成像仪。多模式成像技术包括T2加权成像、钆增强后T1加权成像、动态磁敏感对比增强灌注加权成像,以显示肿瘤血管分布与血流灌注情况的变化。用氧化铁纳米颗粒磁标记肿瘤细胞造模,可以实现单个瘤细胞磁共振脑成像追踪和全脑自动定量[25]。脑转移瘤定期影像检测可提供多病灶动态发展的资料,而单细胞水平磁共振脑成像对于追踪休眠期瘤细胞或微转移灶有重要价值。
常规钆增强MRI仅对较大肿瘤敏感。为提高检测灵敏度,牛津大学Sibson实验室发展了分子MRI方法[35],用连接抗体的氧化铁微颗粒作为靶向造影剂对血管内皮黏附分子-1(VCAM-1)进行MRI成像。裸小鼠心内注射小鼠4T1瘤细胞和SCID小鼠心内注射人MDA-231-BR细胞制备乳腺癌脑转移模型,在注射瘤细胞5 d后,VCAM-1靶向分子MRI成像即可检测到脑内转移瘤信号,检测灵敏度较常规MRI方法提高2~3个数量级。选择血管形成、细胞运动与凋亡、组织炎症特异分子建立各种靶向磁共振成像方法,可以动态检测脑转移瘤微环境的分子与细胞变化。
4.2 病理生物学检测
4.2.1 常规HE染色 肿瘤组织学检测最基础的方法是苏木精-伊红(HE)染色,脑转移瘤动物模型分析要尽量采用系列的全脑完整切片。HE染色可以观察组织细胞的分化程度和异型性大小。脑转移瘤模型的瘤细胞形态差异虽较临床标本小,但瘤细胞核通常染色仍较深、排列密集、易见核分裂。如有必要,HE染色成像后可用1%盐酸乙醇液脱色,再做免疫组化染色来获得肿瘤细胞来源等信息。
4.2.2 特殊染色 特殊染色用于显示组织中的正常结构或病理物质,与脑转移瘤相关的方法包括改良的Gomori银氨法和Alcian blue/PAS复合染色。
Gomori银氨法将网状纤维染成黑色,可用于癌与肉瘤的鉴别诊断:癌细胞间多无网状纤维;肉瘤细胞间多有网状纤维。Gomori银氨法还可用于脑转移瘤与原发瘤的鉴别,转移瘤常有明显的网状纤维,而脑内大多数原发瘤网状纤维很少。Alcian blue染色显示硫酸粘多糖。脑转移瘤细胞分泌的粘蛋白以酸性为主,可被Alcian blue深染成蓝色,而PAS (Periodic Acid-Schiff)染色法检测组织中的糖类。脑转移瘤组织被Alcian blue/PAS复合染色显示为蓝红色。
4.2.3 免疫组化与免疫印迹 肿瘤组织的分子标志物常用免疫组化方法检测,例如,Ki-67及增殖细胞核抗原PCNA是广泛采用的增殖相关标志物,其免疫反应性与肿瘤分级及预后相关。血细胞簇分化抗原CD系列不仅用于区分不同发育阶段和不同亚类淋巴细胞,还可用于显示肿瘤组织血管增殖(如CD31)[36]。一些细胞结构蛋白常用于显示肿瘤来源,如角蛋白cytokeratin(上皮细胞、间皮细胞、癌细胞)、波形蛋白vimentin(间叶组织、肉瘤细胞)、S-100(神经组织、黑色素瘤)等。临床常用的肿瘤分子标志物也可选择性用于对应的脑转移瘤动物模型检测。另外,如果脑转移瘤造模采用表达绿色荧光蛋白的瘤细胞系,可在荧光显微镜下直接观察到脑转移瘤病灶。
由于脑转移瘤多发且大小形状不一,定量检测相对困难。笔者曾设计了脑转移瘤半脑或全脑标本采用GFP等标签蛋白免疫印迹方法,结合全脑片病理学检查来进行脑转移瘤的半定量检测,并介绍给同事应用[37],取得了良好效果。
5 小结与展望
临床脑转移瘤治疗困难,预后较差,持续推动了脑转移瘤动物模型研制成为一个研究热点。不同类型的脑转移瘤模型侧重反映转移瘤发生发展的不同环节,以原位模型反映的环节最为全面。动物自发或诱导的同源性模型保留了宿主的免疫功能,可用于研究瘤细胞与宿主微环境之间的相互作用,但由于瘤细胞为动物来源,所得结果必须在患者标本上加以验证。人-鼠异源性模型是目前方法最成功、应用最多的模型。其中的异位模型虽然因左心室或颈动脉内注射跳过了原发瘤生长、外侵、渗入血管之前的环节,但仍可用于恶性肿瘤经过血道转移至脑的机制研究。另外,异位模型的成模稳定性好于原位模型,可用于治疗措施的研究。原位模型与临床肿瘤脑转移最为接近,但成模所需的时间也最长,目前在脑转移特异性和成模率上尚有缺陷,期待未来不断完善。脑内直接接种模型省略了肿瘤脑转移的大部分环节,适用于试验肿瘤细胞局部生长或治疗措施。另外,动物模型将如何模拟与复发有关的肿瘤休眠(tumor dormancy),尚待进一步研究。
目前的脑转移瘤动物模型在成模方面存在不同动物个体之间的较大差异,使治疗措施的试验仍面临较大挑战。借助小动物活体影像学动态检测与自身前后对照可克服上述限制,尤其是近几年发展了单个瘤细胞成像示踪和分子靶向磁共振等灵敏方法。然而,对于大多数无动物磁共振影像检测条件的实验室,进一步研制出更稳定、个体差异小的动物模型将有广泛的实用价值。
利用基因工程技术导入癌基因或失活抑癌基因是肿瘤动物模型研制的一个新方向,可以与传统造模方法结合起来。CRISPR-Cas9新技术是基因编辑与中止的强有力工具,它通过人工设计具有引导作用的sgRNA(short guide RNA),将核酸酶Cas9引导到基因组的靶点上,对DNA进行定点切割。麻省理工学院的研究人员已经使用CRISPR-Cas9系统构建了高效、快速的基因敲除动物模型制备新方法。最近他们又报道了另一个新方法,将CRISPR-Cas9系统用于高效体内筛选全基因组与肿瘤生长和转移相关的抑癌基因[38]。研究人员先将基因组规模的sgRNAs文库导入无转移特性的小鼠瘤细胞系,再将基因突变的细胞系注射进免疫缺陷动物,以快速产生转移瘤;通过在转移瘤中富集的sgRNAs找到其靶点,即与肿瘤转移有关的抑癌基因。相信通过类似的技术不久便可找到导致肿瘤脑转移的关键基因,在此基础上制备出表型更稳定、机制更明确或与临床情况更相似的脑转移瘤动物模型。
[1] Ba J L,Jandial R,Nesbit A,et al.Current and emerging treat-ments for brain metastases[J].Oncology,2015,29(4):250-7.
[2] Fidler I J.The role of the organ microenvironment in brain metasta-sis[J].Semin Cancer Biol,2011,21(2):107-12.
[3] Bos P D,Zhang X H,Nadal C,et al.Genes that mediate breast cancer metastasis to the brain[J].Nature,2009,459(7249):1005-9.
[4] Liu H,Kato Y,Erzinger S A,et al.The role of MMP-1 in breast cancer growth and metastasis to the brain in a xenograft model[J].BMC Cancer,2012,12:583.
[5] Sevenich L,Bowman R L,Mason S D,et al.Analysis of tumour-and stroma-supplied proteolytic networks reveals a brain-metastasis-promoting role for cathepsin S[J].Nat Cell Biol,2014,16(9):876-88.
[6] Nicolson G,Brunson K,Fidler I J.Specificity of arrest,survival,and growth of selected metastatic variant cell lines[J].Cancer Res,1978,38(11 Pt 2):4105-11.
[7] Price J E.Xenograft models in immunodeficient animals:I.Nude mice:spontaneous and experimental metastasis models[J].Meth-ods Mol Med,2001,58:205-13.
[8] Serres S,Martin C J,Sarmiento S M,et al.Structural and func-tional effects of metastases in rat brain determined by multimodal MRI[J].Int J Cancer,2014,34(4):885-96.
[9] Nonoyama S,Ochs H D.Immune deficiency in SCID mice[J].Int Rev Immunol,1996,13(4):289-300.
[10]Zhang Z,Hatori T,Nonaka H.An experimental model of brain metastasis of lung carcinoma[J].Neuropathology,2008,28(1):24-8.
[11]Hochman J,Assaf N,ckert-Schluter M,et al.Entry routes of ma-lignant lymphoma into the brain and eyes in a mouse model[J].Cancer Res,2001,61(13):5242-7.
[12]张贵祥,魏梦琦,韩月东,等.血源性脑及脑膜转移瘤动物模型的建立及其MRI研究[J].中华放射学杂志,2000,34(4):228 -30.
[12]Zhang G X,Wei M Q,Han Y D,et al.Establishment and MRI study of animal model of hematogenous cerebral and meningeal me-tastasis[J].Chin J Radiol,2000,34(4):228-30.
[13]Meuwissen R,Linn S C,Linnoila R I,et al.Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model[J].Cancer Cell,2003,4(3):181-9.
[14]Nanni P,Nicoletti G,Palladini A,et al.Multiorgan metastasis of human HER-2+breast cancer in Rag2-/-;Il2rg-/-mice and treatment with PI3K inhibitor[J].PLoS One,2012,7(6):e39626.
[15]Malin D,Strekalova E,Petrovic V,et al.αB-crystallin:a novel regulator of breast cancer metastasis to the brain[J].Clin Cancer Res,2014,20(1):56-67.
[16]Yoneda T,Williams P J,Hiraga T,et al.A bone-seeking clone exhibits different biological properties from the MDA-MB-231 pa-rental human breast cancer cells and a brain-seeking clone in vivo and in vitro[J].J Bone Miner Res,2001,16(8):1486-95.
[17]Yi B R,Kim S U,Choi K C.Co-treatment with therapeutic neural stem cells expressing carboxyl esterase and CPT-11 inhibit growth of primary and metastatic lung cancers in mice[J].Oncotarget,2014,5(24):12835-48.
[18]Shintani Y,Higashiyama S,Ohta M,et al.Overexpression of AD-AM9 in non-small cell lung cancer correlates with brain metastasis [J].Cancer Res,2004,64(12):4190-6.
[19]Yoshimasu T,Sakurai T,Oura S,et al.Increased expression of integrin alpha3beta1 in highly brain metastatic subclone of a human non-small cell lung cancer cell line[J].Cancer Sci,2004,95 (2):142-8.
[20]雷 贝,曹 杰,沈 杰,等.人肺腺癌脑转移动物模型建立及显像的研究[J].中国肺癌杂志,2013,16(8):391-9.
[20]Bei L,Cao J,Shen J,et al.An experimental study on the chinese lung adenocarcinoma cell clone CPA-Yang1-BR with brain metasta-sis potency in nude mice and in vivo imaging research[J].Chin J Lung Cancer,2013,16(8):391-9.
[21]Chen Y,Wang M,Zhong W,Zhao J.Pharmacokinetic and phar-macodynamic study of Gefitinib in a mouse model of non-small-cell lung carcinoma with brain metastasis[J].Lung Cancer,2013,82 (2):313-8.
[22]Nishihara H,Hara E,Uramoto H,et al.In vivo imaging models of bone and brain metastases and pleural carcinomatosis with a novel human EML4-ALK lung cancer cell line[J].Cancer Sci,2015,106(3):244-52.
[23]Sakamoto S,Inoue H,Ohba S,et al.New metastatic model of hu-man small-cell lung cancer by orthotopic transplantation in mice [J].Cancer Sci,2015,106(4):367-74.
[24]Rozenberg G I,Monahan K B,Torrice C,et al.Metastasis in an orthotopic murine model of melanoma is independent of RAS/RAF mutation[J].Melanoma Res,2010,20(5):361-71.
[25]Sundstrom T,Daphu I,Wendelbo I,et al.Automated tracking of nanoparticle-labeled melanoma cells improves the predictive power of a brain metastasis model[J].Cancer Res,2013,73(8):2445 -56.
[26]Yin J J,Zhang L,Munasinghe J,et al.Cediranib/AZD2171 in-hibits bone and brain metastasis in a preclinical model of advanced prostate cancer[J].Cancer Res,2010,70(21):8662-73.
[27]Balathasan L,Beech J S,Muschel R J.Ultrasonography-guided intracardiac injection:an improvement for quantitative brain coloni- zation assays[J].Am J Pathol,2013,183(1):26-34.
[28]Zhou H,Chen M,Zhao D.Longitudinal MRI evaluation of in-tracranial development and vascular characteristics of breast cancer brain metastases in a mouse model[J].PLoS One,2013,8(4):e62238.
[29]Stocking K L,Jones J C,Everds N E,et al.Use of low-molecular-weight heparin to decrease mortality in mice after intracardiac injec-tion of tumor cells[J].Comp Med,2009,59(1):37-45.
[30]Romagnoli M,Mineva N D,Polmear M,et al.ADAM8 expression in invasive breast cancer promotes tumor dissemination and metas-tasis[J].EMBO Mol Med,2014,6(2):278-94.
[31]Erin N,Kale S,Tanrńöver G,et al.Differential characteristics of heart,liver,and brain metastatic subsets of murine breast carcino-ma[J].Breast Cancer Res Treat,2013,139(3):677-89.
[32]Cruz-Munoz W,Man S,Xu P,Kerbel R S.Development of a pre-clinical model of spontaneous human melanoma central nervous sys-tem metastasis[J].Cancer Res,2008,68(12):4500-5.
[33]Pishko G L,Muldoon L L,Pagel M A,et al.Vascular endothelial growth factor blockade alters magnetic resonance imaging biomark-ers of vascular function and decreases barrier permeability in a rat model of lung cancer brain metastasis[J].Fluids Barriers CNS,2015,12:5.
[34]Wang J,Daphu I,Pedersen P H,et al.A novel brain metastases model developed in immunodeficient rats closely mimics the growth of metastatic brain tumours in patients[J].Neuropathol Appl Neu-robiol,2011,37(2):189-205.
[35]Serres S,Soto M S,Hamilton A,et al.Molecular MRI enables early and sensitive detection of brain metastases[J].Proc Natl Acad Sci USA,2012,109(17):6674-9.
[36]Kim L S,Huang S,Lu W,et al.Vascular endothelial growth fac-tor expression promotes the growth of breast cancer brain metastases in nude mice[J].Clin Exp Metastasis,2004,21(2):107-18.
[37]Zhao H,Cui K,Nie F,et al.The effect of mTOR inhibition alone or combined with MEK inhibitors on brain metastasis:an in vivo a-nalysis in triple-negative breast cancer models[J].Breast Cancer Res Treat,2012,131(2):425-36.
[38]Chen S,Sanjana N E,Zheng K,et al.Genome-wide CRISPR screen in a mouse model of tumor growth and metastasis[J].Cell,2015,160(6):1246-60.
Animal models of brain metastasis:preparation methods and research progress
CUI Bai-ping1,CHEN Ping2,SUN An-yang1
(1.Laboratory of Neurodegenerative Diseases and Repair,Yancheng Institute of Health Sciences;2.Dept of Oncology,Yancheng First People′s Hospital,Yancheng Jiangsu 224005,China)
Brain metastasis(BM)is a common brain tumor in a-dults,originating from extracranial location in the body.There has been a growing interest in producing suitable animal models for studying BM in vivo.Current BM models take peripheral or brain route for tumor cell inoculation,including intra-cardiac or intra-carotid artery injection or orthotopic injection.Direct im-plantation of patient tumor biopsies into rodent brain bears ad-vantages of clinical relevance.This review presents a compre- hensive introduction to key elements for establishing animal mod-els of BM,with highlights on selections of suitable model ani-mals,brain-seeking tumor cell lines,reasonable inoculation routes,as well as succedent phenotyping methods.In the end,perspectives and future directions in this field are discussed.
brain metastasis;tumor;animal models;nude mice;cell inoculation;model preparation;model evaluation
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.004.html
10.3969/j.issn.1001-1978.2016.03.002
A
1001-1978(2016)03-0304-06
R-05;R363-332;R739.41;R73-37
2015-10-30,
2015-12-20
崔白苹(1987-),女,硕士,讲师,研究方向:神经系统疾病,E-mail:cuibaiping@126.com;陈 平(1963-),女,主任医师,教授,研究方向:肿瘤转移与治疗,共同第一作者,E-mail:doc_pchen@126.com;孙安阳(1966-),男,博士,教授,研究方向:神经系统疾病,通讯作者,E-mail:asun08@fudan.edu.cn
