八肽胆囊收缩素及其受体拮抗剂对吗啡戒断大鼠脑内CaMKⅡ蛋白表达的影响
2016-05-10张雅静杨胜昌马春玲
张雅静,文 迪,杨胜昌,于 峰,马春玲,丛 斌
(1.河北医科大学法医系,河北省法医学重点实验室,河北石家庄 050017;2.石家庄市第一医院肿瘤内科,河北石家庄 050011)
八肽胆囊收缩素及其受体拮抗剂对吗啡戒断大鼠脑内CaMKⅡ蛋白表达的影响
张雅静1,2,文 迪1,杨胜昌1,于 峰1,马春玲1,丛 斌1
(1.河北医科大学法医系,河北省法医学重点实验室,河北石家庄 050017;2.石家庄市第一医院肿瘤内科,河北石家庄 050011)
目的 观察八肽胆囊收缩素(CCK-8)、CCK-1受体拮抗剂L-364,718及CCK-2受体拮抗剂LY-288,513对吗啡戒断大鼠额叶皮质、海马、纹状体细胞内钙/钙调蛋白依赖性的蛋白激酶Ⅱ(CaMKⅡ)表达的影响。方法 建立吗啡依赖及纳洛酮催促戒断大鼠模型,观察CCK-8、L-364,718及LY-288,513对吗啡依赖大鼠戒断症状的影响;采用Western blot方法检测上述脑区CaMKⅡ蛋白表达的变化。结果①CCK-8、L-364,718及LY-288,513能明显改善吗啡依赖大鼠戒断症状的发生;②与盐水对照组相比,吗啡依赖组大鼠额叶皮质、海马、纹状体细胞内CaMKⅡ蛋白表达明显升高;纳洛酮催促戒断后上述脑区CaMKⅡ蛋白表达较吗啡依赖组均明显降低;③CCK-8、L-364,718及LY-288,513均使吗啡戒断大鼠额叶皮质、海马及纹状体内CaMKⅡ蛋白表达升高。结论 CaMKⅡ参与了吗啡依赖及戒断的形成,CCK-8及其受体拮抗剂抑制吗啡依赖大鼠戒断反应的机制可能与其对相关脑区CaMKⅡ蛋白表达的调节有关。
八肽胆囊收缩素;L-364,718;LY288,513;吗啡依赖;吗啡戒断;钙/钙调蛋白依赖性的蛋白激酶Ⅱ
阿片类物质长期滥用引起了相关脑区神经突触可塑性的改变,导致阿片类成瘾,一旦断药,将出现以戒断症状为表现的生理功能紊乱,并导致患者产生复吸,因此寻找安全、快速、有效的脱毒方法刻不容缓。八肽胆囊收缩素(cholecystokinin,CCK-8)作为最强的内源性抗阿片肽类物质,通过与CCK-1和CCK-2受体结合而发挥生物学效应。我室既往研究已证实,CCK-8及其受体拮抗剂可以翻转纳洛酮催促戒断后所致相关脑区细胞内钙离子([Ca2+]i)和钙调蛋白(CaM)活性的下降[1]。CaMKⅡ作为Ca2+-CaM-CaMKⅡ信号转导通路中的下游信号分子,在调节学习记忆和突触可塑性中发挥重要作用[2-3]。因此本实验将重点研究CCK-8及其受体拮抗剂L-364,718及LY-288,513对吗啡依赖大鼠戒断反应的影响是否与调节相关脑区细胞内CaMKⅡ蛋白表达有关,为戒毒提供新的治疗策略。
1 材料与方法
1.1 药品和试剂 盐酸吗啡(morphine hydrochlo-ride,Mor)为沈阳第一制药厂产品;CCK-8、纳洛酮(naloxone,Nal)购自美国Sigma公司,CCK-1受体拮抗剂(L-364,718)及CCK-2受体拮抗剂(LY-288,513)购自英国Tocris公司,CaMKⅡ兔抗大鼠单克隆抗体购自美国Cell Signaling公司,HRP-山羊抗兔IgG购自美国KPL公司。
1.2 动物分组及给药方式 清洁级健康♂Wistar大鼠42只,体质量190~210 g,由河北省实验动物中心提供。实验前适应性饲养1周,室温(22± 1)℃,湿度50%,自然昼夜循环非直接光照条件生活,通风良好,自由摄食、饮水。适应性饲养1周后,参照文献[4]建立大鼠慢性吗啡依赖及纳洛酮急性催促戒断模型:以递增法连续皮下注射吗啡(10、20、30、40、50 mg·kg-1)5 d,每天2次,间隔12 h (8:00、20:00),记录每日大鼠体重变化。d 6,8:00皮下注射吗啡50 mg·kg-1,2 h后腹腔注射盐酸纳洛酮(5 mg·kg-1)进行催促戒断,记录戒断后15 min大鼠跳跃次数及1 h后体重变化。然后用改良Gellert-Holtzman法[5]评价模型建立是否成功,剔除未成模动物。具体分组如下,①盐水对照组(Con-trol):背部皮下注射同等剂量的生理盐水;②吗啡依赖组(Mor):按照上述方案进行吗啡皮下注射;③戒断组(Nal):按照上述方案进行吗啡皮下注射,2 h后进行纳洛酮催促戒断;④~⑥:慢性药物干预组(CCK-8、L-364,718、LY-288,513):每次给予吗啡前30min腹腔内分别注射CCK-8(50 μg·kg-1)、L-364,718(1 mg·kg-1)、LY-288,513(1 mg·kg-1),余同③;⑦溶剂对照组(Vehice):每次给予吗啡前30 min,注射同等体积的溶剂(DMSO∶1,3-丙二醇=1∶4,1 mL·kg-1),余同③。
1.3 大鼠脑组织的急性分离 实验结束后大鼠行断头术,取脑放入定位模具内,参照大鼠脑立体定位图谱(Paxinos and Watson,1998),冰浴下分离额叶皮质、海马和纹状体,立即置液氮内保存,后移入-70℃的冰箱内。
1.4 Western blot法检测CaMKⅡ蛋白的表达临用前称重脑组织,参照文献提取组织蛋白加入预冷的含PMSF的总蛋白提取液(20 mmol·L-1Tris-HCL pH 7.4,0.5%NP-40,0.5%脱氧胆酸钠,50 mmol·L-1NaF,5 mmol·L-1EDTA,1 mmol·L-1PMSF,5 mg·L-1亮肽酶,5 mg·L-1抑肽酶,1 mmol ·L-1DTT,1 mmol·L-1Na3VO4),冰浴上匀浆,匀浆液置于1.5 mL EP管中,冰上裂解1 h,每隔10 min在漩涡震荡器上混匀一次,4℃14 000×g离心10 min,取上清,用考马斯亮兰法定量蛋白浓度。取各组蛋白70 μg,与等体积的上样缓冲液混合后,煮沸5 min,使蛋白充分变性,将样品在4%及10%的SDS-聚丙烯凝胶中进行电泳2 h后,转印至硝酸纤维膜上。用含5%人脱脂奶粉的TBST室温封闭1 h后,加入相应一抗,4℃过夜。TBST充分漂洗3次后加入HPR标记的山羊抗兔IgG二抗,室温作用2 h,TBST充分漂洗3次,ECL法显色1~3 min,暗盒曝光1 min,显影,定影。
1.5 统计学处理 显影后将条带扫描至计算机中,用Image J图像分析系统进行光密度扫描,以各组目的蛋白条带光密度值对内参蛋白光密度值计算相对比值,以Control组该比值为100%,其余各组与之相比,再次计算比值为统计值(±s),各组均数的比较行单因素方差分析(ANOVA),用最小显著差法(LSD)作两两比较。
2 结果
2.1 吗啡催促戒断模型的成功建立 吗啡依赖大鼠在给予纳洛酮催促戒断后,出现了体重下降、跳跃、湿狗样抖动、腹泻、流泪、齿颤、流涎等戒断症状。CCK-8、L-364,718及LY-288,513明显抑制了催促戒断大鼠的体重下降及Gellert-Holtzman评分(Tab 1)。
2.2 CCK-8及其受体拮抗剂对额叶皮质细胞内CaMKⅡ蛋白表达的影响 慢性吗啡处理后,大鼠额叶皮质细胞内CaMKⅡ蛋白表达与对照组比较明显升高(P<0.01);纳洛酮催促戒断后,额叶皮质细胞内CaMKⅡ蛋白表达与吗啡依赖组比较明显降低(P<0.01);CCK-8及其受体拮抗剂预处理后使吗啡戒断大鼠额叶皮质细胞内CaMKⅡ蛋白表达与戒断组相比明显升高(P<0.01);溶剂对照组额叶皮质细胞内CaMKⅡ蛋白表达与戒断组相比差异无显著性(P>0.05)。见Fig 1。
Tab 1 Effects of CCK-8 and its receptor antagonist on body weight loss and Gellert-Holtzman scores of morphine withdrawal rats(±s,n=6)
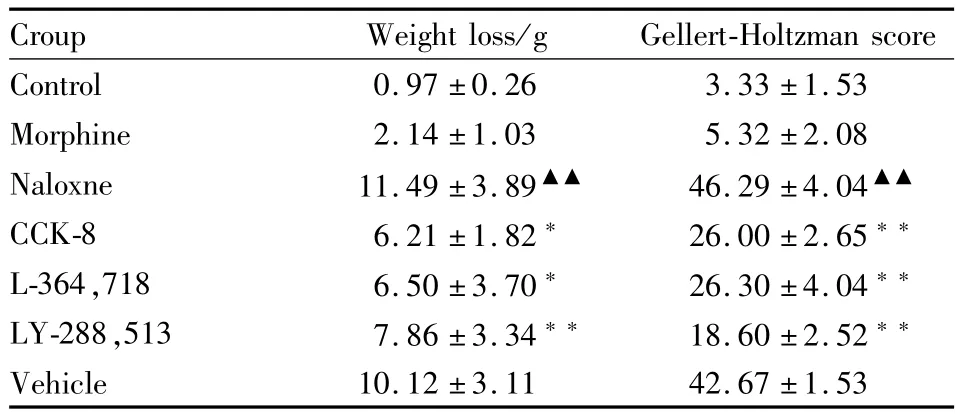
Tab 1 Effects of CCK-8 and its receptor antagonist on body weight loss and Gellert-Holtzman scores of morphine withdrawal rats(±s,n=6)
▲▲P<0.01 vs Mor group;*P<0.05,**P<0.01 vs Nal group
Croup Weight loss/g Gellert-Holtzman score Control 0.97±0.26 3.33±1.53 Morphine 2.14±1.03 5.32±2.08 Naloxne 11.49±3.89▲▲ 46.29±4.04▲▲CCK-8 6.21±1.82* 26.00±2.65**L-364,718 6.50±3.70* 26.30±4.04**LY-288,513 7.86±3.34** 18.60±2.52**Vehicle 10.12±3.11 42.67±1.53
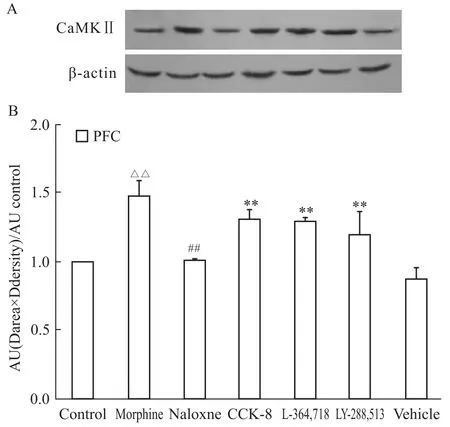
Fig 1 Effects of CCK-8 and its receptor antagonist on expression of CaMKⅡin prefrontal cortex(PFC)of morphine withdrawal rats by Western blot
2.3 CCK-8及其受体拮抗剂对海马细胞内CaMKⅡ蛋白表达的影响 慢性吗啡处理后,大鼠海马细胞内CaMKⅡ蛋白表达与对照组比较明显升高(P <0.01);纳洛酮催促戒断后,海马细胞内CaMKⅡ蛋白表达与吗啡依赖组比较明显降低(P<0.01);CCK-8及其受体拮抗剂预处理使吗啡戒断大鼠海马细胞内CaMKⅡ蛋白较戒断组明显升高(P<0.01),溶剂对照组海马细胞内CaMKⅡ蛋白表达与戒断组相比差异无显著性(P>0.05)。见Fig 2。
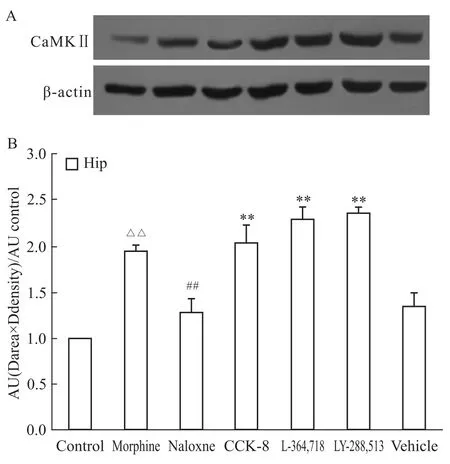
Fig 2 Effects of CCK-8 and its receptor antagonist on expression of CaMKⅡin hippocampus(Hip)of morphine withdrawal rats by Western blot
Tab 2 Effect of CCK-8 and its receptor antagonist on expression of CaMKⅡin prefrontal cortex(PFC),hippocampus(Hip)and cauduate putamen(CPu)of morphine withdrawal rats(±s,n=6)

Tab 2 Effect of CCK-8 and its receptor antagonist on expression of CaMKⅡin prefrontal cortex(PFC),hippocampus(Hip)and cauduate putamen(CPu)of morphine withdrawal rats(±s,n=6)
△△P<0.01 vs control group;##P<0.01 vs Mor group;**P<0.01 vs Nal group.
Group Prefrontal cortex Hippocampus Cauduat e putamen Control 1±0 1±0 1±0 Morphine 1.475±0.109△△1.943±0.071△△1.303±0.167△△Naloxne 1.005±0.011##1.276±0.147##1.008±0.176##CCK-8 1.306±0.069**2.029±0.182**1.358±0.012**L-364,718 1.297±0.021**2.278±0.136**1.368±0.098**LY-288,513 1.194±0.171**2.345±0.057**1.223±0.146**Vehicle 0.874±0.082 1.329±0.158 1.058±0.050
2.4 CCK-8及其受体拮抗剂对纹状体细胞内CaMKⅡ蛋白表达的影响 慢性吗啡处理后,大鼠纹状体细胞内CaMKⅡ蛋白表达与对照组比较明显升高(P<0.01);纳洛酮催促戒断后,纹状体细胞内CaMKⅡ蛋白表达与吗啡依赖组比较明显降低(P<0.01);CCK-8及其受体拮抗剂预处理使吗啡戒断大鼠纹状体细胞内CaMKⅡ蛋白较戒断组明显升高(P<0.01),溶剂对照组纹状体内细胞CaMKⅡ蛋白表达与戒断组相比差异无显著性(P> 0.05)。见Tab 2、Fig 3。

Fig 3 Effects of CCK-8 and its receptor antagonist on expression of CaMKⅡin cauduate putamen(Cpu)of morphine withdrawal rats by Western blot
3 讨论
CaMKⅡ广泛分布于全身,脑内含量尤为丰富,作为一种多功能丝氨酸/苏氨酸蛋白激酶,在神经递质的合成、受体的调节、长时程增强及基因表达等多方面均起到重要作用[6]。慢性吗啡处理的小鼠脊背神经元CaMKⅡ的mRNA及蛋白表达均明显上调[7]。郭庆民等[8]研究发现,DPDPE长时程作用NG108-15细胞后胞质CaMKⅡ活性明显升高,其作用可被CaMKⅡ特异性抑制剂KN-62所拮抗。向海马微注射CaMKⅡ抑制剂能够抑制吗啡耐受和镇痛及纳洛酮所引起的促戒断症状[9]。本研究发现,吗啡依赖大鼠额叶皮质、海马和纹状体细胞内CaMKⅡ蛋白表达较对照组明显增强,而纳洛酮促戒断则使CaMKⅡ蛋白表达明显下降,提示CaMKⅡ参与了阿片类药物的成瘾。其机制可能是阿片类物质通过上调细胞内Ca2+通道的数目及增强突触的Ca2+摄取能力,导致细胞内Ca2+的增多,增多的Ca2+与CaM相结合,藉此激活CaMKⅡ。溶剂组大鼠皮质、海马及纹状体细胞内CaMKⅡ蛋白表达同戒断组相比无明显变化,这表明溶剂对细胞内CaMKⅡ蛋白的表达无影响,进一步说明拮抗剂组细胞内CaMKⅡ蛋白表达的变化与溶剂无关。
阿片类成瘾是一种慢性、复发性脑病,涉及复杂的神经机制。目前常用的治疗方法为替代治疗和对症治疗。所谓的替代治疗是以另一种阿片类似物进行替代来缓解成瘾者的戒断症状,但随着替代药物的应用,会引起成瘾的再次发生,因此并非真正意义上的治疗;而对症治疗是应用非阿片类物质来进行治疗,避免了二次成瘾的可能,为目前较为理想的治疗方法。CCK-8作为迄今体内最强的“抗阿片肽”[10],在疼痛的调节、学习记忆的形成、负面情绪的管理等多方面起着重要的作用[11]。内源性CCK-8的释放参与了阿片类成瘾的形成,应用CCK-8受体拮抗剂能减轻吗啡戒断症状[10],对药物依赖的治疗具有重要价值[12]。本室前期研究也证实,CCK-8受体拮抗剂可减轻纳洛酮引起的急性催促戒断症状[13]。外源性CCK-8作为一种强效CCK受体激动剂,其相关研究并未得到与CCK受体拮抗剂完全相反的结论。外源性给予CCK-8同样可减轻戒断症状[14],抑制吗啡精神依赖及复吸过程[15],其机制可能与外源性CCK-8的剂量浓度、应用方式及应用时间有关,具体机制有待进一步研究。本实验中我们也观察到CCK-8、L-364,718、LY-288,513干预后翻转了纳洛酮戒断引起的额叶皮质、海马及纹状体细胞内CaMKⅡ蛋白表达的下降,且与前期研究中CaM变化趋势一致。由此可见,相关脑区细胞内CaMKⅡ蛋白表达与吗啡成瘾、戒断密切相关,而CCK-8及其受体拮抗剂可通过影响CaMKⅡ蛋白的表达及其相关信号转导通路拮抗纳洛酮引起的急性戒断症状的发生,为将来戒毒治疗提供新的策略。
(致谢:本实验在河北医科大学法医系所属实验室完成。参与人员:张雅静、文迪、杨胜昌、于峰、马春玲、丛斌。在此对所有给予本实验支持和帮助的老师及同学表示衷心感谢。)
[1] 张雅静,马兴友,文 迪,等.八肽胆囊收缩素及其受体拮抗剂对吗啡戒断大鼠脑内[Ca2+]i和CaM活性的影响[J].中国药理学通报,2014,30(1):35-8.
[1] Zhang Y J,Ma X Y,Wen D,et al.Effects of CCK-8 and its recep-tor antagonists on[Ca2+]iand CaM activity in morphine with-drawal rats[J].Chin Pharmacol Bull,2014,30(1):35-8.
[2] 徐 浩,王 勃,段燕红,曹晓华.βCaMKⅡ过量表达损害小鼠海马齿状回区长时程抑制[J].华东师范大学学报,2012,1:54-62.
[2] Xu H,Wang B,Duan Y H,Cao X H.βCaMKⅡoverexpression impairs long-term depression in dentate gyrus of mice[J].China Normal Univ,2012,1:54-62.
[3] Cao X,Wang H,Mei B,et al.Inducible and selective erasure of memories in the mouse brain via chemical-genetic manipulation [J].Neuron,2008,60:353-66.
[4] 谷建平,丛 斌,朱桂云,等.褪黑素对吗啡戒断大鼠脑内cAMP和cGMP含量的影响[J].中国药物依赖性杂志,2005,14(1):24-6.
[4] Gu J P,Cong B,Zhu G Y,et al.Effects of melatonin on cAMP and cGMP contents in some brain regions of morphine withdrawl rats[J].Chin J Drug Depend,2005,14(1):24-6.
[5] Gellert V F,Holtzman S G.Development and maintenance of mor-phine tolerance and dependence in the rat by scheduled access to morphine drinking solutions[J].J Pharmacol Exp Ther,1987,205(3):536-46.
[6] Gavrila LBS,Praver M,Mykles D L,et al.Calcium,calpain,and calcineurin in low-frequency depression of transmitter release[J].J Neurosci,2013,33(5):1975-90.
[7] Chen Y J,Jiang Y,Yue W,et al.Chronic,but not acute morphine treatment,up-regulates alpha-Ca2+/calmodulin dependent pro-tein kinaseⅡgene expression in rat brain[J].Neurochem Res,2008,33(10):2092-8.
[8] 郭庆民,刘景生.阿片类药物对NG108-15细胞Ca2+/钙调蛋白依赖的蛋白激酶Ⅱ信息通路的作用[J].药学学报,2001,36 (9):652-6.
[8] Guo Q M,Liu J S.Effects of opioids on Ca2+/calmodulin depend-ent protein kinase signal pathway in NG108-15 cells[J].Acta Pharm Sin,2001,36(9):652-6.
[9] Wang Y P,Cui H M,Wang W,et al.The region-specific activa-tion of Ca2+/calmodulin dependent protein kinaseⅡand extracel-lular signal-regulated kinases in hippocampus following chronic al-coholexposure[J].Brain Res Bull,2012,89(5-6):191-6.
[10]Mitchell J M,Bergren L J,Chen K S,Fields H L.Cholecystokinin is necessary for the expression of morphine conditioned place pref-erence[J].Pharmacol Biochem Behav,2006,85(4):787-95.
[11]Hebb A L,Poulin J F,Roach S P,et al.Cholecystokinin and en-dogenous opioid peptides:Interactive influence on pain,cognition and emotion[J].Prog Neuropsychopharmacol Biol Psych,2005,29 (8):1225-38.
[12]Lu L,Zhang B,Liu Z,Zhang Z.Reactivation ofcocaine conditioned place preference Induced by stress is reversed by cholecystokinin-B receptors antagonist in rats[J].Brain Res,2002,954(1):132-40.
[13]文 迪,马春玲,丛 斌,等.侧脑室注射八肽胆囊收缩素及其受体拮抗剂对吗啡依赖大鼠戒断症状的影响[J].中国药理学通报,2011,27(10):1363-8.
[13]Wen D,Ma C L,Cong B,et al.Effects of CCK-8 and its receptor antagonists given intracerebroventricularly on withdrawal symptom of morphine dependent rats[J].Chin Pharmacol Bull,2011,27 (10):1363-8.
[14]文 迪,马春玲,丛 斌,等.CCK-8及其受体拮抗剂对吗啡戒断大鼠额叶皮质、尾壳核、海马阿片受体的影响[J].中国药理学通报,2010,26(7):867-71.
[14]Wen D,Ma C L,Cong B,et al.Effects of CCK-8 and its receptor antagonists on opioid receptor in prefrontal cortex,cauduate puta-men and hippocampus of morphine withdrawal rats[J].Chin Phar-macol Bull,2010,26(7):867-71.
[15]Wen D,Cong B,Ma C L,et al.The effects of exogenous CCK-8 on the acquisition and expression of morphine-induced CPP[J].Neu-rosci Lett,2012,510(1):24-8.
Effects of CCK-8 and its receptor antagonists on CaMKⅡexpression of morphine withdrawal rats
ZHANG Ya-jing1,2,WEN Di1,YANG Sheng-chang1,Ma Chun-ling1,CONG Bin1
(1.Dept of Forensic Medicine,Hebei Medical University,Hebei Key Lab of Forensic Medicine,Shijiazhuang 050017,China;2.Dept of Medical Oncology,the First Hospital of Shijiazhuang,Shijiazhuang 050011,China)
Aim To observe the effects of CCK-8 and its receptor antagonists(L-364,718;LY288,513)on CaMKⅡexpression in prefrontal cortex(PFC),hippo-campus(Hip)and cauduate putamen(CPu)of mor-phine withdrawal rats.Methods A physical morphine-dependent model in rats was established by subcutane-ous injection of morphine in gradually increasing doses for 5 consecutive days.The expression of CaMKⅡin prefrontal cortex,hippocampus and striatum of rats was assayed by Western blot.Results ①CCK-8 and its receptor antagonists could relieve the morphine with-drawal symptoms of the rats.②Compared with control group morphine dependence increased CaMKⅡexpres- sion in prefrontal cortex,hippocampus and striatum.Following naloxone precipitation,CaMKⅡexpression significantly decreased.③CCK-8 and its receptor an-tagonists pre-treatment significantly increased CaMKⅡexpression in prefrontal cortex(PFC),hippocampus and striatum of morphine withdrawal rats.Conclusion The inhibitory effect of CCK-8 and its receptor an-tagonists on withdrawal syndrome of morphine-depend-ent rats may be related to the increase of CaMKⅡex-pression in specific brain regions.
cholecystokinin;L-364,718;LY 288,513;morphine dependence;morphine withdrawal;CaMKⅡ
时间:2016-2-26 10:20 网络出版地址:http://www.cnki.net/kcms/detail/34.1086.R.20160226.1020.014.html
10.3969/j.issn.1001-1978.2016.03.007
A
1001-1978(2016)03-0327-05
R-332;R322.81;R341;R345.57;R347.923;R392.11;R749.61;R971.2
2015-11-24,修回时间:2015-12-26
国家自然科学基金资助项目(No 81273337,30672355);河北省应用基础研究重点研究项目(No 10966911D)
张雅静(1982-),女,硕士,主治医师,研究方向:物质成瘾,E-mail:zyjjkw@126.com;马春玲(1964-),女,教授,博士生导师,研究方向:法医毒理学,通讯作者,E-mail:chunlingma@126.com;丛 斌(1957-),男,博士,中国工程院院士,博士生导师,研究方向:法医物证学、法医毒理学,通讯作者,E-mail:hbyd-congbin@126.com
