新型单羟基氯代咔咯的合成及其光断裂DNA性质
2016-05-09杨文聪曾淑莹莫婷婷汪华华刘海洋
史 蕾, 杨文聪, 曾淑莹, 莫婷婷, 汪华华, 刘海洋
(1. 广东第二师范学院 化学系,广东 广州 510303; 2. 华南理工大学 化学与化工学院,广东 广州 510640)
·快递论文·
新型单羟基氯代咔咯的合成及其光断裂DNA性质
史 蕾1*, 杨文聪1, 曾淑莹1, 莫婷婷1, 汪华华2, 刘海洋2
(1. 广东第二师范学院 化学系,广东 广州 510303; 2. 华南理工大学 化学与化工学院,广东 广州 510640)
以五氟苯甲醛和吡咯经缩合反应合成了五氟苯基二吡咯烷烃(1); 1与3-氯-4-羟基苯甲醛经缩合反应合成了一个新的10-位苯环被氯原子取代的单羟基自由咔咯——10-(3-氯-4-羟苯基)-5,15-二(五氟苯基)咔咯(2),收率12.0%,其结构经UV-Vis,1H NMR,19F NMR, HR-ESI-MS和X-射线单晶衍射表征。琼脂糖凝胶电泳实验发现:2在光照下能够有效引起超螺旋质粒pBR 322 DNA发生断裂,当浓度为100 μmol·L-1时,活性最强,断裂百分比为68%。
五氟苯甲醛; 咔咯; 合成; 晶体结构; 光断裂; DNA
咔咯是与卟啉具有相似结构的大环化合物,未与金属配位的称为自由咔咯,咔咯与金属配位后可形成高价态的金属咔咯[1-2]。咔咯是一种新型光敏剂,在光动力治疗(PDT)方面与卟啉相比表现出优良的性能,如在可见光区具有更强的吸收、更大的斯托克斯位移以及在新陈代谢中更容易分解[3-4]。卟啉类光敏剂能够选择性地聚集在肿瘤细胞并且在光照条件下引起细胞的损伤,并且卟啉诱导的DNA光断裂在过去几年已经被广泛报道[5-9]。然而,有关咔咯光断裂DNA的研究相对较少。2007年,SanKar等[10]合成了氧杂咔咯铜衍生物,发现其在光照下能够有效断裂DNA。本课题组[11]制备了一系列含卤族元素氟、氯、溴和碘的单羟基自由咔咯衍生物,发现咔咯的重原子效应对其单线态氧量子产率和光核酸酶活性均有影响。之后我们又合成了一系列咔咯-吩噻嗪二元体、水溶性咔咯及其镓配合物[12-15],吩噻嗪的引入可以提高咔咯的光核酸酶活性,然而,与自由咔咯相比,与镓配位后其光断裂效果较弱。
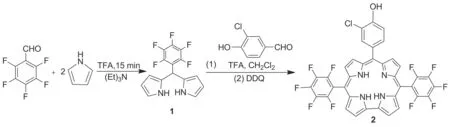
Scheme 1
本文以五氟苯甲醛和吡咯经缩合反应合成了五氟苯基二吡咯烷烃(1); 1与3-氯-4-羟基苯甲醛经缩合反应合成了一种10-位苯环被氯原子取代的单羟基自由咔咯——10-(3-氯-4-羟苯基)-5,15-二(五氟苯基)咔咯(2, Scheme 1),收率12.0%,其结构经UV-Vis,1H NMR,19F NMR, HR-ESI-MS和X-射线单晶衍射表征。并通过琼脂糖凝胶电泳实验研究了其光断裂DNA性质。
1 实验部分
1.1 试剂与仪器
UV-Vis 2450型紫外可见分光光度计(甲苯为溶剂);AVANCE Digital 400 MHz型傅里叶变换核磁共振仪(CDCl3为溶剂,TMS为内标);Agilent1290/maXis impact型超高压液相色谱-高分辨质谱联用仪;Oxford SuperNova TM型X-射线单晶衍射仪;31-CN型凝胶电泳仪;BIO-RAD Gel Dox XR+凝胶自动成像分析系统(用COM3,开启302 nm光源)。
Tris-HCl缓冲溶液I和II参考文献[18]方法配制;pBR 322DNA,大连宝生物工程有限公司;三羟甲基甲胺(Tris)、生物氯化钠(NaCl)、硼酸(H3BO3)、琼脂糖、溴酚蓝、溴化乙锭(EB),生物纯,上海生工生物工程公司;实验用水为去离子水;其余所用试剂均为分析纯。
1.2 合成
(1) 1的合成[16-17]
在反应瓶中加入五氟苯甲醛1.96 g(10 mmol)和吡咯50 mL,搅拌使其均匀;加入TFA 15 μL,于室温反应15 min,加入三乙胺30 μL中和TFA。减压蒸馏(120 ℃)除去过量吡咯,残余物经硅胶柱层析[洗脱剂:A=V(二氯甲烷) ∶V(正己烷)=1 ∶2,收集淡黄色条带]纯化得淡黄色粉末1,收率78.0%。
(2) 2的合成
在反应瓶中加入1 499.2 mg(0.80 mmol)和二氯甲烷50 mL,搅拌使其溶解;加入3-氯-4-羟基苯甲醛62.8 mg(0.40 mmol)和TFA 20 μL,于室温反应7 h;注入三乙胺40 μL中和TFA;加入2,3-二氯-5,6-二氰对苯醌(DDQ)182.0 mg(0.8 mmol),于室温反应2 h。经硅胶柱层析(先用二氯甲烷淋洗除去DDQ,梯度洗脱剂:A=1 ∶3~1 ∶2)纯化得紫色粉末2,收率12.0%; UV-Visλmax(relative intensity): 422.0(0.85), 563.5(0.17), 611.0(0.09) nm;1H NMRδ: 7.39(d,J=10.8 Hz, 1H, ArH), 8.00(d,J=11.6 Hz, 1H, ArH), 8.15(br s, 1H, ArH), 8.58(br s, 2H, pyrrole-H), 8.72(br s, 4H, pyrrole-H), 9.12(d,J=7.6 Hz, 2H, pyrrole-H);19F NMRδ: -162.1(m, 4F), -153.1(m, 2F), -138.3(m, 4F); HR-ESI-MSm/z: Calcd for C37H15N4OF10Cl {[M]+}756.077 5, found 756.049 8。
1.3 单晶培养及晶体结构测定
将2溶于二氯甲烷,缓慢加入正己烷(A=1 ∶3),静置结晶3 d得紫色晶体。
将2单晶(0.12 mm×0.10 mm×0.02 mm)置衍射仪上,于298(2) K以经石墨单色仪单色化的CuKα射线(λ=1.541 78 Å)以ω-φ方式扫描,共收集衍射点6 165个,其中I>2σ(I)独立衍射点3 342个,并用于结构分析。非氢原子坐标用直接法解出,并对其坐标及其各向异性热参数进行全矩阵最小二乘法修正。氢原子的位置由理论加氢得到,并使用骑式换型位置参数和固定的各向同性热参数加入结构精修。所有计算通过SHELXS-97和SHELXL-97程序包进行。

表1 2的晶体学数据
1.4 光断裂DNA性质测定
采用10 μL的反应体系(在Tris-HCl缓冲溶液I中进行),包含pBR 322 DNA(0.1 μg)和不同浓度的化合物。将反应液在荧光灯(10 W)照射下反应一段时间(将光源和反应液置于避光系统,反应液和荧光灯之间保持10 cm距离)。加入溴酚蓝2 μL终止反应,琼脂糖凝胶(琼脂糖含量1.0%,在Tris-HCl缓冲溶液Ⅱ中进行)电泳2 h(77 V, 30 mA)后,放入EB溶液中染色20 min,置凝胶成像系统中成像,测定Form I和Form Ⅱ型DNA所占的百分比。
2 结果与讨论
2.1 晶体结构
2(CCDC: 1 448 781)的晶体学参数见表1,晶体结构见图1。
晶体结构分析表明:2属三斜晶系,P-1空间群。2中大环的四个吡咯环不完全在同一平面上,与大环平面均有一定程度的偏离,四个吡咯环与拟合得到的大环平面的夹角分别为11.720 °, 10.271 °, 22.224 °和8.908 °。三个meso-位取代苯环与咔咯大环平面的夹角分别为:63.339 °, 70.001 °和50.866 °。 2中存在明显的π-π相互作用,咔咯大环与上下相邻两个大环平面的距离分别为3.623 8 Å和3.627 7 Å。
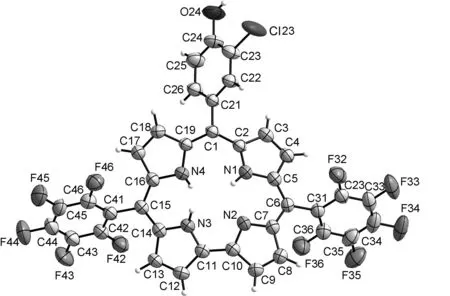
图1 2的晶体结构图
2.2 光断裂DNA性质研究
DNA是许多抗肿瘤药物在生物体内的重要靶标分子,小分子在光照下与DNA相互作用导致的DNA损伤,有可能影响相关蛋白质翻译从而抑制肿瘤细胞增殖,最终导致癌细胞凋亡[19]。本文对不同浓度2对pBR 322 DNA的光断裂行为进行了考察,结果见图2。

图2 2的光断裂DNA的琼脂糖凝胶电泳图*
Figure 2 Agarose gel electrophoresis pattern of 2 for
the cleavage of supercoiled pBR 322 DNA
*样品(10 μL)包含0.1 μg质粒DNA, 2 和 5%DMF,泳道1:仅DNA,泳道2:DNA+100 μM 2(无光照),泳道 3~6: DNA分别加10, 40, 70, 100 μM 2(光照2 h)。
从图2可见,DNA空白样品以及加入2而没有光照条件下均没有发现DNA有明显的断裂;在浓度为10 μmol·L-1,用10 W的荧光灯照射2 h, 2能使25%的Form I DNA转变为Form II DNA,增大样品浓度,其光断裂DNA的活性相应增强;当浓度为100 μmol·L-1时,其光断裂DNA的活性最强,断裂百分比为68%。2的光断裂DNA行为与我们之前合成的一系列卤代咔咯类似[11]。该研究结果对于开拓新型的PDT光敏剂及临床光动力治疗药物提供相应的理论基础和实验依据。
3 结论
以五氟苯甲醛为起始原料合成了一个新的10-位苯环被氯原子取代的单羟基自由咔咯——10-(3-氯-4-羟苯基)-5,15-二(五氟苯基)咔咯。该化合物能够在光照下有效引起超螺旋质粒DNA发生断裂。该研究结果对于开拓新型的核酸酶试剂、以及从分子水平了解这类化合物作为光动力治疗药物的作用机制和构效关系提供重要的理论基础和实验依据。
[1] Gross Z, Galili N, Saltsman I,etal. The first direct synthesis of corroles from pyrrole[J].Angew Chem Int Ed,1999,38(10):1427-1429.
[2] Grodkowski J, NetaI, Fujita E,etal. Reduction of cobalt and iron corroles and catalyzed reduction of CO2[J].J Phys Chem A,2002,106:4772-4778.
[3] Paolesse R, Marini A, Nardis S,etal. Novel routes to substituted 5,10,15-triaryl corroles[J].J Porphyr Phthalocya,2003,7(1):25-36.
[4] Ventura B, Degli E, Gryko D T,etal. Photophysical characterization of free-base Corroles,promising chromophores for light energy conversion and singlet oxygen generation[J].New J Chem,2005,29(12):1559-1566.
[5] Henderson B W, Sumlin A B, Owczarczak B L,etal. Bacteriochlorophyll-a as photosensitizer for photodynamic treatment of transplantable murine tumors[J].J Photochem Photobiol B,1991,10(4):303-313.
[6] MacDonald I J, Morgan J, Bellnier D A,etal. Subcellular localization patterns and their relationship to photodynamic activity of pyropheophorbide-a derivatives[J].Photochem Photobiol,1999,70(5):789-797.
[7] Dougherty T J, Gomer C J, Henderson B W,etal. Photodynamic therapy[J].J Nati Cancer,1998,90(12):889-905.
[8] Bonnett R, Martinez G. Photobleaching of sensitisers used in photodynamic therapy[J].Tetrahedron,2001,57:9513-9547.
[9] Kim Y S, Song R, Kim D H,etal. Synthesis,biodistribution and antitumor activity of hematoporphyrin-platinum(II) conjugates[J].Bioorg Med Chem,2003,11:1753-1760.
[10] Sankar J, Rath H, Prabhuraja V,etal. meso-meso-linked corrole dimers with modified cores:Synthesis,characterization,and properties[J].Chem Eur J,2007,13:105-114.
[11] Shi L, Liu H Y, Si L P,etal. The heavy atom effect on photocleavage of DNA by mono-hydroxyl halogenated corroles[J].Chin Chem Lett,2010,21:373-375.
[12] Shi L, Liu H Y, Peng K M,etal. Synthesis of phenothiazine-corrole dyads:The enhanced DNA photocleavage properties[J].Tetrahedron Lett,2010,51:3439-3442.
[13] Shi L, Jiang H F, Yi W,etal. Synthesis,fluorescence and DNA photocleavage activity of phenothiazine-corrole Gallium(III) complexes[J].Acta Phys-Chim Sin,2012,28(2):465-469.
[14] Huang J T, Zhang Y, Wang X L,etal. DNA binding and photonuclease activity of sulfonated corrole and its gallium(III) complex[J].Chinese J Inorg Chem,2013,29(8):1649-1656.
[15] Wang J M, Shi L, Liu H Y. Theinteraction of corrole and its metal complex with DNA and their anti-tumor activity[J].Progress in Chem,2015,27(6):755-762.
[16] Gryko D T. A simple,rational synthesis of meso-substituted A2B-Corroles[J].Chem Commun,2000, 22:2243-2244.
[17] Gryko D T, Jadach K. A simple and versatile one-pot synthesis ofmeso-substitutedtrans-A2B-corroles[J].J Org Chem,2001,66:4267-4275.
[18] Agadjanian H, Ma J, Rentsendorj A,etal. Tumor detection and elimination by a targeted gallium corrole[J].Proc Natl Acad Sci,2009,106:6105-6110.
[19] Song Y M, Wu Q, Yang P J,etal. DNA binding and cleavage activity of Ni(II) complex with all-trans retinoic acid[J].J Inorg Biochem,2006,100:1685-1691.
Synthesis of A Novel Mono-hydroxyl Chloro-corrole and Its Photocleavage of DNA
SHI Lei1*, YANG Wen-cong1, ZENG Shu-ying1,MO Ting-ting1, WANG Hua-hua2, LIU Hai-yang2
(1. Department of Chemistry, Guangdong University of Education, Guangzhou 510303, China;2. School of Chemistry and Chemical Engineering, South China University of Technology, Guangzhou 510640, China)
5-(Pentafluoro-phenyl)-dipyrromethane(1) was prepared by condensation reaction of pentafluorobenzaldehyde with pyrrole. A novel mono-hydroxyl corrole, 10-(3-chloro-4-hydroxylphenyl)-5,15-bis(pentafluorophenyl) corrole(2) with yield of 12.0%, was synthesized by condensation reaction of 1 with 3-chloro-4-hydroxylbenzaldehyde. The structure was characterized by UV-Vis,1H NMR,19F NMR, HR-ESI-MS and X-ray single crystal diffraction. Agarose gel electrophoresis showed that 2 could cleave 68% supercoiled DNA(form I) to give nicked-circular DNA(form II) under irradiation at 100 μmol·L-1.
pentafluorobenzaldehyde; corrole; synthesis; crystal structure; photocleavage; DNA
2015-12-21
大学生创新项目(国家级); 广东省自然科学基金资助项目(S2012040006270); 广东大学生科技创新培育专项资金(攀登计划专项资金)项目
史蕾(1982-),女,汉族,广东广州人,博士,讲师,主要从事Corrole大环的合成及其性质研究。 Tel. 020-34113254, E-mail: shil@gdei.edu.cn
O614.81
A
10.15952/j.cnki.cjsc.1005-1511.2016.04.15408
