国家结核病规划指南
——儿童结核病管理(第2版)
2016-05-09焦伟伟孙琳肖婧李洁琼申晨申阿东
焦伟伟孙 琳肖 婧李洁琼申 晨申阿东
国家结核病规划指南
——儿童结核病管理(第2版)
焦伟伟1,2孙琳1,2肖婧1,2李洁琼1申晨1申阿东1
作者单位1首都医科大学附属北京儿童医院北京,100045; 2共同第一作者
编者按国家结核病规划指南——儿童结核病管理(第2版)为WHO制定的循证指南,共分为9个部分,本文主要翻译了其中的5个部分(方法学,儿童结核病的诊断,儿童结核病的预防,儿童结核病的治疗和国家结核病防治规划的实施),方法学部分做了归纳性的翻译,在完全体现指南建议的基础上,对其他4个部分根据中国大陆的实际情况做了部分节译。该指南不是以问题为导向的循证指南,而是对结核病管理的系统论述,其中穿插了指南制定小组认为非常重要的28条推荐意见。由于文章篇幅较长,读者重点阅读时可选择用另色标注的建议。
1 方法学
依照WHO循证指南的编写程序编制,以GRADE作为证据评估、分级和推荐的方法。
指南指导小组基于2006版指南(第1版)的框架,回顾了WHO所有有关儿童结核病的建议,包括了最近出版在WHO政策文件和指南中的建议。
确定了如下优先选题,①Xpert结核分枝杆菌/耐药性检测(Xpert MTB/RIF)等新的检测方法应用于儿童结核病诊断,②γ-干扰素释放试验(IGRAs)用于诊断儿童结核病和潜伏结核病,③改进儿童的用药剂量和现有的儿童抗结核药物使用规划的临时指南,④HIV流行地区卡介苗(BCG)的使用,⑤对有HIV接触史儿童的调查和异烟肼预防性治疗(IPT)建议,⑥儿童耐多药结核病的治疗。
国家结核病规划指南——儿童结核病管理(第2版)涉及到的一些建议将来自于16个文件[1~16],其中有许多是成人结核病和结核病/艾滋病的控制方法,并不都明确涉及到儿童。
检索PubMed数据库。检索限定在WHO区域内的低等和中等收入国家的研究文献。检索截止至2012年7月。
检索关键词:结核、儿童、儿科学、诊断、IGRA、Xpert;分子诊断技术、预防、治疗、利福平、异烟肼、吡嗪酰胺、乙胺丁醇、链霉素、疫苗、BCG、HIV、抗逆转录病毒、筛选、耐药性。
在指南指导小组的监管下,委派2名专业人员进行文献阅读。
文献质量评估工具:诊断准确性研究采用QUADAS量表,病例对照研究和队列研究采用NOS量表。对纳入证据进行详细描述。
指南专家组成员以书面形式说明了利益冲突。以GRADE方法依据证据的质量做出推荐意见。根据明显利大于弊行强烈推荐,根据利大于弊或利弊权衡不确定行有条件性推荐。利弊权衡不确定的原因包括:缺乏高质量的证据、有利因素有限、经济效益比不对等和对有利因素不能精确评估。
邀请来自世界各地的专家(具有区域代表性和性别平衡)审阅指南草稿,提出的反馈意见尽可能被纳入修订后的指南。
2 儿童结核病的诊断
2.1儿童结核病诊断现状目前,关于儿童结核病诊断方法多见于专家意见,相关研究文献较少[17~20]。儿童结核病的诊断方法:①详细的询问病史,包括活动性结核病密切接触史和疑似症状等;②临床检查,包括生长评估等;③结核菌素皮肤试验(PPD) ;④条件允许下行X线胸片检查;⑤尽可能获得病原学确诊的证据;⑥辅助检查,提示可能存在肺结核或者肺外结核病;⑦HIV检测。
儿童结核病以肺结核为主。尽管儿童结核病难以获得病原学证据,但仍应根据临床表现,采集呼吸道或非呼吸道标本进行镜检、培养,或者采用WHO推荐的分子生物学方法(如Xpert MTB/RIF)进行检测。不推荐将试验性抗结核药物治疗是否有效作为儿童结核病的诊断方法。
儿童结核病的主要危险因素[12]:①密切接触史,即在家庭或其他环境中与肺结核患者(尤其是与痰抗酸染色阳性或细菌培养阳性)密切接触者;②年龄<5岁;③HIV感染;④严重营养不良。
现有的儿童结核病诊断方法仍存在一定的局限性。所有的诊断方法,包括细菌培养和PPD在内,均易出现假阴性结果。
2.2实验室诊断方法的新进展2006年以后,一些结核病诊断的新方法被相继开发和评估,包括结核菌快速培养技术和分子生物学技术等。例如,WHO推荐的商品化液体培养系统和分子探针试验,虽然成本较高且操作复杂,限制了其在资源匮乏地区的推广和使用,但上述方法均有助于耐多药结核病的快速诊断[21,22]。
2.2.1Xpert MTB/RIF通过全自动化的实时定量PCR方法检测DNA,可在2 h内同时检测结核分枝杆菌和利福平耐药情况,是目前受到较多关注的诊断方法。鉴于其在成人结核病临床评估中具有很好的应用价值,WHO于2011年出版了Xpert MTB/RIF试验的使用指南,但在儿童结核病诊断中的研究数据太少。
儿童痰液标本的检测中,Xpert MTB/RIF试验的敏感度和特异度远高于抗酸染色试验[23~26],但是敏感度仍然显著低于细菌培养或临床诊断。
Xpert MTB/RIF试验主要被推荐用于急需快速诊断的重症疾病患儿。需要指出的是,其阴性结果无法除外活动性结核病存在,仍需要根据临床资料进行综合诊断。
建议1在疑似耐多药结核病或HIV感染的结核病患儿中优先采用Xpert MTB/RIF试验进行初筛,不推荐使用抗酸染色法或细菌培养法[16]。(强烈推荐,研究数据较少)
建议2在疑似结核病儿童中优先采用Xpert MTB/ RIF试验进行初筛,不推荐使用抗酸染色法或细菌培养法[16]。(根据经济情况进行选择,研究数据较少)
建议3对疑似肺外结核病儿童的非呼吸道标本(淋巴和其他组织)进行检测时,Xpert MTB/RIF试验可以替代传统的抗酸染色、细菌培养和或组织病理学等常规诊断方法[16]。(条件性推荐,研究数据较少)
建议4对疑似结核性脑膜炎儿童的脑脊液进行检测时,优先采用Xpert MTB/RIF试验进行初筛,而非抗酸染色和细菌培养[16]。(在急需快速诊断结果的情况下强烈推荐,研究数据较少)
Xpert MTB/RIF试验对处理过或未处理的痰标本均适用;也适用于洗胃后或抽取的胃液标本。单次Xpert MTB/ RIF试验结果阴性的疑似结核病或疑似肺外结核病儿童应采用其他诊断方法进一步确诊;临床高度怀疑罹患肺结核或肺外结核病的儿童,即使Xpert MTB/RIF试验阴性或者无法进行Xpert MTB/RIF试验时,也应该进行抗结核治疗。当急需快速诊断结果时,在脑脊液送检量较少或者无法再抽取脑脊液的情况下,应优先采用Xpert MTB/RIF试验进行初筛,而非细菌培养;如果脑脊液送检量足够,应采用离心法提高检出率。无论采用何种诊断方法,胸腔积液都是结核性胸膜炎病原学确诊的次选标本,胸膜活检组织为首选标本。Xpert MTB/RIF试验在胸腔积液标本中的敏感度很低。胸腔积液Xpert MTB/RIF试验阳性,就要进行结核性胸膜炎的抗结核治疗;如果阴性结果,应采用其他诊断方法进一步确诊。由于目前尚无Xpert MTB/RIF试验在粪、尿和血液标本中诊断的数据,因此不适用于上述标本的检测。
2.2.2血液相关诊断试验IGRAs的原理为通过体外试验,检测机体对结核分枝杆菌特异性抗原的免疫应答。由于IGRAs不受BCG接种的影响,因此与PPD相比,特异度更高。IGRAs在结核病高发国家的儿童中的诊断研究数据较少、质量较低且结论不一,缺乏婴幼儿和小年龄儿童的研究数据。
同PPD一样,IGRAs阳性结果仅能提示结核感染的存在,而无法明确诊断活动性结核病。IGRAs阴性结果也无法除外活动性结核病的存在。在资源匮乏的地区,IGRAs成本较高且操作复杂,在年幼儿童中的不确定率较高。
建议5在中低收入国家,对儿童潜伏结核感染诊断时或对疑似结核病儿童进行诊断性检查时,不建议用IGRAs替代PPD[11]。(强烈推荐,研究数据较少)
在某些国家,一些商品化的血清学诊断方法也被用于结核病的诊断。无论在成人还是儿童中,该方法也不能用于结核病的诊断。2011年WHO出版的指南中,出台相关政策反对或阻止将商品化的血清学诊断方法用于中低收入国家,以及儿童群体中[8,11]。
建议6无论是否感染HIV病毒,商品化的血清学诊断方法都不适用于疑似肺结核或肺外结核病患儿的诊断[8]。(强烈推荐,研究数据较少)
2.2.3HIV检测明确HIV感染对于结核病以及艾滋病的控制具有非常重要的作用,除外HIV共感染的可能同样有助于活动性结核病的快速临床诊断。
建议7考虑结核病或者已诊断结核病的所有患者(包括儿童)应常规检测HIV[13]。(强烈推荐,研究数据较少)
HIV检测应常规用于考虑活动性结核病的儿童或者艾滋病高发地区中具有HIV感染高风险的结核病儿童[27,28]。
2.3儿童结核病诊断推荐方法
2.3.1详细的病史包括活动性结核病接触史和结核病症状。
2.3.1.1接触史具有与活动性结核病患者共同生活或学习的密切接触史。痰涂片阳性的结核病患者的传染性明显高于痰涂片阴性者。<5岁活动性结核病患儿的主要暴露源即家庭内与其密切接触的成员。婴幼儿在家庭环境中暴露于结核病的风险更高。儿童通常在暴露和感染后的1年内发病,因此儿童结核病通常为近期接触[12]。
以下几点对于活动性结核病儿童的诊断具有重要意义[12]:①如果存在结核病的密切接触史,无论是否有临床症状的0~4岁儿童和存在临床症状的≥5岁儿童均应考虑是否存在结核病。②具有密切接触史的HIV感染儿童均应考虑是否存在结核病。③对于明确诊断的结核病患儿,应立即对其家庭中的传染源或尚未明确诊断的活动性结核病患者进行筛查和管理。④对于传染性结核病患儿,应对其接触过的儿童进行筛查。痰涂片阳性的肺结核患儿或者X线胸片提示的空洞型肺结核患儿(多见于年长儿或者青少年)均具有传染性。
2.3.1.2症状在多数情况下,结核病患儿表现为慢性、持续性症状,例如对肺炎进行抗生素治疗、对发热进行抗疟疾药物治疗和对营养不良的支持治疗时,症状持续≥2周无明显改善或仍未治愈。最常见症状包括:咳嗽、发热、纳差、体重减轻或营养不良、乏力和活动减少。
除了要询问是否存在体重减轻或营养不良外,如有可能,查看儿童的生长曲线表非常重要。不同类型的肺外结核病根据其不同的发病部位,往往还存在其他症状,例如肿大的淋巴结、背部肿胀和抽搐。
结核病症状诊断的特异度,取决于对该症状定义的精确程度。目前尚无用于诊断的症状临界值,如症状持续时间等。在重症结核病和预后较差的高危人群,如婴幼儿、HIV感染儿童和重症营养不良儿童[17]中,以特定症状为标准时诊断的敏感度和特异度均较低。
2.3.2临床检查在临床检查(包括生长评估)中,尚无特异症状和体征可以准确提示肺结核存在。某些体征虽然不常见,但仍高度提示肺外结核病的存在。某些症状虽然缺乏特异度,但在结核病诊断中仍具有一定的辅助价值。
高度提示肺外结核病的生理指标:①驼背,尤其是近期发生的,可能为脊柱结核所致;②无痛性的颈部肿大淋巴结,伴或不伴有瘘管。
提示需要进一步检查以排除肺外结核病的生理指标:①抗生素治疗无效的脑膜炎,伴有亚急性发作和或颅内压升高;②胸腔积液;③心包积液;④腹腔积液导致的腹部膨隆;⑤无痛性的肿大淋巴结,不伴有瘘管;⑥无痛性的肿大关节。
如患儿接受营养治疗或补充营养后体重仍未增加,或者体重继续降低,应考虑是否存在慢性病,如结核病。
2.3.3PPD PPD阳性提示现在或过去感染了结核分枝杆菌,并不一定意味着活动性结核病的存在。PPD主要检测机体的免疫应答,而不是病原体的存在与否。在疑似结核病儿童中,尤其是在无结核病密切接触史的情况下可作为有效的诊断方法。PPD与其他诊断方法相结合,可用于具有活动性结核病症状和体征儿童的辅助诊断。
PPD的方法较多,推荐使用结核菌素皮内注射法。采用5个结核菌单位(TU)的结核菌纯化蛋白衍生物(PPD-S)或2个TU的结核菌PPD RT23,两者在结核分枝杆菌感染儿童中的反应相似。
以下结果可判断为阳性:免疫抑制儿童(包括HIV阳性和严重营养不良,即临床存在消瘦或恶性营养不良病)硬结直径>5 mm; BCG接种或未接种的其他儿童硬结直径>10mm。
PPD阴性不能除外结核分枝杆菌感染或者排除结核病诊断。
2.3.4尽可能进行病原学确诊从疑似病变部位取得的任何合格标本均应进行镜检和细菌培养(在肺外结核病患者中应尽可能行组织病理学检查)。合格的临床标本包括痰(咳痰或诱导痰)、胃部抽出物和根据病变部位所取的标本(如淋巴结活检组织)。
由于结核病儿童细菌载量低,因此相较于抗酸染色法,结核分枝杆菌培养的阳性率更高。细菌培养可区分结核分枝杆菌和非结核分枝杆菌,并可进行药物敏感性检测。病原学诊断在以下儿童中具有重要意义:①疑似耐药结核病患儿;②HIV感染患儿;③复杂或重症结核病患儿;④诊断不明的患儿;⑤具有抗结核治疗史的患儿。
值得注意的是,年长儿童和青少年的结核病类型与成人相似,且细菌载量较高,痰标本容易获取且抗酸染色阳性率高。
2.3.5HIV检测考虑结核病或已诊断结核病的所有患者(包括儿童)均应常规检测HIV[13]。
2.3.6疑似肺结核和肺外结核病的相关检查
2.3.6.1疑似肺结核X线胸片(正侧位图)在儿童结核病诊断中具有一定的价值。大多数情况下,肺结核患儿可出现结核病相应的胸部影像学改变;其中最常见的影像学改变为肺部持续性阴影以及肿大的肺门或隆突下淋巴结。HIV阴性儿童中出现肺部粟粒性阴影高度提示结核病存在。青少年结核病患者的影像学改变与成人类似,最常见的表现为大量胸腔积液和肺尖段的空洞形成。疑似结核病儿童的X线胸片解读指南见文献[29]。
2.3.6.2疑似肺外结核病表1显示,以下方法可用于常见类型肺外结核病的诊断,确诊需要根据组织学或其他特定检查。
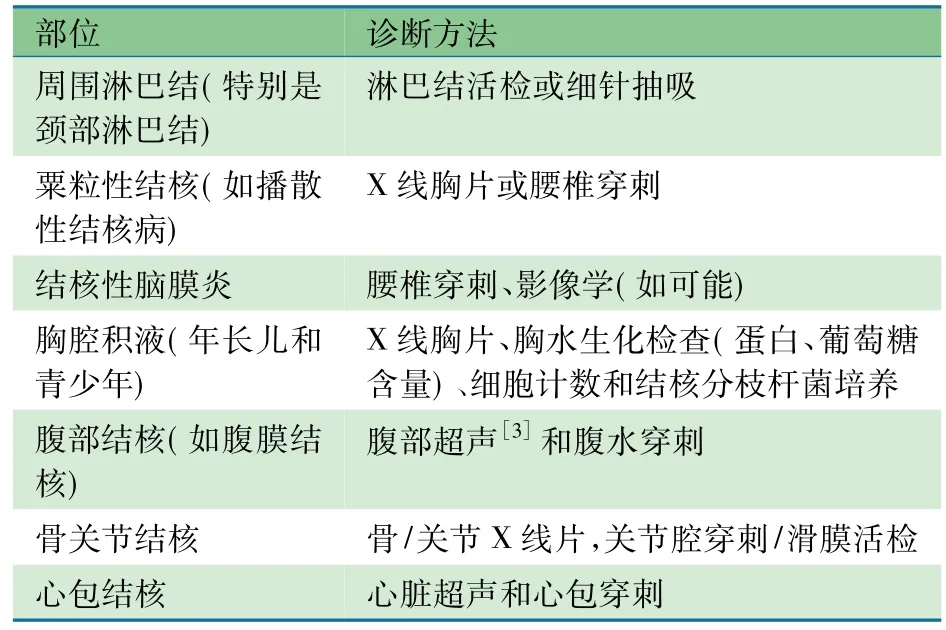
表1 儿童肺外结核病的常见类型
2.3.6.3其他检查方法不建议将胸部CT和支气管镜用于儿童结核病的常规检查。
有的国家将评分系统用于儿童结核病的诊断,但是极少文献采用“金标准”对其进行评估和确认,而评价的结果也显示其诊断价值不大且结论不一。在最常见的疑似肺结核患儿和HIV阳性儿童中,评分系统的诊断价值较低。不能就其在结核病诊断中的应用给出建议[20]。
3 儿童结核病的治疗
3.1儿童结核病的治疗原则①治愈结核病;②防止结核病患者死亡及迟发不良反应;③控制结核病复发;④防止耐药结核病的发生和传播;⑤降低结核病患者传他性;⑥最大程度减少药物毒性。
所有接受结核病治疗的儿童都应该在国家结核控制规划(NTP)进行登记。
3.2给药剂量
建议8一线抗结核药物。异烟肼(H) : 10(7~15) mg·kg-1,最大剂量300 mg·d-1;利福平(R) : 15(10~20) mg·kg-1,最大剂量600 mg·d-1;吡嗪酰胺(Z) : 35 (30~40) mg·kg-1;乙胺丁醇(E) : 20(15~25) mg· kg-1[6]。(强烈推荐,中等质量证据)
对<5岁患儿按照体重给药时,其血药浓度可能与大年龄儿童和成人不同。因此,<5岁患儿可以考虑提高每公斤体重的给药剂量以达到有效的抗菌浓度[30]。药代动力学研究结果显示,建议8的给药剂量可提高小年龄儿童的血药浓度,包括2岁以下的儿童[30~32]。系统性回顾研究也表明,建议8的给药剂量安全性高,并且不增加药物毒性作用,异烟肼或吡嗪酰胺导致的药物性肝损伤和乙胺丁醇导致的视神经炎的风险均未增加[33,34]。对于小年龄患儿予建议8推荐剂量的上限[30]。有证据显示,异烟肼给药剂量低至7 mg·kg-1时,不同年龄段包括<2岁和(或)异烟肼快代谢型的儿童均能达到有效的血药浓度。
3.3治疗方案
建议9对生活在HIV低流行或异烟肼低耐药地区,且HIV阴性的可疑或确诊的肺结核或结核性淋巴结炎患儿,按照'建议8'推荐的剂量使用三联药物(HRZ)治疗2个月后,随后用二联药物(HR)治疗4个月[6]。(强烈推荐,中等质量证据)
新发患者的治疗方案应包含6个月利福平治疗;淘汰包含乙胺丁醇(6HE)的后续治疗方案;在可行的情况下,对新发患儿的最佳给药频率应为整个治疗过程中每日给药。
建议10对生活在HIV感染率高和(或)异烟肼耐药率高的地区,可疑(确诊)肺结核或结核性淋巴结炎、广泛性肺疾病的儿童,按照建议8推荐的剂量使用四联方案(HRZE)治疗2个月后,随后用二联方案(HR)治疗4个月[6]。(强烈推荐,中等质量证据)
对成人的推荐方案显示,有必要在强化治疗期采用四联方案,尤其是在HIV感染率高或异烟肼耐药率高的地区[7],有利于减少耐多药结核病的发展和传播风险[6]。
建议11对于疑似(确诊)肺结核或结核性周围淋巴结炎的0~3月龄儿童,应及时采用建议9或10方案进行治疗。治疗中可根据年龄和可能发生的毒性作用进行剂量调整。剂量调整应由有儿童结核病临床经验的医生来决定[6]。(强烈推荐,证据质量低)
关于新生儿抗结核药物剂量的数据非常有限。新生儿尤其是在1周以内的新生儿药物代谢动力学数据匮乏。应该由有儿童结核病临床经验的医生根据年龄和可能的毒性作用进行剂量调整。如果不具备相关的临床经验,对确诊或是强烈怀疑结核病新生儿,可以采用标准治疗方案进行治疗。
建议12在巩固治疗阶段,对HIV阴性且生活在有规范治疗条件地区的患儿予以每周3次治疗[6]。(条件性建议,特殊条件下儿童间歇性治疗,非常低质量的证据)
间歇性的每周3次的治疗可作为非HIV流行区域的备选方案,前提是每次服药应在有效监督下完成,不宜用于HIV高流行地区的儿童或确诊的HIV感染儿童,或广泛肺结核,或播散性结核病(粟粒型结核病)[6,7]。
建议13链霉素不应作为一线治疗方案的药物用于儿童肺结核或周围淋巴节结核[6]。(强烈推荐,中等质量证据)
建议14对疑似(确诊)的结核性脑膜炎、骨关节结核病儿童,应用四联方案(HRZE)治疗2个月,而后应用二联方案(HR)治疗10个月,总疗程为12个月。对结核性脑膜炎的推荐治疗剂量与肺结核相同[6]。(强烈推荐,证据质量低)
表2显示了当前推荐的所有治疗方案。
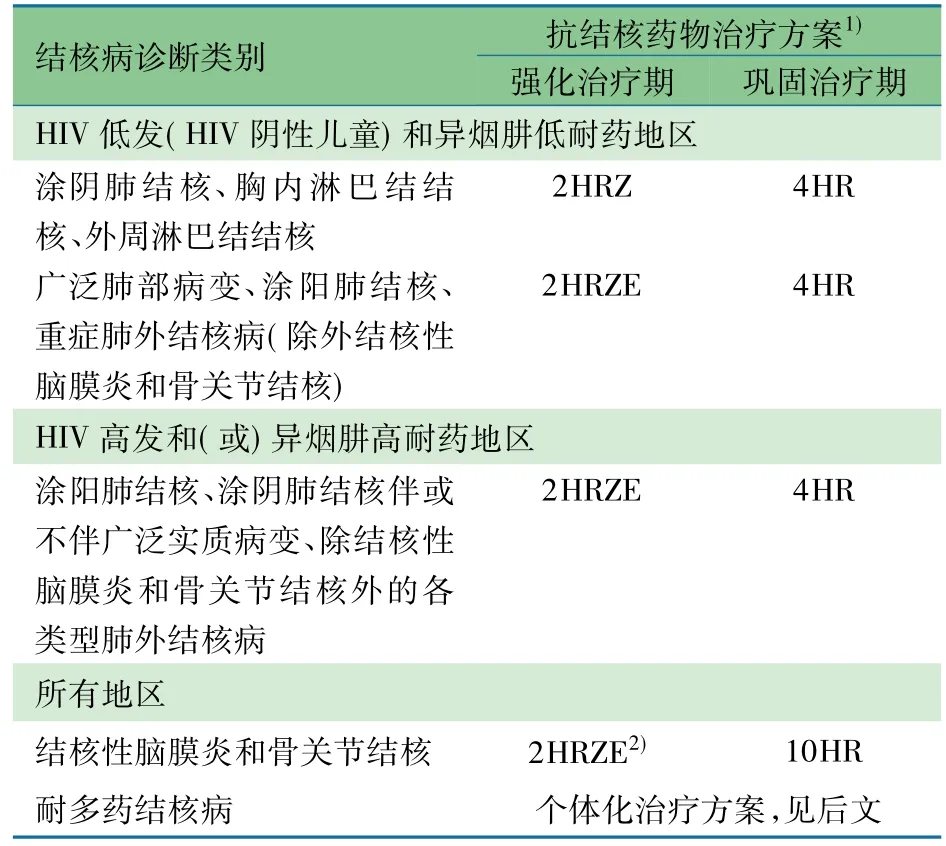
表2 新发结核病患儿的推荐治疗方案
3.4实施注意事项
3.4.1剂量和治疗方案现有的固定药物剂量组合与修正后增高的剂量不匹配。如异烟肼和利福平比例为2∶3,异烟肼10 mg·kg-1对应利福平15mg·kg-1,当异烟肼剂量达15 mg·kg-1[6]时,利福平(20 mg·kg-1)和吡嗪酰胺(40 mg·kg-1)的剂量就容易超出用药剂量上限,从而导致肝毒性的发生。
此外,异烟肼的推荐剂量范围调整为7~15 mg·kg-1,扩大剂量范围便于临时使用现有的固定药物剂量组合,而不需要额外口服异烟肼片,也可确保达到足够的血药浓度,特别是在容易出现低水平血药浓度的年幼儿童或异烟肼快乙酰化代谢者中。
3.4.2疗效和随访儿童结核病如果治疗及时并能坚持完成治疗,其治疗效果总体是好的。采用推荐方案治疗儿童发生严重不良反应事件的风险[34,35]非常低。严重的播散性结核病(如结核性脑膜炎)的致残率高,且幸存者中发病率高。理想情况下,治疗开始2周后、强化治疗结束时,以及每2个月直到完成治疗时都应进行治疗评估。评估至少应包括症状、治疗依从性、不良事件的询问和体重测量。给药剂量应根据体重增长情况进行调整。根据治疗卡片信息评价依从性。对于痰涂片阳性的结核病儿童,在开始治疗后2个月进行随访,取其痰标本进行涂片镜检。对于治疗有好转的儿童并不需要常规随访X线胸片,儿童结核病治疗后影像学改变相对缓慢。抗结核治疗无效的儿童,应进一步的评估,可能为耐药结核病、少见的肺结核并发症、其他原因导致的肺部疾病或者是治疗依从性差。
3.4.3治疗依从性儿童、父母及其照顾者应了解结核病和完成治疗的重要性。尽可能使用固定药物剂量组合来简化用药管理和依从性。推荐采用患儿治疗卡记录治疗依从性。坚持全程治疗往往有难度,特别是当临床症状快速得到改善后。大部分结核病患儿在抗结核治疗2~4周后就会出现好转的迹象。
接受抗结核治疗2个月后进行评估时,症状没有缓解或进一步加重、体重持续下降和痰涂片阳性提示可能治疗失败。
依从性差是治疗失败的常见原因。治疗失败提示可能出现了耐多药结核病,需要进行仔细评估,这种情况在HIV感染的儿童中更为常见。
3.4.4青少年结核病的治疗青少年结核病的治疗遵循原则与成人相同[7]。在给药剂量、耐多药结核病的发生风险、药物耐受性等方面,青少年与成人更为相似。因此,建议青少年和年龄较大的儿童(体重>25 kg)采用成人剂量进行治疗。青少年尤其容易出现治疗依从性差。
3.4.5其他
糖皮质激素可用于结核性脑膜炎、结核淋巴腺阻塞气道的并发症和心包结核。糖皮质激素已被证明可以提高生存率和降低晚期结核性脑膜炎的发生率,因此建议在所有的结核性脑膜炎病例中使用[36]。泼尼松最常用,每日2 mg·kg-1,在严重情况下可增加至每日4 mg·kg-1,最大剂量为60 mg·d-1,为期4周,在之后的1~2周剂量应逐渐减少直至停止。
异烟肼可引起维生素B6缺乏症,表现为神经系统病变,特别是在严重营养不良的儿童和接受抗逆转录病毒治疗(ART)的HIV阳性儿童中,推荐补充维生素B65~10 mg·d-1[37]。
严重的营养不良可增加结核病患者的病死率,因此在抗结核治疗过程中应定期评估儿童的营养状况。所有诊断为结核病的患儿均需进行营养支持,包括幼儿早期继续母乳喂养(在可能的情况下至少持续至24月龄),额外的能量供给在强化治疗期尤为重要。对发生营养不良或生长迟缓的6月龄以内的儿童,应给予治疗性喂养,或帮助哺乳期的母亲优化母乳喂养。6月龄以内的儿童不能直接进行营养补充,但可对哺乳期的母亲进行营养补充[2,38~43]。
3.4.6不良事件的管理儿童抗结核治疗所致不良反应不如成人常见[35]。最重要的不良反应是由异烟肼、利福平和吡嗪酰胺所导致的肝损伤。血清肝酶水平不需要常规监测,无症状的血清肝酶轻度升高(<5倍正常值)并不是停止治疗的指标。当出现肝区压痛、肝肿大或黄疸等时,应立即检测血清肝酶水平,并及时停止所有可能导致肝毒性的药物。寻找可能导致肝炎的原因,在肝功能恢复正常前不再尝试使用这些抗结核药物。乙胺丁醇毒性的早期识别,在大年龄患儿中可采用红绿色辨认,还可以在适当的时候进行视神经炎的早期监测。
4 儿童结核病的预防
4.1BCG接种BCG是来源于分枝杆菌的一种减毒活疫苗,保护效果差异较大[44]。
建议15在结核病高发区或结核病暴露度较高的地区,所有新生儿均需进行BCG接种[45]。(推荐强度和证据质量未分等级)
新生儿BCG接种可以有效预防重症结核病,如粟粒性结核和结核性脑膜炎[46]。暂无证据表明BCG二次接种可加强疫苗保护作用,不推荐BCG二次接种[47]。
建议16已感染HIV的儿童,不推荐进行BCG接种[45]。(推荐强度和证据质量未分等级)
建议17 HIV感染情况尚不明确、母亲为HIV阳性以及暂无HIV感染症状的高风险婴儿,需酌情考虑实际情况后进行BCG接种[45]。(推荐强度和证据质量未分等级)
HIV阳性的儿童不应进行BCG接种[48,49],接种可能会导致疾病加重或者引发致死性的BCG播散[45,50]。
BCG引起的相关疾病较难诊断,治疗也有一定的特殊性:牛分枝杆菌对吡嗪酰胺耐药,治疗需要使用大剂量的其他抗结核一线药物。例如,专家推荐治疗BCG接种引起的疾病需要用20 mg·kg-1(最大剂量300 mg)的异烟肼和20 mg·kg-1(最大剂量300 mg)的利福平,连续服用9个月,并对药物毒性和治疗反应及时监测[51]。对于HIV阳性并且有BCG相关疾病的儿童,需要进行专家咨询及管理。
在HIV阳性并且早期已有ART的婴儿,大量报道显示BCG接种可引发免疫重建炎性综合征。相对于BCG播散性疾病的低病死率而言,该综合征病死率较高。
在结核病高发区,BCG通常在新生儿时期便进行常规免疫,因此在疫苗接种前就对HIV感染状况进行全面评估存在一定的难度。本指南的建议应根据实际情况进行调整[52]。
通常HIV感染在出生时确诊有困难,暴露于HIV但尚未感染的婴儿,如不及时接种BCG,则罹患结核病的概率会明显提高。在结核病和HIV双重高发地区,母亲为HIV阳性而无临床症状的婴儿,同样需要接种BCG。
下列因素是评估接种风险的方法[52,53]: HIV的母婴传播控制项目的覆盖率和成功率;对于HIV高感染风险的婴儿,在不明确是否已感染HIV之前,应尽量推迟BCG接种的时间;实现新生儿HIV感染的早期诊断;明确ART的HIV阳性婴儿。
一般来说,HIV高发人群感染结核病的风险也较高,因此,HIV阴性的儿童需进行BCG接种。母亲HIV感染情况尚不确定的婴儿,BCG接种的益处大于风险,应建议进行BCG接种。HIV感染情况尚不确定、无HIV感染症状但母亲HIV阳性的婴儿,BCG接种的益处大于风险,通过综合评估应进行BCG接种。已明确有HIV感染,无论有无症状的婴儿,BCG接种的风险均大于益处,不建议进行BCG接种。HIV感染情况尚不明确,但已有疑似HIV感染症状的婴儿且其母亲为HIV阳性,不建议进行BCG接种。由于HIV感染的临床表现通常在出生后3个月才有表现,因此上述原则只适用于出生几周尚未进行BCG接种的婴儿。对于早期通过病毒性检测方法排除HIV感染情况的婴儿,应按计划接种BCG[45]。
4.2接触者筛查与管理筛选与管理的目的主要有两方面:①了解各年龄段人群与结核病可疑患者的接触情况;②对近期有结核分枝杆菌感染尚未发展为结核病的人进行预防性用药。如5岁以下儿童和HIV阳性的各个年龄段儿童更值得关注。
建议18和活动性结核病有密切接触史的人群或家庭,应进行临床评估,评价其感染结核病并发展为活动性结核病的潜在后果。需要密切关注的人群包括:有结核病感染症状的儿童; 5岁以下儿童;已知或可能存在免疫缺陷病的儿童;与耐多药结核病和广泛耐药结核病患者接触的儿童[12]。(强烈推荐,证据不足)
接触者筛查是发现活动性和重症结核病病例的一种方法[12,54,55]。接触者的早期鉴别不但有利于避免重症结核病的发生,同时对减少后续传播也具有重要意义。如果可疑病例为儿童,则应尽可能排除所有接触过的感染来源。
密切接触痰涂片阳性结核病患者的儿童,具有较高的结核病感染率。接触越密切,接触时间越长,感染概率越高。通常婴儿和5岁以下儿童感染结核分枝杆菌之后更容易发展为结核病[56],且病情发展在婴儿和儿童中速度更快,比如成人中疾病发展需1年,而儿童仅需要几周。任何年龄段的儿童接触耐多药结核病后,感染耐多药结核杆菌的概率也明显升高[51]。
建议19与具有以下特点患者有密切接触史的人或其家庭成员,建议应进行严密筛查:痰涂片阳性肺结核病;耐多药结核病和广泛耐药结核病(证实或怀疑) ;合并感染了HIV的结核病或5岁以下结核病儿童[12]。(强烈推荐,证据不足)
建议20除了推荐19提到的内容外,对密切接触过其他类型结核病患者的人也应进行接触者筛查[12]。(强烈推荐,证据不足)
痰涂片阳性病例应进行密切随访。一般情况下,可通过PPD筛选有结核分枝杆菌感染的儿童,通过X线胸片筛选有结核病的儿童。不具备PPD和X线胸片条件时,临床评估足以判定。
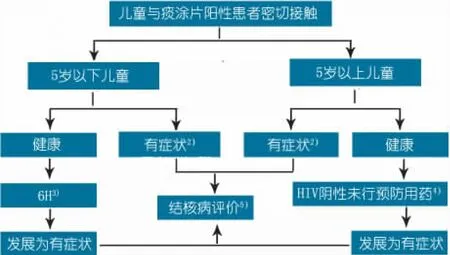
图1 儿童接触者症状为基础的筛查管理注 1)诊断为结核病应及时治疗并向国家结核控制规划报告; 2)如果疑似结核病,参考本文第2部分儿童结核病的诊断; 3)异烟肼10 mg·kg-1·d-1(7~15 mg·kg-1)持续使用6个月; 4)如果HIV阳性,任何年龄均服用异烟肼6个月; 5)确诊为结核病,开始进行抗结核治疗并登记于国家结核控制规划;如排除结核病,需要考虑异烟肼预防性治疗
建议21 5岁以下儿童有结核病密切接触史,但经过评估未感染结核病者,应给予6个月的异烟肼预防性治疗[10(7~15) mg·kg-1·d-1,最大剂量300 mg·d-1][12]。(强烈推荐,证据不足)
预防性治疗主要用于无结核病症状或者已排除了结核病的<5岁儿童或HIV高感染者人群。儿童时期的预防性治疗可以明显降低潜伏结核病发展为活动性结核病的可能性[58]。
预防性治疗,即潜伏结核病的治疗。推荐异烟肼10 (7~15) mg·kg-1·d-1,疗程为6个月,又称为IPT。[59]。
治疗结束后2个月应进行随诊,IPT不会导致潜伏结核病感染患者,甚至漏诊的活动性结核病患者发生耐药[60~62]。
随着HIV的大范围流行,结核病接触者筛查为了解结核病和HIV共同感染提供了机会。HIV感染风险较高的儿童,结核病的感染风险也比较高。
建议22 HIV高发地区,所有与结核病患者有密切接触者,都应该进行HIV筛查[12]。(强烈推荐,证据不足)
建议23 HIV低发地区,所有与结核病患者有密切接触者,并且有疑似结核病症状的人,都应该进行HIV筛查。(条件性推荐,证据质量较低)
建议24与艾滋病患者接触的人群,应建议进行HIV筛查[12]。(强烈推荐,证据不足)
建议25经症状筛查可能不存在活动性结核病、无结核病接触史的HIV感染的>1岁儿童,若在结核病高发地区,必须将6个月的异烟肼预防治疗[10(7~15) mg· kg-1·d-1,最大剂量300 mg·d-1]作为HIV预防和护理综合方案的一部分(强烈推荐,研究数据少) ;若在结核病较低或中等发病率地区,可根据需要选择是否增加该异烟肼预防治疗方案。
建议26在HIV高发地区或确诊HIV感染的、疑似或确诊肺结核或结核性淋巴结炎儿童不应该采用间断性治疗方案(即每周2或3次用药)。(强烈推荐,低至中等质量证据)
5 耐药结核病的管理
5.1与耐药结核病患者接触儿童的预防目前并不推荐对耐药结核患者的接触者进行预防治疗,仅有观察性研究结果报告。
耐药结核病患者的密切接触者若发展为结核病,一般为耐药结核病。
接触传染性结核病患者的所有儿童均需要进行结核病相关筛查,尤其是HIV阳性儿童和家庭耐药结核病患者接触者[51]。建议对无症状的儿童进行密切随访(最初的半年中每2~3个月随访1次,随后的至少2年内每半年随访1次)。如果发展为结核病,则应根据传染源的药敏试验结果制定相应的耐药结核病治疗方案。
年龄越小的儿童发展为结核病的风险越高。
5.2耐药结核病治疗儿童耐多药和广泛耐药结核病的治疗原则与成人相同,均使用二线药物,但适宜的疗程尚不明确。与敏感结核病相比,儿童耐多药结核病一般治疗效果较差,病死率较高[63,64]。
5.2.1单耐药结核病的治疗如果治疗前已知或怀疑对异烟肼单耐药,或患儿所在地区异烟肼耐药率较高,建议强化治疗阶段在异烟肼、利福平和吡嗪酰胺治疗的基础上添加乙胺丁醇。如果病变范围比较广泛,建议加用一种氟喹诺酮类药物,同时延长治疗时间至9个月以上。对利福平单耐药者建议给予异烟肼、乙胺丁醇和一种氟喹诺酮类药物治疗12~18个月,并且至少在治疗起始的2个月加用吡嗪酰胺[65]。
5.2.2多耐药结核病的治疗多耐药指的是对2种或更多的一线抗结核药物耐药,但并不同时对异烟肼和利福平耐药。可以采用相应的推荐治疗方案[65]。
5.2.3耐多药结核病的治疗儿童耐多药结核病的治疗与成人相似[10]。最大的差异在于儿童结核病没有药敏结果,对怀疑为耐多药结核病的儿童进行经验性治疗。现有的证据显示儿童的治疗效果并不比成人差[65,66]。
可遵循以下原则:①避免在无效的治疗方案中加入单一药物,这样很容易产生耐药性;②建议每天的治疗在医生直接督导下进行;③没有药敏试验结果,则按照其可能传染源菌株的药敏结果制定治疗方案;④对所有耐多药结核病患儿进行二线抗结核药物的敏感性检测,排除对氟喹诺酮类和(或)二线注射类药物的耐药性,因为此种情况下需要在治疗早期加入其他药物;⑤对单纯性疾病或敏感结核病患儿给予至少3种,最好是4种药物治疗;⑥每次随访时,耐心解答看护人在不良反应、治疗时间和治疗依从性的重要性方面的问题;⑦要对患儿进行症状和治疗依从性评估;询问不良反应并行体重测量。需根据体重的增加调整药物剂量。
治疗过程中需监测临床表现、影像学和培养结果的变化。每月进行1次涂片镜检和培养,直至连续3次结果均为阴性,以后每2~3个月进行1次培养检测。
每次随访时需对所有药物的不良反应进行监测。
表3中列出了可能用于儿童耐多药结核病治疗的药物,但目前仅有氟喹诺酮类药物在儿童中的安全性数据。
建议27在一个良好的耐多药结核病控制项目和合理的耐多药结核病治疗方案的背景下,对于确诊或怀疑耐多药结核分枝杆菌所引起的肺结核、结核性脑膜炎患儿,可以采用氟喹诺酮类药物治疗。相关的治疗策略应由具有儿童结核病治疗经验的临床医生来决定[6]。(强烈推荐,低至中等质量证据)
5.2.4制定耐多药结核病的治疗方案儿童耐多药结核病的治疗方案遵循的原则与成人相同[10,67]。广泛性肺结核或播散性肺外结核病患者应根据药敏结果,在治疗方案中至少包含4~6种抗结核药物[65]:①使用任何可能有效或基本有效的第一组一线口服药物,并在整个治疗期间持续使用(表3)。②根据药敏结果和治疗反应,加入1种第二组注射类药物。至少使用6个月,且在培养结果转阴后继续使用4个月。优先使用氨基糖苷类药物,如阿米卡星。除非第二组的其他药物均不可用时,不使用链霉素,一方面因为耐药菌株对链霉素的耐药率较高,另一方面易致耳毒性。③根据药敏结果和治疗反应,在治疗过程中加入1种第三组的氟喹诺酮类药物。左氧氟沙星和莫西沙星要优于氧氟沙星。④应在治疗过程中加入第四组的二线口服药物,除非治疗方案中已包含至少4种可能敏感的药物。第四组的药物应根据治疗反应、不良反应和经济成本进行选取。第四组药物的药敏试验目前尚未进行标准化。⑤如从上述1~4组药物中未能选取出4种有效药物来制定治疗方案,建议在征求耐多药结核病专家的建议后,考虑加入至少2种第五组的三线药物。

注 1)除了乙胺丁醇外,其他所有药物(包括氟喹诺酮类)在儿童中的使用剂量接近推荐剂量的上限。乙胺丁醇的使用剂量为15 mg·kg-1,明显低于成人,因为儿童视神经炎的监测是非常困难的; 2)乙胺丁醇和吡嗪酰胺的药敏试验结果可信度不高,因此未做药敏试验或结果敏感,均可考虑加用其他药物; 3)选取1种药物。儿童中阿米卡星优于卡那霉素。肌肉注射阿米卡星时疼痛明显,建议进行静脉注射; 4)选取1种或多种药物组成4联方案; 5)对氨基水杨酸(包括对氨基水杨酸钠)在酸性介质(如酸奶或橙汁)中可促进吸收; 6)如果其他组药物不足以制定满意的治疗方案,可以考虑使用本组药物,本组中的2种药物可作为1种添加的药物; 7)成人中大剂量异烟肼:每天16~20mg·kg-1; 8)利奈唑胺用于治疗结核病的剂量不确定,但较低剂量(成人300 mg,bid或300 mg,qd)的不良反应较少,且具有一定疗效; 9)氨硫脲不能用于HIV患者的治疗,因为可能引起危及生命的严重不良反应
二线药物很少有儿童剂型,药物动力学研究比较匮乏,因此二线药物的最佳使用剂量是不明确的,由于药片必须被切分,可能会导致剂量和血药浓度的不准确,或达不到治疗浓度或引起毒性。药物的味感不好可引起呕吐和腹泻,会影响药物的吸收。每日的药物总量分次服用可以提高耐受性,但会导致漏服。药物可以和不同的食物或饮料进行混合,个别情况下,也可以采用鼻饲或经皮内镜下胃造瘘进行喂养。
专家建议结核病早期,如纵膈或肺门淋巴结肿大(伴或不伴有局部的肺部浸润)可以采用较少的药物和较短的疗程[68,69]。伴或不伴空洞广泛性肺结核和播散性肺外结核病应采用4种或更多的药物进行治疗[67]。
5.2.5耐药结核病治疗持续时间儿童耐多药结核病治疗的相关证据很少,一般采用成人的治疗方案[10,65]。治疗时间取决于疾病的严重程度,强化期持续至少8个月,整个疗程持续10个月以上[10],且防止漏服。儿童的结核病早期、非广泛性结核病治疗时间比成人短,但仍需进一步的研究证实[66~69]。
5.2.6耐药结核病治疗不良反应儿童耐药结核病治疗不良反应的发生率低于成人[67,70]。应当告知监护人药物可能的不良反应,一旦发生不良反应要及时报告。任何二线抗结核药物都可用于儿童,接受耐药结核病治疗的儿童都对二线药物具有较好的耐受性。定期监测体重并调整剂量。如治疗方案中包含第二组注射类药物,尤其是氨基糖苷类药物使用时间较长的情况下,需进行基础听力测试,同时每个月必须进行听力检测[65,67],在高风险的患儿中(如糖尿病、HIV感染或肾功能不全)尤其重要[65]。
5.2.7耐药结核病治疗中的其他问题①HIV阳性的耐药结核病儿童也应给予以下治疗:维生素B6(每天5~10 mg·kg-1) ;复方磺胺甲唑预防治疗;尽早开始ART。②对敏感结核病和免疫重建炎症综合征患儿使用糖皮质激素。③营养支持很重要。④采取合理的感染控制措施避免耐药结核病的传播。⑤依从性对于防止进一步产生耐药性是至关重要的。
5.2.8依从性抗结核和ART方案中一些药物口感非常不好,可引起恶心、呕吐,且口服药物的数量较多。建议每天到当地的诊所进行注射治疗,甚至住院至注射类药物疗程结束也是有必要的。将每日药物总剂量分次或从低剂量开始,在1~2周内渐增至常规剂量,可以降低硫代酰胺和对氨基水杨酸的胃肠道不良反应;呕吐停止后,应当重新制定每日的单一剂量[67]。
6 国家结核病防治规划的实施和管理
建议28所有接受结核病治疗的儿童应该按照2个年龄段(0至4岁以及5至14岁)分别由国家结核控制规划进行记录和汇报[15,37]。(这个建议不是分级的,并且需要基于良好的临床实践)
向国家结核控制规划汇报所有已确诊的结核病患儿,并且登记治疗情况和临床结局非常重要。开始接受治疗的结核病患儿必须纳入医疗机构的记录中,并应完善以下信息:年龄,结核病类型,HIV感染情况,HIV阳性时复方磺胺甲唑预防性治疗和ART的疗效。
参考文献
[1]Co-trimoxazole prophylaxis for HIV-exposed and HIV-infected infants and children: practical approaches to implementation and scale up.Geneva,World Health Organization,2009
[2]Guidelines for an integrated approach to the nutritional care of HIV-infected children (6 months -14 years).Geneva,World Health Organization,2009
[3]Policy statement on HIV testing and counselling in health facilities for refugees,internally displaced persons and other persons of concern to UNHCR.Geneva,Offie of the United Nations High Commissioner for Refugees,2009
[4]WHO policy on TB infection control in health-care facilities,congregate settings and households.Geneva,World Health Organization,2009
[5]Guidance on ethics of tuberculosis prevention,care and control.Geneva,World Health Organization,2010 (WHO/ HTM/TB/2010.16)
[6]Rapid advice: treatment of tuberculosis in children.Geneva,World Health Organization,2010 (WHO/HTM/TB/2010.13)
[7]Treatment of tuberculosis: guidelines for national programmes,4th ed.Geneva,World Health Organization,2010 (WHO/ HTM/TB/2009.420)
[8]Commercial serodiagnostic tests for diagnosis of tuberculosis: policy statement.Geneva,World Health Organization,2011 (WHO/HTM/TB/2011.5)
[9]Guidelines for intensifid case-fiding for tuberculosis and isoniazid preventive therapy for people living with HIV in resource-constrained settings.Geneva,World Health Organization,2011
[10]Guidelines for the programmatic management of drug-resistant tuberculosis–2011 update.Geneva,World Health Organization,2011 (WHO/HTM/TB/2011.6)
[11]Use of tuberculosis interferon-gamma release assays (IGRAs) in low-and middleincome countries: policy statement.Geneva,World Health Organization,2011 (WHO/HTM/TB/2011.18)
[12]Recommendations for investigating contacts of persons with infectious tuberculosis in low-and middle-income countries.Geneva,World Health Organization 2012 (WHO/HTM/TB/ 2012.9)
[13]WHO policy on collaborative TB/HIV activities: guidelines for national programmes and other stakeholders.Geneva,World Health Organization,2012 (WHO/HTM/TB/2012.1)
[14]Consolidated guidelines on the use of antiretroviral drugs for treating and preventing HIV infection: recommendations for a public health approach.Geneva,World Health Organization,2013
[15]Defiitions and reporting framework for tuberculosis–2013 revision.Geneva,World Health Organization (WHO/HTM/ TB/2013.2)
[16]Automated real-time nucleic acid amplifiation technology for rapid and simultaneous detection of tuberculosis and rifampicin resistance: Xpert MTB/RIF system for the diagnosis of pulmonary and extrapulmonary TB in adults and children.Policy Update.Geneva,World Health Organization,2013
[17]Marais BJ,Gie RP,Hesseling AC,et al.A refined symptombased approach to diagnose pulmonary tuberculosis in children.Pediatrics,2006,118(5) : e1350-1359
[18]Schaaf HS,Zumla A,eds.Tuberculosis: a comprehensive clinical reference.London,UK: Saunders Elsevier,2009
[19]Perez-Velez CM,Marais BJ.Tuberculosis in children.N Engl J Med,2012,367(4) : 348-361
[20]Graham SM.The use of diagnostic systems for tuberculosis in children.Indian J Pediatr,2011,78(3) : 334-339
[21]Use of liquid TB culture and drug susceptibility testing (DST) in low and medium income settings.Summary report of the Expert Group Meeting on the use of liquid culture media,Geneva,26 March 2007.Geneva,World Health Organization,2007
[22]Molecular line probe assays for rapid screening of patients at risk of multidrug-resistant tuberculosis (MDR-TB) : policy statement.Geneva,World Health Organization,2008
[23]Zar HJ,Workman L,Isaacs W,et al.Rapid molecular diagnosis of pulmonary tuberculosis in children using nasopharyngeal specimens.Clin Infect Dis,2012,55(8) : 1088-1095
[24]Bates M,O'Grady J,Maeurer M,et al.Assessment of the Xpert MTB/RIF assay for diagnosis of tuberculosis with gastric lavage aspirates in children in sub-Saharan Africa: a prospective descriptive study.Lancet Infect Dis,2013,13(1) : 36-42
[25]Nicol MP,Workman L,Isaacs W,et al.Accuracy of the Xpert MTB/RIF test for the diagnosis of pulmonary tuberculosis in children admitted to hospital in Cape Town,South Africa: a descriptive study.Lancet Infect Dis,2011,11(11) : 819-824
[26]Rachow A,Clowes P,Saathoff E,et al.Increased and expedited case detection by Xpert MTB/RIF assay in childhood tuberculosis: a prospective cohort study.Clin Infect Dis,2012,54(10) : 1388-1396
[27]Guidance on provider-initiated HIV testing and counselling in health facilities.Geneva,World Health Organization,2007
[28]Wright CA,Warren RM,Marais BJ.Fine needle aspiration biopsy: an undervalued diagnostic modality in paediatric mycobacterial disease.Int J Tuberc Lung Dis,2009,13(12) : 1467-1475
[29]Gie R.Diagnostic atlas of intrathoracic tuberculosis in children: a guide for low-income countries.Paris,International Union Against Tuberculosis and Lung Disease,2003
[30]Thee S,Seddon JA,Donald PR,et al.Pharmacokinetics of isoniazid,rifampin,and pyrazinamide in children younger than two years of age with tuberculosis: evidence for implementation of revised World Health Organization recommendations.Antimicrob Agents Chemother,2011,55(12) : 5560-5567
[31]Donald PR,Maritz JS,Diacon AH.The pharmacokinetics and pharmacodynamics of rifampicin in adults and children in relation to the dosage recommended for children.Tuberculosis (Edinb),2011,91(3) : 196-207
[32]McIlleron H,Willemse M,Werely CJ,et al.Isoniazid plasma concentrations in a cohort of South African children with tuberculosis: implications for international pediatric dosing guidelines.Clin Infect Dis,2009,48(11) : 1547-1553
[33]Ethambutol efficacy and toxicity: literature review and recommendations for daily and intermittent dosage in children.Geneva,World Health Organization,2006 (WHO/HTM/TB/ 2006.365)
[34]Donald PR.Antituberculosis drug-induced hepatotoxicity in children.Pediatric Reports,2011,3(2) : e16
[35]Frydenberg AR,Graham SM.Toxicity of first-line drugs for treatment of tuberculosis in children: review.Trop Med Int Health,2009,14(11) : 1329-1337
[36]Schoeman JF,Van Zyl LE,Laubscher JA,et al.Effect of corticosteroids on intracranial pressure,computed tomographic findings,and clinical outcome in young children with tuberculous meningitis.Pediatrics,1997,99(2) : 226-231
[37]Guidance for national tuberculosis programmes on the management of tuberculosis in children.Geneva,World Health Organization,2006 (WHO/HTM/TB/2006.371)
[38]WHO,UNICEF,WFP and UNHCR Consultation on the programmatic aspects of the management of moderate acute malnutrition in children under five years of age,24-26 February 2010,WHO,Geneva.Geneva,World Health Organization,2010
[39]Technical note.Supplementary foods for the management of moderate acute malnutrition in infants and children 6-59 months of age.Geneva,World Health Organization,2012
[40]WHO child growth standards and the identification of severe acute malnutrition in infants and children.A Joint Statement by the World Health Organization and the United Nations Children ’s Fund.Geneva,World Health Organization and United Nations Children ’s Fund,2009
[41]The WHO Child Growth Standards.Geneva,World Health Organization,2012; available at: http: / /www.who.int/ childgrowth/standards/en/
[42]Growth reference 5-19 years.Geneva,World Health Organization,2012; available at: http: / /www.who.int/ growthref/en/
[43]Management of severe malnutrition: a manual for physicians and other senior health workers.Geneva,World Health Organization,1999
[44]Colditz GA,Berkey CS,Mosteller F,et al.The efficacy of bacillus Calmette-Guérin vaccination of newborns and infants in the prevention of tuberculosis: meta-analyses of the published literature.Pediatrics,1995,96(1 Pt 1) : 29-35
[45]Revised BCG vaccination guidelines for infants at risk for HIV infection.Wkly Epidemiol Rec,82(21) : 193-196
[46]Trunz BB,Fine P,Dye C.Effect of BCG vaccination on childhood tuberculous meningitis and miliary tuberculosis worldwide: a meta-analysis and assessment of costeffectiveness.Lancet,2006,367(9517) : 1173-1180
[47]Global tuberculosis programme and global programme on vaccines.Statement on BCG revaccination for the prevention of tuberculosis.Wkly Epidemiol Rec,1995,70(32) : 229-231
[48]Global Advisory Committee on Vaccine Safety,29–30 November 2006.Safety of BCG vaccine in HIV-infected children.Weekly Epidemiological Record,2007,82: 22
[49]Global Advisory Committee on Vaccine Safety,3-4 December 2009.Use of BCG vaccine in HIV-infected infants.Weekly Epidemiological Record,2010,85: 32-33
[50]Hesseling AC,Johnson LF,Jaspan H,et al.Disseminated bacille Calmette-Guérin disease in HIV-infected South African infants.Bull World Health Organ,2009,87(7) : 505-511
[51]Becerra MC,Franke MF,Appleton SC,et al.Tuberculosis in children exposed at home to multidrug-resistant tuberculosis.Pediatr Infect Dis J,2013,32(2) : 115-119
[52]Azzopardi P,Bennett CM,Graham SM,et al.Bacille Calmette-Guérin vaccine-related disease in HIV-infected children: a systematic review.Int J Tuberc Lung Dis,2009,13(11) : 1331-1344
[53]Hesseling AC,Cotton MF,Fordham von Reyn C,et al.Consensus statement on the revised World Health Organization recommendations for BCG vaccination in HIV-infected infants.Int J Tuberc Lung Dis,2008,12(12) : 1376-1379
[54]Rieder HL.Interventions for tuberculosis control and elimination.Paris,International Union Against Tuberculosis and Lung Diseases,2002
[55]International standards for tuberculosis care,2nd ed.The Hague,Netherlands: Tuberculosis Coalition for Technical Assistance,2009
[56]Marais BJ,Gie RP,Schaaf HS,et al.The natural history of childhood intra-thoracic tuberculosis: a critical review of literature from the pre-chemotherapy era.Int J Tuberc Lung Dis,2004,8(4) : 392-402
[57]Kruk A,Gie RP,Schaaf HS,et al.Symptom-based screening of child tuberculosis contacts: improved feasibility in resourcelimited settings.Pediatrics,2008,121(6) : e1646-1652
[58]Smieja MJ,Marchetti CA,Cook DJ,et al.Isoniazid for preventing tuberculosis in non-HIV infected persons.Cochrane Database Syst Rev,2000; (2) : CD001363
[59]Stop TB Partnership.Product information.Geneva,World Health Organization,2013 (http: / /www.stoptb.org/gdf/ drugsupply/pc3.asp?PID =56,accessed 7 October 2013)
[60]Product information.Geneva,Stop TB Partnership,Global Drug Facility,Procurement and Supply; available at: http: / / www.stoptb.org/gdf/drugsupply/pc3.asp?PID =56
[61]Balcells ME,Thomas SL,Godfrey-Faussett P,et al.Isoniazid preventive therapy and risk for resistant tuberculosis.Emerg Infect Dis,2006,12(5) : 744-751
[62]van Halsema CL,Fielding KL,Chihota VN,et al.Tuberculosis outcomes and drug susceptibility in individuals exposed to isoniazid preventive therapy in a high HIV prevalence setting.AIDS,2010,24(7) : 1051-1055
[63]S Seddon JA,Hesseling AC,Willemse M,et al.Cultureconfirmed multidrug-resistant tuberculosis in children: clinical features,treatment,and outcome.Clin Infect Dis,2012,54 (2) : 157-166
[64]Seddon JA,Visser DH,Bartens M,et al.Impact of drug resistance on clinical outcome in children with tuberculous meningitis.Pediatr Infect Dis J,2012,31(7) : 711-716
[65]Guidelines for the programmatic management of drug resistant tuberculosis: 2008 emergency update.Geneva,World Health Organization,2008 (WHO/HTM/TB/2008.402)
[66]Ettehad D,Schaaf HS,Seddon JA,et al.Treatment outcomes for children with multidrug-resistant tuberculosis: a systematic review and meta-analysis.Lancet Infect Dis,2012,12(6) : 449-456
[67]Schaaf HS,Marais BJ.Management of multidrug-resistant tuberculosis in children: a survival guide for paediatricians.Paediatr Respir Rev,2011,12(1) : 31-38
[68]Schaaf HS,Shean K,Donald PR.Culture confirmed multidrug resistant tuberculosis: diagnostic delay,clinical features,and outcome.Arch Dis Child,2003,88(12) : 1106-1111
[69]Schaaf HS,Gie RP,Kennedy M,et al.Evaluation of young children in contact with adult multidrug-resistant pulmonary tuberculosis: a 30-month follow-up.Pediatrics,2002,109 (5) : 765-771
[70]Swanson DS,Starke JR.Drug-resistant tuberculosis in pediatrics.Pediatr Clin North Am,1995,42(3) : 553-581
(本文编辑:张崇凡)
·病案报告·
(收稿日期:2015-03-30修回日期: 2016-01-26)
通讯作者申阿东,E-mail: shenad16@ hotmail.com
DOI:10.3969/j.issn.1673-5501.2016.01.016
