siRNA抑制缺氧诱导因子-1ɑ表达对人视网膜母细胞瘤细胞增殖与凋亡的影响
2016-05-07郎莉莉葛茸茸陈建梅
郎莉莉,高 玉,葛茸茸,陈建梅,景 明
siRNA抑制缺氧诱导因子-1ɑ表达对人视网膜母细胞瘤细胞增殖与凋亡的影响
郎莉莉,高玉,葛茸茸,陈建梅,景明
[摘要]目的观察siRNA抑制人视网膜母细胞瘤表达低氧诱导因子(HIF)对细胞增殖和凋亡的影响。方法以Y-79细胞系为研究对象,分别在正常氧和低氧环境下培养,MTT法检测细胞增殖,RT-PCR和Western blot检测HIF-1ɑmRNA和蛋白质水平的表达变化,siRNA抑制细胞表达HIF-1ɑ,膜联蛋白V-FITC和PI双染法流式细胞术检测细胞凋亡情况,荧光评估测定法检测半胱天冬酶活性。SPSS 16.0软件包作统计学分析,配对t检验。结果与常氧和低氧环境培养Y79细胞比较,在0、4、8、12 h后HIF-1ɑmRNA和蛋白质数倍高表达。siRNA干扰技术处理24、48、72 h后,常氧环境培养下的Y-79细胞表达HIF-1ɑ呈时间依赖性轻度下降趋势,低氧条件下呈显著下降。siRNA HIF-1ɑ可能是通过上调Bax/Bcl-2比率和活化caspase-9、caspase-3途径促进Y-79细胞凋亡。结论siRNA HIF-1ɑ下调人视网膜母细胞瘤表达低氧诱导因子,可抑制细胞增殖和促进细胞凋亡。抑制HIF-1ɑ表达可能是治疗视网膜母细胞瘤的潜在新策略。
[关键词]低氧诱导因子-1ɑ;人视网膜母细胞瘤;细胞增殖;细胞凋亡
[作者单位]200120上海,同济大学附属东方医院眼科(郎莉莉、陈建梅),解放军第四一一医院眼科(高玉、葛茸茸、景明)
视网膜母细胞瘤(retinoblastoma,RB)是婴幼儿最常见的眼内恶性肿瘤,其发病率约为1/15 000~20 000,严重威胁和危害患儿的视力甚至生命[1-2]。随着对RB认识的不断深入,其诊断和治疗正在发生着快速的变化[3]。除了传统的眼球摘除术和外放射治疗,过去的十年里,系统性化疗已成为了首选的治疗手段[4-5]。但以上方法均存在安全性低、不良反应严重等诸多不足。基因治疗相对于传统治疗方法则具有安全性高、无不良反应的优势而受到广泛关注。肿瘤组织缺氧是恶性肿瘤的重要生物学特征,由于新生血管生成不足、不规则血供、癌细胞快速增殖引起的氧消耗补偿不良所导致的瘤内缺氧是实体瘤的常见现象[6-7]。缺氧条件下,肿瘤细胞调控血管形成、肿瘤侵袭与转移、细胞周期与凋亡以及对放化疗抵抗性等许多基因的转录和表达发生变化。缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)由α亚基和β亚基组成,在缺氧诱导的基因表达变化中起关键作用[8]。国外的研究观察到在RB的发生发展过程中HIF-1α高表达[9],证实了缺氧现象同样存在于RB。国内的研究则表明,RB肿瘤组织中HIF-1ɑ的表达与血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达呈正相关,认为HIF-1ɑ可作用于VEGF,在RB血管形成中起到一定作用,从而促进RB的发生发展[10-11]。最近,Fernandes等报道利用RNA干扰技术敲除HIF-1ɑ表达可以显著降低RB肿瘤细胞的增殖,但这一现象的发生机制并不清楚[12]。笔者利用RNA干扰技术观察了HIF-1ɑ对人RB Y-79细胞增殖、凋亡和凋亡途径的影响,可能有助于深入理解HIF-1ɑ在视网膜母细胞瘤中的病理作用,预示HIF-1ɑ可作为RB基因治疗的一个新靶标。
1 材料与方法
1.1细胞株及其培养人RB Y-79细胞株从美国典型培养物保藏中心(ATCC,VA,USA)获得。Y-79细胞利用RPMI1640培养基(invitrogen life technologies,ON,USA)添加10%胎牛血清、1 250 mg/L两性霉素B、100 U/ml青霉素和100 mg/L链霉素。所有的培养物保持在含有5%CO2和21%O2的37℃湿润的空气中。
1.2细胞的缺氧处理缺氧(≤1%O2)的实现按照文献描述使用气体发生器系统[13]。
1.3细胞的siRNA处理siRNA敲除HIF-1ɑ如文献所述[14]。分别合成siRNA HIF-1ɑ正义链:5-AGAGGUGGAUAUGUGUGGGdTdT-3和反义链5-CCCACACAUAUCCACCUCUdTdT-3。一个靶标是无关mRNA的siRNA作为非特异性的对照。细胞在无血清培养基中转染siRNA(100 nmol/L)5 h,使用metafectene试剂(Biontex,München,Germany)。靶基因消除的确定通过RT-PCR和Western blot检测。1.4 RT-PCR分析总RNA的抽提使用Trizon厂商说明书,第一链cDNA使用PrimeScriptTMRT试剂盒合成(Takara,Shiga,Japan)。RT-PCR使用SYRB green PCRMaster Mix(Takara)。每个扩增反应进行变性95℃30 s,在95℃5 s扩增40个循环,退火和延伸在60℃20 s,使用ABI7500序列检测系统(life technologies)。β-actin作为管家基因。
1.5 Western blot分析总的细胞抽提物按照文献描述使用裂解液(50 mmol/L HEPES,100 mmol/L NaCl,2 mmol/L乙二胺四乙酸,0.1%3-[(3-胆酰胺丙基)二]-1-丙烷磺酸,10%蔗糖,5 mmol/L DTT)[14]。裂解液孵化在4℃,30 min,离心13 000 r/min,10 min,收集上清液和蛋白浓度的测定用Bradford方法[15]。蛋白质在10%SDS-PAGE分离和电转聚偏氟乙烯氟膜。PVDF膜Tris缓冲生理盐水用5%牛血清白蛋白封闭37℃2 h后,加入1:1 000一抗孵育4℃过夜,用PBS-T洗膜3次,加入二抗,37℃孵育2 h。蛋白条带的检测使用增强化学发光检测试剂盒(碧云天,南通,中国)。
1.6细胞增殖实验MTT实验检测细胞增殖,细胞(1×104细胞/孔)接种于96孔板中,贴壁过夜,按照设定的时间(24、48、72 h)转染siRNA HIF-1ɑ,每孔添加10μl MTT溶液(5 g/L),37℃孵育4 h后移去MTT液,添加100μl DMSO,ELISA酶标仪检测活细胞数。
1.7细胞凋亡检测用Annexin V-FITC和PI双染色法检测细胞凋亡。转染siRNA HIF-1ɑ48 h后,冷PBS清洗细胞,用结合缓冲(10 mmol/L HEPES/NaOH,pH 7.4,140 mmol/L NaCl,2.5 mmol/L CaCl2)重新悬浮。室温下Annexin V-FITC和PI染色15 min,1 h内使用流式细胞仪(Becton-Dickinson,San Jose,CA)检测。V+/PI-cells细胞被定义为凋亡细胞。应用CellQuest(Becton-Dickinson)软件计算出的凋亡细胞百分比。
1.8半胱天冬酶(caspase)活性分析用荧光评估测定法检测半胱天冬酶活性。细胞处理后,细胞(2 ×105细胞/孔)用裂解缓冲液收获。按照先前描述的离心法分离蛋白、确定浓度[14]。来源于各个样本的等量蛋白和caspase-3底物DEVD-AFC或者caspase-9底物LEHD-AFC共同孵育在37℃30 min。通过荧光分光光度计(Molecular Devices,Sunnyvale,CA)定量活性。
1.9统计学处理利用SPSS 16.0软件包进行统计学分析。所有实验重复3次,数据以均数±标准差(±s)表示。统计分析采用一个配对测试,P<0.05为差异有统计学意义。
2 结果
2.1缺氧上调人RB Y-79细胞表达HIF-1ɑ在常氧条件下,人RB Y-79细胞表达低水平的HIF-1ɑ mRNA。然而,在此研究中能够检测到该细胞稳定表达HIF-1ɑ蛋白。细胞暴露于低氧环境中,观察到HIF-1ɑmRNA和蛋白水平的表达成倍增加。这些数据表明,缺氧上调人RB Y-79细胞HIF-1ɑ的表达(图1、2)。

图1 RT-PCR检测人RB Y-79细胞HIF-1ɑm RNA表达
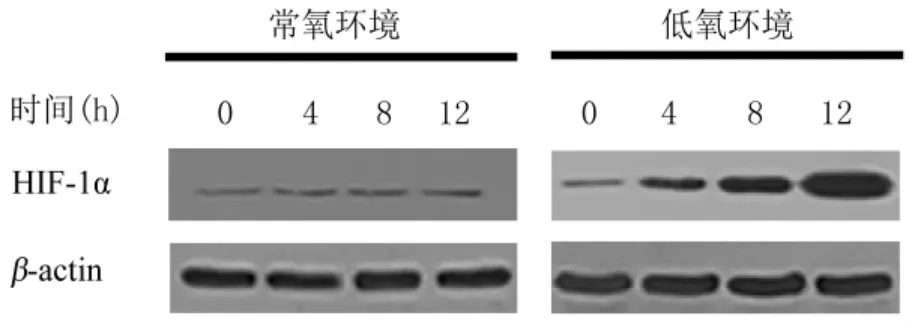
图2 Western blot检测人RB Y-79细胞HIF-1ɑ蛋白表达
2.2 siRNA HIF-1ɑ抑制人RB Y-79细胞表达HIF-1ɑ
为确定siRNA HIF-1ɑ是否能抑制人RB Y-79细胞表达HIF-1ɑ,遂将siRNA HIF-1ɑ转染细胞24 h后进行RT-PCR和Western blot分析。结果表明,在常氧和缺氧条件下人RB Y-79细胞表达HIF-1ɑ的mRNA和蛋白水平被抵消或者消除(图3、图4)。

图3 RT-PCR检测人RB Y-79细胞HIF-1ɑmRNA表达

图4 Western blot检测人RB Y-79细胞HIF-1ɑ蛋白质表达
2.3敲除HIF-1ɑ抑制人RB Y-79细胞增殖MTT实验检测(酶联免疫检测仪OD490nm处测量)HIF-1ɑ基因在细胞增殖中的作用。常氧和缺氧条件下,当人RB Y-79细胞敲除HIF-1ɑ基因后,细胞增殖表现为明显的时间依赖性降低(图5、6)。这些结果表明,HIF-1ɑ参与人RB Y-79的细胞增殖。

图5 常氧条件下人RB Y-79细胞增殖情况

图6 缺氧条件下人RB Y-79细胞增殖情况
2.4敲除HIF-1ɑ诱导人RB Y-79细胞凋亡Annexin V-FITC和Propidium Iodide双染法流式细胞术检测HIF-1ɑ在细胞凋亡中的作用。当敲除人RB Y-79细胞HIF-1ɑ基因后,相对于对照组,凋亡细胞百分比显著上升,在缺氧条件下更加敏感。结果表明,在人RB Y-79细胞中,siRNA HIF-1ɑ诱导的凋亡是功能性缺失HIF-1ɑ的特定结果(图7)。
2.5敲除HIF-1ɑ诱导人RB Y-79细胞凋亡的机制
为了解人RB Y-79细胞敲除HIF-1ɑ诱导其凋亡的机制,笔者对细胞凋亡相关分子(Bax/Bcl-2比率、caspase-9、caspase-3)进行了研究。结果表明,相对于对照组,敲除人RB Y-79细胞HIF-1ɑ能提高Bax/Bcl-2比值、活化caspase-9激活剂和caspase-3效应剂;在常氧条件下,观察到了类似但微弱的结果(P>0.05,差异无统计学意义)(图8、9、10)。

图7 Annexin V-FITC和Propidium Iodide双染法流式细胞术检测HIF-1ɑ对人RB Y-79细胞凋亡的影响
图8敲除HIF-1ɑ对人RB Y-79细胞Bax、Bcl-2表达的影响
3 讨论
在细胞环境中,HIF-1ɑ被证明参与癌症生物学的许多重要方面,包括血管生成、细胞存活、侵袭和凋亡以及对化、放疗的抵抗性[16]。更有研究表明HIF-1ɑ参与促进RB细胞的存活和增殖[12]。但至目前为止,HIF-1ɑ在RB细胞增殖与凋亡中的作用仍知之甚少。本研究中,笔者首次观察了常氧和缺氧条件下,siRNA敲除人RB Y-79细胞HIF-1ɑ后对其细胞增殖、凋亡和凋亡途径的影响。

图10 敲除HIF-1ɑ对人RB Y-79细胞caspase-3活性的影响
在常氧条件下,HIF-1ɑ是von Hippel-Lindau肿瘤抑制蛋白的靶标,通过泛素蛋白酶体途径降解。然而,在缺氧条件下,这一过程被抑制,导致转录因子稳定积累。本研究中,人RB Y-79细胞暴露于缺氧环境诱导HIF-1ɑmRNA和蛋白水平成倍增加; siRNA HIF-1ɑ敲除HIF-1ɑ后对人RB Y-79细胞活力和凋亡的诱导有明显的影响。上述结果表明,通过siRNA HIF-1ɑ诱导人Y-79 RB细胞凋亡是HIF-1ɑ功能缺失的结果。Bax/Bcl-2比率是调控细胞死亡的“可变电阻器”,在外界因素刺激下,细胞的生死最终取决于BAX和BCL-2两种调控因子的平衡结果。作为细胞凋亡调节因子家族,caspase家族在凋亡的执行过程中占据着中心地位,直接参与凋亡启动、信号传递及凋亡效应,其中,caspase-9能在多种内、外源性刺激因子的作用下表达,通过线粒体通路激活其效应子caspase-3,从而诱导细胞凋亡。有研究表明,典型的线粒体凋亡级联反应,包括增加Bax/Bcl-2比值和半胱天冬酶活化,参与了缺氧/HIF-1ɑ介导的抗凋亡和细胞生存过程[17]。上述研究结果表明,敲除HIF-1ɑ可以提高Bax/Bcl-2比值、活化凋亡激活剂caspase-9和凋亡效应剂caspase-3,缺氧条件下该效应更为敏感。
[参考文献]
[1]Rodriguez-Galindo C,Chantada GL,Haik BG,etal.Treatmentof retinoblastoma:current status and future perspectives[J].Curr Treat Options Neurol,2007,9(4):294-307.
[2]Dyer MA.Biology of retinoblastoma[M].Springer US,2010:1-9.
[3]Varan A,KiratliH,Aydin B,etal.The treatment of retinoblastoma with four-drug regimen including cisplatin,etoposide,vincristine,and cyclophosphamide[J].Pediatr Hematol Oncol,2012,29(6):529-537.DOI:10.3109/08880018.2012.700387.
[4]Shields CL,Bianciotto CG,Jabbour P,etal.Intra-arterial chemotherapy for retinoblastoma:report No.1,control of retinal tumors,subretinal seeds,and vitreous seeds[J].Arch Ophthalmol,2011,129(11):1399-1406.DOI:10.1001/archophthalmol.2011.150.
[5]Chawla B,Jain A,Azad R.Conservative treatment modalities in retinoblastoma[J].Indian J Ophthalmol,2013,61(9):479-485.DOI:10.4103/0301-4738.119424.
[6]Mayer A,Vaupel P.Hypoxia,lactate accumulation,and acidosis: siblings or accomplices driving tumor progression and resistance to therapy[J].Adv Exp Med Biol,2013,789:203-209.DOI:10.1007/978-1-4614-7411-1_28.
[7]Ji RC.Hypoxia and lymphangiogenesis in tumormicroenvironment and metastasis[J].Cancer Lett,2014,346(1):6-16.DOI:10.1016/j.canlet.2013.12.001.
[8]Semenza GL,Wang GL.A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation[J].Mol Cell Biol,1992,12(12):5447-5454.
[9]Sudhakar J,Venkatesan N,Lakshmanan S,et al.Hypoxic tumor microenvironment in advanced retinoblastoma[J].Pediatr Blood Cancer,2013,60(10):1598-1601.DOI:10.1002/pbc.24599.
[10]汪晓磊,牛膺筠,马建民.HIF-1ɑ、HPSE、VEGF共同促进视网膜母细胞瘤的恶性进程[J].中华眼科杂志,2010,46(2): 140-144.
[11]岳晗,钱江,吴继红,等.缺氧诱导因子-1α在视网膜母细胞瘤中表达的区域性分布及其与血管内皮生长因子、Bax、Ki-67的关系[J].中华眼底病杂志,2011,27(5):440-445.DOI:10.3760/cma.j.issn.1005-1015.2011.05.009.
[12]Fernandes BF,Coates J,Odashiro AN,et al.Hypoxia-inducible factor-1αand its role in the proliferation of retinoblastoma cells [J].Pathol Oncol Res,2014,20(3):557-563.DOI:10.1007/s12253-013-9728-8.
[13]Dai S,Huang ML,Hsu CY,etal.Inhibition of hypoxia inducible factor 1alpha causes oxygen-independent cytotoxicity and induces p53 independent apoptosis in glioblastoma cells[J].Int JRadiat Oncol Biol Phys,2003,55(4):1027-1036.
[14]Xue Z,KeW,Kai Z,etal.Ziyuglycoside II inhibits the growth of human breast carcinoma MDA-MB-435 cells via cell cycle arrest and induction of apoptosis through the mitochondria dependent pathway[J].Internat JMolecul Sci,2013,14(9):18041-18055.
[15]Zhu X,Wang K,Zhang K,et al.Ziyuglycoside II inhibits the growth of human breast carcinoma MDA-MB-435 cells via cell cycle arrest and induction of apoptosis through themitochondria dependent pathway[J].Int JMol Sci,2013,14(9):18041-18055.DOI:10.3390/ijms140918041.
[16]Hammond JB,Kruger NJ.The bradford method for protein quantitation[J].Methods Mol Biol,1988,3:25-32.DOI:10.1385/0-89603-126-8:25.
[17]Corzo CA,Condamine T,Lu L,et al.HIF-1ɑregulates function and differentiation ofmyeloid-derived suppressor cells in the tumor microenvironment[J].JExp Med,2010,207(11):2439-2453.DOI:10.1084/jem.20100587.
[18]Piret JP,MottetD,RaesM,etal.Is HIF-1alpha a pro-or an antiapoptotic protein[J].Biochem Pharmacol,2002,64(5-6): 889-892.
(本文编辑:彭润松)
Inhibition of hypoxia inducible factor 1αby siRNA-induced apoptosis in human retinoblastoma cells
Lang Lili,Gao Yu,Ge Rongrong,Chen Jianmei,Jing Ming
(Department of Ophthalmology,Dongfang Hospital,Affiliated to Tonji University,Shanghai200120,China)
[Abstract]Objective To investigate the effect of hypoxia inducible factor-1ɑknocked down by small interfering RNA(siRNA)on cell proliferation,apoptosis and apoptotic pathways ofhuman Y-79 RB cells.MethodsCell proliferation,HIF-1ɑmRNA and protein levels were measured by MTT,RT-PCR and Western Bloton human Y-79 RB cells under both normoxic and hypoxic conditions,respectively.siRNA knockdown against HIF-1ɑwas carried out to suppress the expression of HIF-1ɑ.Cell apotosiswas determined by double staining cellswith the annexin V-FITC and PI.Caspase activity was assessed by the fluorometric assay.Biostatistical analyses were conducted with SPSS 16.0 software package.Results Amultifold increase in HIF-1ɑmRNA and protein levelswere observed after cellswere exposed to the hypoxic environ mentat0 h,4 h,8 h and 12 h.BothmRNA and protein levels of HIF-1ɑwere attenuated or abolished by transfection with siRNAHIF-ɑunder normoxic and hypoxic conditions.Futhermore,knockdown of HIF-1ɑcould enhance hypoxia-induced slight increase of Bax/Bcl-2 ratio and activate caspase-9 and caspase-3.Conclusion This study was able to show that a knockdown of HIF-1ɑby siRNAHIF-1ɑresulted in a decrease in proliferation and induction of apoptosis in human Y-79 RB cells under both normoxic and hypoxic conditions.HIF-1ɑexpression may be a promising strategy for the treatment of human RB in the future.
[Key words]Hypoxia inducible factor 1α;siRNA;Y-79 retinoblastoma cells
(收稿日期:2015-09-24)
[通信作者]高玉,电子信箱:gyhqyygy@sina.com
[基金项目]上海市卫生和计划生育委员会科研资助课题(201540304),上海市虹口区卫生和计划生育委员会科研资助课题(虹卫1402-11)
[中图分类号]R774
[文献标识码]A[DOI]10.3969/j.issn.1009-0754.2016.01.009
