转双Bt基因巨霸杨外源基因表达及抗虫性检测1)
2016-05-06赵洁杜沙沙邱彤杨敏生王进茂
赵洁 杜沙沙 邱彤 杨敏生 王进茂
(河北农业大学,保定,071000)
转双Bt基因巨霸杨外源基因表达及抗虫性检测1)
赵洁杜沙沙邱彤杨敏生王进茂
(河北农业大学,保定,071000)
摘要为提高转基因杨树中Bt基因的表达效率并扩大抗虫谱,以同时转入Cry1Ac和Cry3A基因的转双Bt基因巨霸杨(Populus deltocdes ‘55/56’×P. deltocdes ‘2KEN8’)株系1年生苗为材料,对外源基因的表达和抗虫性进行检测。经PCR检测,证明目的基因已被整合到巨霸杨基因组中。利用荧光定量PCR和ELISA技术检测了4个转基因株系叶片中Bt基因的转录丰度和毒蛋白表达量。结果表明:不同株系间Bt基因的转录丰度存在显著差异,Cry3A基因的转录丰度显著高于Cry1Ac基因的转录丰度;2种Bt毒蛋白表达量在各株系间存在显著差异,Cry3A毒蛋白质量分数均显著高于Cry1Ac毒蛋白质量分数。各株系对鳞翅目害虫美国白蛾(Hyphantria cunea)幼虫抗虫效果不明显,且无显著差异;对鞘翅目害虫柳蓝叶甲(Plagiodera versicolora)表现出极高抗虫效果,且均显著高于转单基因Cry3A 741杨高抗株系CC84,不同株系间存在显著差异。
关键词巨霸杨;双Bt基因;转录丰度;毒蛋白;抗虫性
分类号S718.43;Q965.9
Exogenous Gene Expression and Insect Resistance Detection of TransgenicPopulusdeltocdes‘55/56’×P.deltocdescv‘2KEN8’ with DoubleBtGene
Zhao Jie, Du Shasha, Qiu Tong, Yang Minsheng, Wang Jinmao
(Agricultural University of Hebei, Baoding 071000, P. R. China)//Journal of Northeast Forestry University,2016,44(3):47-51.
To improve the efficiency of genetically modified (gm) polar Bt gene expression and expand the insect-resistant spectrum, we chose thePopulusdeltocdes‘55/56’×P.deltocdescv‘2KEN8’ with doubleBtgene ofCry1AcandCry3Aof one-year seedlings as materials, and tested the expression of exogenous genes and insect resistance. The purpose gene was integrated into the genome in theP.deltocdes‘55/56’×P.deltocdescv‘2KEN8’ by PCR identification. We used the fluorescent quantitative PCR technique and ELISA to detect the four gm strains transcription abundanceBttoxic protein gene expression content in the leaves. The difference existed between the twoBtgene transcription abundance in different strains:Cry3Agene transcription abundance was significantly higher thanCry1Ac. Two kinds of Bt toxic protein expression quantity were significantly different between each strain.Cry3Atoxic protein levels in each strain were significantly higher thanCry1Ac. Each strains’ insect-resistant effect to lepidoptera pests, larvae (Hyphantriacunea) was not obvious with no significant difference between different strains. The strains showed very high insect-resistant effect to coleoptera pests (Plagioderaversicolora), and were significantly higher than that of single geneCry3Apoplars high strain CC84, and there was significant difference between different strains.
KeywordsPopulus deltocdes ‘55/56’×P. deltocdescv ‘2KEN8’; Double Bt gene; Transcript abundance; Toxic protein; Insect resistance
杨树栽培历史悠久,用途广泛,但是近年来虫害严重,给农林业造成巨大损失,使用传统的化学防治消灭害虫,虽可一时缓解虫害,但是会造成环境污染。利用植物基因工程可以将杀虫蛋白基因转入植物,使植物获得抗虫性。甄志先等将BtCry3A基因转入741杨,获得的转基因株系对鞘翅目害虫的致死率很低,但是对幼虫的发育起到了明显的抑制作用[1]。王颖等将部分改造的Cry1Ac基因与慈菇蛋白酶抑制剂(API)基因构建的载体导入三倍体毛白杨,获得的转基因植株明显抑制了鳞翅目幼虫的生长发育,且不同转基因株系饲养的幼虫,其生长发育存在显著差异[2]。随着害虫对转基因植株产生耐受性及抗性有了越来越多报道之后,科研工作者将2个或多个不同的抗性基因导入同一植物中,通过基因叠加的方法使昆虫难以对2种或2种以上的抗虫物质同时产生抗性,以延缓抗性的产生[3-6]。王桂英等在田颖川的基础上将Cry3A基因导入已转Cry1Ac+API基因的741毛白杨高抗虫株系Pb29中,成功获得转双Bt基因的741杨,有效地发挥了基因的叠加效应,使高抗株系具有了更高的抗虫能力[7-9]。
多基因转化克服了单个目的基因逐个重复导入受体植株的问题,大大减少了组织培养、遗传转化和DNA提取的工作量,缩短了转化周期[10]。本试验将Cry1Ac和Cry3A两种Bt基因构建在植物转化载体上,转化美洲黑杨杂交品种巨霸杨(Populusdeltocdes‘55/56’×P.deltocdes‘2KEN8’),获得转基因株系,比较分析获得的转基因株系Bt基因转录和表达差异,探索影响双Bt基因表达的因素,为杨树多基因遗传转化提供理论基础。
1材料与方法
1.1试验材料
转双Bt基因巨霸杨株系。植物表达载体为p71A68Y71,结构如图1,携带2个抗虫Bt基因Cry1Ac(GenBank accession:AF148644)和Cry3A(GenBank accession:M84650),选择标记基因为对卡那霉素具有抗性的新霉素磷酸转移酶基因(nptII),目的基因Cry1Ac在Cry3A前端,Cry1Ac基因启动子为CaMV35S启动子,Cry3A基因启动子为CoYMV。且在目的基因两侧加入了来自烟草的MAR结构,MAR结构为一段环状碱基序列,可以增强基因的表达。转基因受体巨霸杨杂交组合为Populusdeltocdes‘55/56’×P.deltocdes‘2KEN8’,是由中国林业科学研究院培育的优良杨树杂交新品种。试验的对照材料为未转基因巨霸杨和转Cry3A基因741杨高抗虫性株系CC84[11]。采用农杆菌介导法将双Bt基因一次性转入巨霸杨杨叶盘中,通过卡那霉素筛选获得转化植株。

图1 p71A68Y711(8 400 bp)的结构
1.2测试昆虫
参试昆虫为柳蓝叶甲(Plagioderaversicolora)幼虫和美国白蛾(Hyphantriacunea)幼虫。
1.3转基因株系的PCR检测
从苗圃中采集1年生转基因苗木叶片,采用改良的CTAB法提取巨霸杨株系及对照植株嫩叶的基因组DNA[12]。以基因组DNA为模板,分别用Cry1Ac和Cry3A基因的正反引物进行PCR检测。以农杆菌中含双Bt基因的质粒做阳性对照(菌落PCR),阴性对照为未经转化的普通巨霸杨。检测Cry1Ac基因的引物为5′-ATGGATAACAATCCGAACATCA-3′(F1);5′-CCACCTTTGTCCAAACACTGAA-3′(R1),扩增片段大小为546 bp。检测Cry3A基因的引物为5′-CACTGTTCCCACTGTACGATGT-3′(F2);5′-ATGTTGAAGAAGTCCACGCTCT-3′(R2),扩增片段大小为667 bp。Cry1Ac基因的PCR扩增程序:95 ℃预变性5 min;95 ℃变性50 s,50 ℃复性1 min,72 ℃延伸1 min,30个循环;72 ℃延伸7 min;25 ℃ 1 min。Cry3A基因的PCR扩增程序:95 ℃预变性5 min;95 ℃变性50 s,50 ℃复性1 min,72 ℃延伸1 min,30个循环;72 ℃延伸7 min。PCR仪购于Bio-RAD Chromo4公司。
1.4转基因株系的荧光定量PCR检测
2013年8月从苗圃中栽植的1年苗木中,随机选择各转基因株系和对照各3株,采集苗木上部完全展开的叶片,立即放入液氮中带回实验室。取叶片100 mg放入研钵中,加液氮迅速研成粉末,采用赛勒生物公司超纯RNA提取试剂盒EASYEx PLUS Plant RNA Kit,按照说明书流程提取叶片总RNA。之后,采用北京艾德莱公司的反转录试剂盒TUREscript 1st Strand cDNA Synthsis Kit 进行cDNA第1链的反转录。根据从NCBI中查找的目的基因的全序列信息设计荧光定量PCR引物。以上述反转录合成的cDNA为模板,采用2×Sybr Green qPCR Mix进行荧光定量PCR。Cry1Ac基因荧光定量PCR引物为5′-GAATTTTTGGTCCCTCTCAAT-3′(F1);5′-AGGATCTGCTTCCCACTCTCT-3′(R1)。Cry3A基因荧光定量PCR引物为5′-TGGGGATACGAGAAGGAGGAT-3′(F2);5′-AGTGGGAACAGTGCGATGAGA-3′(R2)。用已知片段大小的含Cry1Ac和Cry3A的质粒DNA为标准品,按照10倍梯度稀释,进行实时荧光定量PCR反应生成标准曲线。根据每个PCR反应管内荧光信号到达设定的域值时所经历的循环数(Ct值),以及利用已知表达量的标准品做出的标准曲线,从标准曲线上计算出以mRNA为转录本合成的cDNA中Bt基因的丰度。
1.5转基因株系的ELISA检测
8月份从苗圃中栽植的1年苗木中,随机选择各转基因株系和对照各3株,采集苗木上部完全展开的叶片,用于Bt蛋白检测。检测Cry1Ac蛋白用美国Agdia公司的Bt-Cry1Ab/1AcELISA蛋白检测试剂盒;检测Cry3A蛋白用Agdia公司的Bt-Cry3AELISA蛋白检测试剂盒,阳性对照为试剂盒自带,阴性对照为非转基因巨霸杨。检测过程参照试剂盒的说明及牛小云等的实验方法进行,用BioRad 550型酶标仪测定结果[13]。以每克新鲜叶片所含毒蛋白的质量分数计算毒蛋白含量。
1.6转基因株系的饲虫试验
检测Cry1Ac毒蛋白抗虫性所用昆虫为美国白蛾初孵的1龄幼虫。2013年7月初从河北农业大学苗圃采集美国白蛾卵块,在温室内孵化的1龄幼虫直接用于饲虫试验。
检测Cry3A毒蛋白抗虫性所用昆虫为柳蓝叶甲的1龄、2龄、3龄幼虫。2013年4月底从河北农业大学苗圃采集柳蓝叶甲成虫,置于室温下培养,每天换取新鲜幼嫩的非转基因巨霸杨叶片。每天收集虫卵进行培养,用非转基因对照饲喂幼虫,3d后得到柳蓝叶甲初孵的1龄幼虫,并培养至2龄、3龄用于试验。
从苗圃中采集各转基因株系和非转基因对照当年生苗木新鲜叶片,将叶柄插入湿润的花泥块中,以保持叶片新鲜。将测试昆虫轻轻均匀地放到叶片上,然后放置于小烧杯中,杯口用双层湿润纱布覆盖并绑好。再将小烧杯放置于塑料袋中,轻松绑缚,保持湿度和透气。每个株系设置3次重复,每个重复1瓶,放置30头幼虫。每天换取新鲜叶片,记录测试幼虫的死亡数,及存活幼虫的平均体质量、体长,至幼虫的数量稳定或是全部死亡,停止试验。
校正死亡率公式为:校正死亡率=(转基因株系死亡率-对照死亡率)/(1-对照死亡率)
1.7数据分析
采用Excel软件对试验数据进行处理,利用SPSS 13.0软件进行方差分析及多重比较。
2结果与分析
2.1转基因株系的PCR检测
采用2个Bt基因的特异性引物,对初步获得的4个转基因株系进行PCR扩增。以含有双Bt基因质粒和非转基因巨霸杨植株为阳性对照和阴性对照。PCR扩增结果表明,在获得的4株转基因巨霸杨中均检测到Cry1Ac和Cry3A基因,如图2所示。PCR扩增结果初步确定目的基因已整合到巨霸杨基因组中。
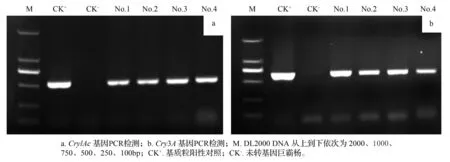
图2 外源基因的PCR检测
2.2转基因株系荧光定量PCR扩增
利用荧光信号积累对整个PCR进程实时监测表明,4个株系均检测到了Cry1Ac和Cry3A荧光信号的表达。对照没有双Bt基因的荧光扩增信号,转单Cry3A株系CC84只检测到Cry3A基因的荧光信号表达。由表1可以看出,Cry1Ac基因的转录丰度为7.50×103~8.38×103,Cry3A基因的转录丰度为3.80×105~5.15×106。Cry3A基因的转录丰度显著高于Cry1Ac基因的转录丰度。统计分析表明,Cry1Ac基因的转录丰度均很低,且不同株系之间无显著差异;Cry3A基因转录丰度在不同株系之间存在显著差异,No.1株系转录丰度最高。
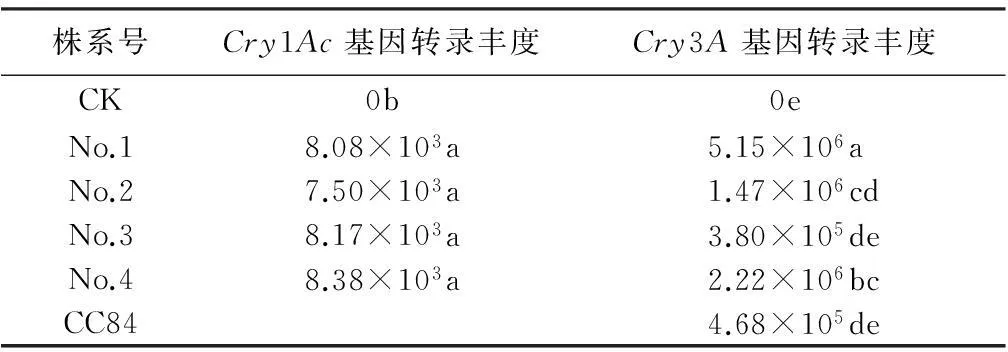
表1 荧光定量PCR检测Cry1Ac和Cry3A基因的转录丰度
注:同列数据后字母不同表示差异显著(P<0.05);转录丰度指每微克RNA中所含拷贝数。
2.3转基因株系Bt毒蛋白的ELISA检测
ELISA检测2种Bt毒蛋白结果见表2。由表2可见,Cry1Ac毒蛋白在各转基因株系中均表达量极低,仅为0.13~0.33 ng·g-1。各转基因株系之间存在显著差异,No.3和No.2株系毒蛋白质量分数较高。Cry3A毒蛋白质量分数均极显著高于Cry1Ac毒蛋白,为35.78~236.91 μg·g-1。各转基因株系之间存在显著差异,No.1株系毒蛋白质量分数最高。
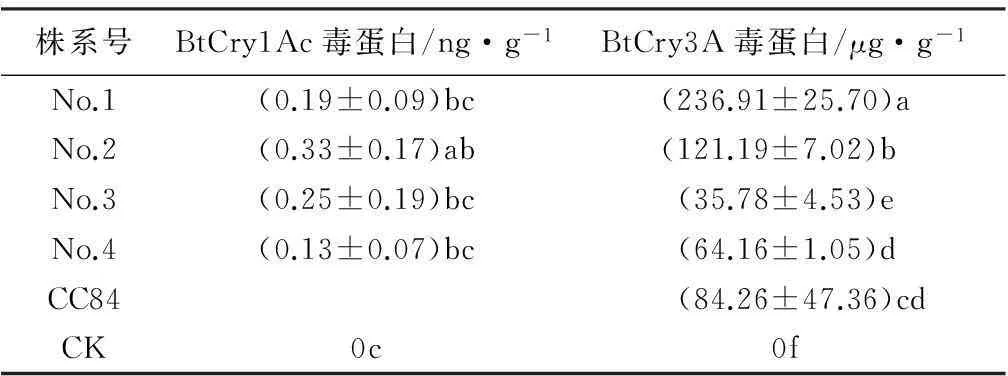
表2 各株系的Cry1Ac和Cry3A毒蛋白质量分数
注:表中数据为平均值±标准差,同列数据后字母不同表示差异显著(P<0.05)。
2.4转基因株系对美国白蛾幼虫抗性检测
用转基因植株和对照植株叶片饲喂美国白蛾1龄幼虫结果表明,转基因叶片对幼虫的致死率很低,与对照无显著差异。对各株系叶片饲养4 d的美国白蛾幼虫分别称量虫体长和虫体质量如表3所示。统计分析表明,不同株系之间及与对照之间,在虫体质量和虫体长性状上均无显著差异,表明转基因植株Cry1Ac毒蛋白表达量低,抗虫效果不明显。

表3 转基因株系对美国白蛾幼虫发育的影响
注:表中数据为平均值±标准差。
2.5转基因株系对柳蓝叶甲抗性检测
2.5.1对柳蓝叶甲幼虫致死效果
表4结果表明,转基因植株对柳蓝叶甲幼虫的致死效果非常显著,几乎所有株系对1龄幼虫的致死率均达到100%。随着幼虫的发育,转基因植株的致死率逐渐下降,各株系对2龄幼虫的致死率为93.3%~100.0%,对3龄幼虫致死率下降为52.22%~94.44%。不同转基因株系间对柳蓝叶甲幼虫致死率存在显著差异,主要表现在对3龄幼虫的致死效果上。No.1和No.4株系的致死效果最好,这2个株系对3龄幼虫致死率仍保持在90%以上。各株系对柳蓝叶甲幼虫的致死效果与Cry3A毒蛋白的表达量基本一致,毒蛋白表达量高的抗虫效果好。各转基因株系的抗虫效果均显著高于单转Cry3A基因的阳性对照株系CC84。
2.5.2对柳蓝叶甲成虫致死效果
柳蓝叶甲的成虫对转基因巨霸杨的抗性高于幼
虫,且不同转基因株系间抗虫性间存在差异。随着虫试时间的推移,成虫死亡率逐渐增加(图3)。饲养第2天,各株系死亡率最高,为40.5%;随着培养时间的延长,各转基因株系死亡率也逐渐延长,No.3的成虫死亡率一直较低,虫试第8天,死亡率只有15.4%,其余株系在虫试第8天的死亡率均达到80%;其中No.1的死亡率最高,在虫试第6天死亡率为80%,第8天死亡率达到95.8%。虫试第2天开始,用非转基因巨霸杨叶片饲喂的柳蓝叶甲开始产卵,而用转基因巨霸杨叶片饲喂的柳蓝叶甲均未产卵,且死亡率逐渐增大(图4)。
表4不同转基因株系对柳蓝叶甲幼虫致死效果

%
注:表中数据为平均值±标准差,同列数据后字母不同表示显著差异(P<0.05)。
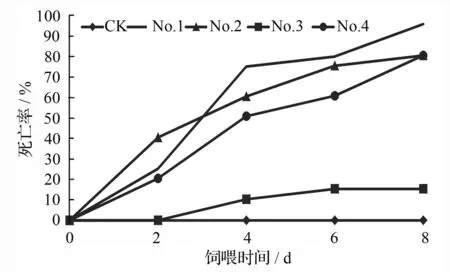
图3 转基因不同株系上柳蓝叶甲成虫的死亡率

图4 柳蓝叶甲成虫取食叶片2d的情况
3讨论
Bt毒蛋白基因是杨树转基因中应用最广也是最有潜力的抗虫基因,目前已构建了多种携带不同类型Bt基因的转化载体[14]。Cry1Ac基因和Cry3A基因是杨树抗虫基因工程研究中常用的Bt基因,已成功导入不同杨树品种,并且各转基因株系表达出抗虫性[15-17]。转Cry1Ac基因杨树对美国白蛾等鳞翅目害虫具有高抗虫性,而转Cry3A基因杨树对柳蓝叶甲等鞘翅目害虫也具有高抗虫性,对1龄幼虫致死率分别达到85%、100%以上[18-19],并能明显抑制杨树重要蛀干害虫桑天牛(Aprionagermari)幼虫的生长发育[11]。王彦平等以转Cry3A基因741杨株系和转CrylAc+API双抗虫基因741杨株系为材料,比较研究了转不同抗虫基因杨树对不同类型害虫的抗虫性,证明了转CrylAc+API741杨对鞘翅目害虫没有抗虫性,仅对鳞翅目害虫具有抗虫效果,转Cry3A基因741杨也得到了类似的结论[18]。同时发现,Cry3A基因毒蛋白表达量高于CrylAc基因毒蛋白表达量达10倍以上。
本研究中,将2个Bt基因构建在一个载体上,导入杨树基因组中,得到的转基因株系中2个基因的毒蛋白表达量也存在显著差异,Cry3A毒蛋白的表达量比Cry1Ac的毒蛋白表达量高104~105倍。在抗虫性检测中,对柳蓝叶甲致死率极高,且高于转Cry3A单基因的高抗株系CC84,而对鳞翅目害虫无抗虫效果,与对照无差异,说明Cry1Ac基因基本未表达。在过去的研究中,通过二次转化法将这2个Bt基因分别插入到植物基因组不同位置,均能高效表达[8]。本研究中,2个基因的表达量存在显著差异,可能原因是:2个基因具有较高的同源性,出现干扰引起了基因间互作,使得其中一个基因抑制了另一个基因。另外,目的基因的排列顺序也影响了基因的表达量。在转化载体中,Cry3A基因靠近T-DNA左边界(LB),Cry1Ac基因位于右边界(RB)。根据在烟草上的相关研究发现,当将这2个Bt基因同时构建在1个转化载体上时,无论是Cry3A基因还是Cry1Ac基因,靠近T-DNA左边界的Bt基因表达效率均高,而靠近右边界的基因被抑制,这还需要进一步深入研究和验证。
在获得的4个转基因株系间Bt基因的毒蛋白表达量和抗虫性存在明显差异。No.1株系的Bt基因表达量较高,其Cry3A毒蛋白表达量要高出其他株系将近两倍,抗虫效果也更为显著。李宝健等的研究证明,在同一转化事件中,不同转基因株系间外源基因的表达存在差异[4]。这与本试验结论一致,因此,对大量转基因株系的筛选,可获得表达水平更高的转基因株系。
参考文献
[1]甄志先,李静,梁海永,等.转BtCry3A基因杨树毒蛋白表达及对桑天牛抗性的研究[J].蚕业科学,2007,33(4):538-542.
[2]王颖,甄志先,杨敏生,等.转双抗虫基因三倍体毛白杨外源基因表达及性状相关性分析[J].昆虫学报,2007,50(9):907-913.
[3]BATES S L, ZHAO J Z, ROUSH R T, et al. Insect resistance management in GM crops: past, present and future[J]. Nature Biotechnology,2005,23(1):57-62.
[4]李宝健,朱华晨.论应用多基因转化策略综合改良生物体遗传性研究方向的前景[J].中山大学学报(自然科学版),2005,44(4):79-83.
[5]CHRISTOU P, CAPELL T, KOHLI A, et al. Recent developments and future prospects in insect pest control in transgenic crops[J]. Trends in Plant Science,2006,11(6):302-308.
[6]王继磊,刘迪秋,丁元明,等.Bt转基因抗虫植物研究进展[J].生物学杂志,2010,27(4):75-78.
[7]王桂英,杨敏生,霍雪梅,等.转单、双Bt基因741杨外源基因表达和抗虫性比较[J].昆虫学报,2012,55(7):798-803.
[8]王桂英,杨敏生,霍雪梅,等.741杨双Bt基因的遗传转化及转基因株系的抗虫性[J].林业科学,2012,48(9):42-49.
[9]田颖川,郑均宝,虞红梅,等.转双抗虫基因杂种 741毛白杨的研究[J].植物学报,2000,42(3):263-268.
[10]别晓敏,佘茂云,杜丽璞,等.植物多基因转化研究进展[J].中国农业科技导报,2010,12(6):18-23.
[11]牛小云,黄大庄,杨敏生,等.转Btcry3A基因杨树6个株系体内毒蛋白表达及对桑天牛的抗性鉴定[J].蚕业科学,2011,37(4):593-599.
[12]王关林,方宏筠.植物基因工程[M].2版.北京:科学出版社,2002:329.
[13]牛小云,黄大庄,杨敏生,等.转Btcry3A抗虫基因杨树中毒蛋白的时空表达[J].林业科学,2011,47(12):154-157.
[14]张蕾,崔建国,王洪魁.杨树Bt抗虫基因工程研究进展[J].中国森林病虫,2005,24(3):19-22.
[15]杨利艳,孙毅,谢莉琴.转基因杨树的研究及其生物安全评价[J].分子植物育种,2008,6(1):123-127.
[17]AXELSSON E P, HJLTÉN J, LEROY C J. Performance of insect-resistantBacillusthuringiensis(Bt)-expressing aspens under semi-natural field conditions including natural herbivory in Sweden[J]. Forest Ecology and Management,2012,264:167-171.
[18]王彦平,李静,杨敏生,等.转不同抗虫基因741杨的抗虫选择性[J].林业科学,2008,44(8):67-71.
[19]YANG M S, LANG H Y, GAO B J, et al. Insecticidal activity and transgene expression stability of transgenic hybrid poplar clone 741 carrying two insect-resistant genes[J]. Silvae Genetica,2003,52(5/6):197-201.
收稿日期:2015年3月27日。
第一作者简介:赵洁,女,1990年7月生,河北农业大学林学院,硕士研究生。E-mail:308801987@qq.com。通信作者:王进茂,河北农业大学林学院,教授。E-mail:lxwjm@hebau.edu.cn。
1)国家高技术研究发展计划“863”计划项目(2013AA102703)。
责任编辑:程红。
