缓释处理茉莉酸类化合物对兴安落叶松叶内防御蛋白活性的诱导效果1)
2016-05-06林健严善春
林健 严善春
(东北林业大学,哈尔滨,150040)
缓释处理茉莉酸类化合物对兴安落叶松叶内防御蛋白活性的诱导效果1)
林健严善春
(东北林业大学,哈尔滨,150040)
摘要外源茉莉酸类化合物能够诱导植物产生抗虫性,为了延长其作用时间,选取茉莉酸甲酯(MJA)和茉莉酮(ZJ),将2种化合物倒入缓释瓶中作为缓释处理,挂于2年生兴安落叶松(Larix gmelinii)苗木中下部;以用2种化合物直接喷施落叶松苗为对照。测定落叶松针叶内与抗虫相关的几种主要防御蛋白的活力。喷施及用缓释处理MJA和ZJ后,兴安落叶松针叶内防御蛋白活性都有显著地增加(P<0.01),并且呈现先升高后降低的波动变化。缓释处理的MJA和ZJ对兴安落叶松针叶内防御蛋白诱导作用没有直接喷施处理反应迅速,表现为前期诱导效果低于喷施处理,但后期诱导效果好于喷施处理,且缓释处理诱导效果可以延长5~15 d。MJA诱导效果强于ZJ。说明外源茉莉酸类化合物对落叶松抗虫性的诱导作用,经过缓释处理可以得到延长。
关键词兴安落叶松;茉莉酸甲酯;茉莉酮;诱导抗性;缓释效果;防御蛋白
分类号S769;S791.222
Induction Effect of Slow-release Exogenous Jasmonic on the Activities of Defense Protein inLarixgmeliniiNeedles
Lin Jian, Yan Shanchun
(Northeast Forestry University, Harbin 150040, P. R. China)//Journal of Northeast Forestry University,2016,44(3):82-85.
In order to control release of active exogenous jasmonic acid compounds and maintain a certain active duration, exogenous methyl jasmonate signal substances and jasmone were poured into the slow-release bottles, spayed onto 2-year-old larch trees, and the activities of several major defense protein in larch needles were measured to maintain a certain active duration of induced resistance of larch. The activities of defense proteins were increased significantly in the needles ofL.gmeliniiinduced by exogenous jasmonates and slow-release treatments. The variation of their activity was waved in the period of the experimentation. Slow-release bottles with these jasmonates may provide a feasible control release formulation to extend their effective life-span (duration) of enhancing induced resistance of larch for at least five days.
KeywordsLarix gmelinii; Methyl jasmonate; Cis-jasmone; Induced resistance; Slow-release; Defensive protein
茉莉酸(JA)首先是从真菌中分离得到的,人们把具有JA基本结构的一类衍生物统称为茉莉酸盐或茉莉酸类化合物(JAs)。JAs在植物界中普遍存在[1],包括茉莉酸、茉莉酸甲酯(MJA)、茉莉酮(ZJ)、二氢茉莉酸(DHJA)和南瓜子酸(CA)等多种JAs相关化合物[2-4]。大量的研究表明,JAs是衰老启动物质,并在诱导、胁迫、创伤、病虫害防御等信号传导中起着重要的作用[5-7]。
诱导抗性作为一种新的植物抗性类型,在防御植食者的取食和产卵方面具有很大的潜力[8]。由于茉莉酸类化合物有一定的挥发性,因而应用外源茉莉酸类化合物诱导植物产生抗虫性的方法有2种[9-10]:一种是喷雾法;另一种是暴露法。在植物生长季节必要时间段内,要实现对植物化学防御能力的持续诱导,保持植物抗虫性,需要对挥发性诱导剂茉莉酸类化合物进行缓释处理,以保证在害虫活跃期诱导剂的持续有效释放。
本研究选取2种可以诱导兴安落叶松(Larixgmelinii)产生抗虫性的外源茉莉酸类物质茉莉酸甲酯和茉莉酮[11],为了延长其作用时间对这2种物质进行缓释处理,之后施用于兴安落叶松,通过比较分析落叶松针叶内防御蛋白的时序变化,测定其缓释效果。为利用林木的诱导抗性控制害虫提供理论依据。
1材料与方法
1.1供试落叶松苗
2012年4月末,于黑龙江平山森林植物试种苗圃,将2年生的兴安落叶松苗1 000株单株栽于塑料桶内,自然光照条件下生长,及时浇水、施肥、除草,避免人为机械损伤和病虫危害。恢复生长40 d后,备用。
1.2供试试剂及缓释处理
将茉莉酸甲酯和茉莉酮各配制成不同浓度,分别装入缓释瓶(北京中捷生物公司)中,挂于落叶松苗中下部,分别于1、3、5、10 d后取样测定落叶松针叶内防御蛋白活性作为预试验,根据预试验结果,确定每种化合物的合适浓度(表1),装瓶缓释备用。
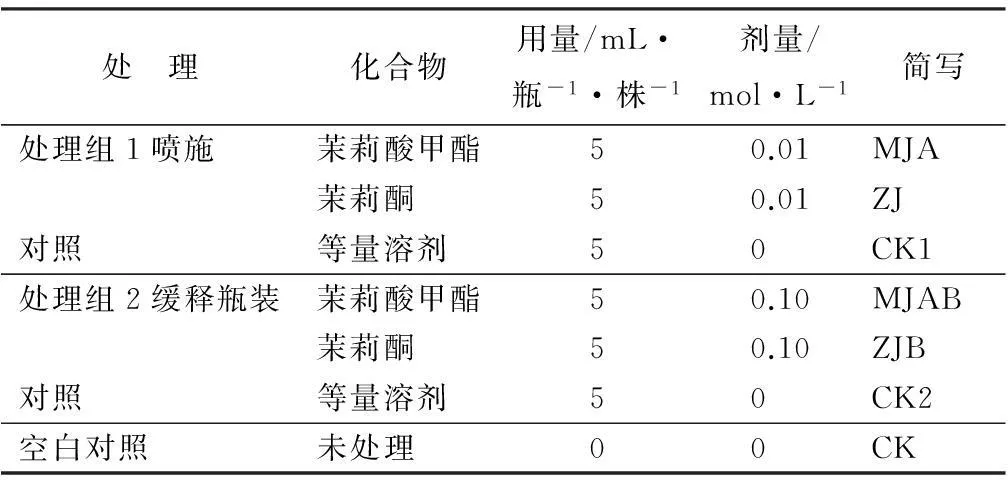
表1 缓释茉莉酸类化合物对兴安落叶松苗的处理
1.3兴安落叶松苗处理
将装瓶缓释的茉莉酸甲酯和茉莉酮悬挂于健康、长势相似的苗木中下部,以瓶装等量溶剂或在苗木上直接喷施化合物的等量溶剂为对照,以未做任何处理的苗木作为空白对照。每组处理100株,详见表1。每组处理的幼苗之间间隔15 m以上。根据预试验及正式试验结果,2组溶剂对照及空白对照的防御蛋白活性均无显著差异,因此结果分析中的对照均选用空白对照的数据。
1.4落叶松针叶内主要防御蛋白活力的测定
1.4.1样品的采集
分别于处理后1、3、5、10、15、20、25、30 d采集落叶松针叶。采样时,在每样株自上至下每个轮枝的不同方位上摘取健康针叶,每处理采集9株,每3株为一个重复,重复3次。每个重复摘取针叶鲜质量约20 g。将每重复所采针叶充分混均,放置于夹链袋内,低温密封保存,带回实验室,冰箱冷冻保存待用。
1.4.2POD、CAT活性
过氧化物酶(POD)活性测定参照李合生[12]的愈创木酚法,以1 min内OD470变化0.01的酶量为1个酶活力单位(U·g-1·min-1)。过氧化氢酶(CAT)活性测定参照王晶英等[13]的过氧化氢氧化法,以1 min内OD240减少0.1的酶量为1个酶活力单位(U·g-1·min-1)。
1.4.3PAL、PPO活性
苯丙氨酸解氨酶(PAL)活性测定采用苯丙氨酸比色法[14],以1 min内OD290变化0.01为1个酶活力单位(U·g-1·min-1)。多酚氧化酶(PPO)活性测定采用咖啡酸比色法[15],以1 min内OD470变化0.01为1个酶活力单位(U·g-1·min-1)。
1.4.4TI、CI活性
胰蛋白酶抑制剂(TI)、胰凝乳蛋白酶抑制剂(CI)活力测定参照徐伟[16]的方法,以1 min内蛋白酶抑制剂活力降低0.001为1个酶活力单位(U·g-1·min-1)。
1.5数据统计及分析
数据用SPSS17.0统计分析软件进行方差分析,差异显著性检验采用LSD方法。
2结果与分析
2.1各处理落叶松针叶内保护性酶活性
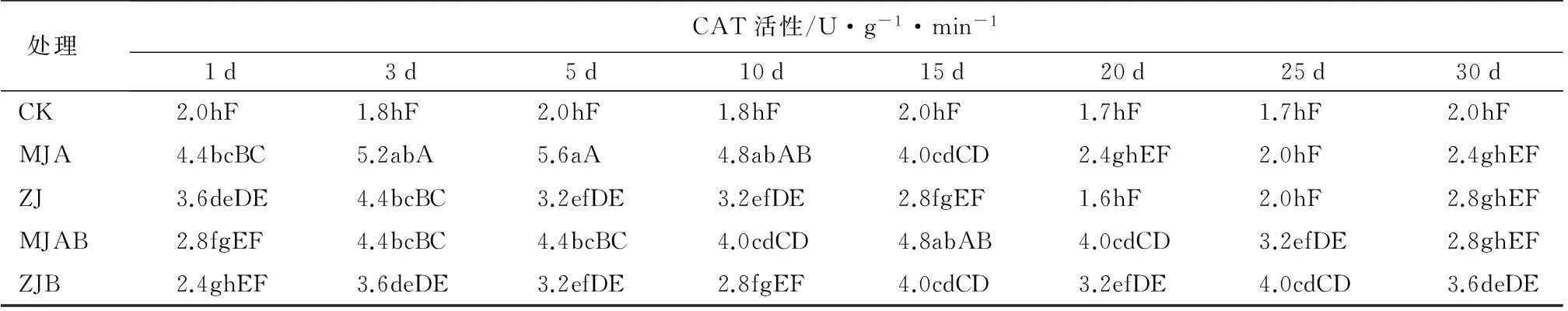
由表2可见,喷施MJA诱导后,POD和CAT活性在1~5 d大量增加,5 d时最大;从第10天开始呈下降的趋势,25 d时与对照相比无差异,诱导效果可达20 d以上。用缓释处理的MJA诱导后,POD活性在1~5 d、CAT活性在1~3 d大量增加,随后POD、CAT活性维持稳定,直到25 d时与对照相比差异极显著(P<0.01),到30 d时与对照相比仍有明显差异(P<0.05或P<0.01),诱导效果至少维持30 d。诱导效果,1~5 d喷施处理好于缓释处理,从15~25 d,缓释处理好于较喷施处理。喷施ZJ诱导后,POD活性变化与喷施MJA有相似的趋势,5 d时达到最大,15 d时与对照相比无显著差异,诱导效果可达10 d以上。CAT活性3 d时达到最大,20 d时与对照相比无差异,诱导效果可达15 d以上。用缓释处理ZJ诱导后,POD活性在1~10 d大量增加,随后POD活性维持稳定,直到20 d时与对照相比还有极显著差异(P<0.01),诱导效果至少维持20 d;CAT活性在1~15 d大量增加,随后CAT活性维持稳定,直到30 d时与对照相比还有显著差异(P<0.01),诱导效果至少维持30 d。诱导效果,1~5 d喷施处理好于缓释处理,15~30 d缓释处理好于喷施处理。
2.2各处理落叶松针叶内防御性酶活性
由表3所见,MJA喷施诱导后,PPO活性在1~10 d大量增加,10 d时PPO活性达到最大。从第10天开始PPO活性呈下降的趋势,30 d时与对照相比无差异,诱导效果可达25 d以上。PAL活性在1~5 d大量增加,5 d时PAL活性达到最大。从第10天开始PAL活性呈下降的趋势,25 d时与对照相比无差异,诱导效果可达20 d以上。用MJA缓释处理诱导后,PPO活性在1~5 d大量增加,随后PPO活性维持稳定,直到30 d时与对照相比还有明显差异(P<0.05),缓释诱导效果至少维持30 d;PAL活性在1~10 d大量增加,直到30 d时与对照相比还有显著差异(P<0.01),诱导效果至少维持30 d。15~30 d,缓释诱导效果好于喷施处理。喷施ZJ诱导后,PPO活性变化与喷施MJA有相似的趋势,3 d时达到最大,30 d时与对照相比无差异,诱导效果可达25 d以上。PAL活性10 d时达到最大,25 d时与对照相比无差异,诱导效果可达20 d以上。ZJ缓释处理诱导后,PPO活性在1~5 d大量增加,随后PPO活性维持稳定,直到30 d时与对照相比还有明显差异(P<0.05),诱导效果至少维持30 d;PAL活性在1~10 d大量增加,随后PAL活性维持稳定,直到30 d时与对照相比还有显著差异(P<0.01),诱导效果至少维持30 d。5~30 d,缓释处理诱导效果好于喷施处理。

表2 兴安落叶松针叶内保护性酶活性的时序变化
处理CAT活性/U·g-1·min-11d3d5d10d15d20d25d30dCK2.0hF 1.8hF 2.0hF 1.8hF 2.0hF 1.7hF 1.7hF 2.0hFMJA4.4bcBC5.2abA5.6aA4.8abAB4.0cdCD2.4ghEF2.0hF2.4ghEFZJ3.6deDE4.4bcBC3.2efDE3.2efDE2.8fgEF1.6hF2.0hF2.8ghEFMJAB2.8fgEF4.4bcBC4.4bcBC4.0cdCD4.8abAB4.0cdCD3.2efDE2.8ghEFZJB2.4ghEF3.6deDE3.2efDE2.8fgEF4.0cdCD3.2efDE4.0cdCD3.6deDE
注:表中同列数据后不同小写字母表示在P=0.05水平差异显著,不同大写字母表示在P=0.01水平差异显著。
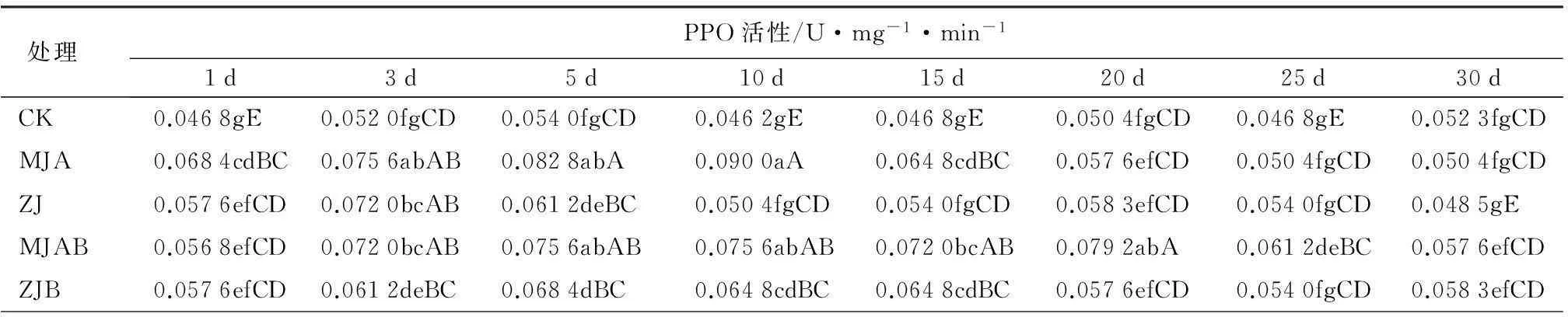
表3 兴安落叶松针叶内防御性酶活性的时序变化

处理PAL/U·mg-1·min-11d3d5d10d15d20d25d30dCK4.26fD 4.36fD 4.19fD 4.44fD 4.92fD 4.24fD 4.69fD 4.36fD MJA7.19cdBC7.34cdBC9.16aA8.24abAB7.59bcAB5.96efCD4.41fD4.59fDZJ7.44cdBC7.66bcAB7.39cdBC7.84abAB6.54efCD6.17efCD4.60fD4.39fDMJAB7.01cdBC7.13cdBC7.54cdBC7.70bcAB7.43cdBC7.77bcAB7.67bcAB7.73bcABZJB7.23cdBC7.30cdBC7.50cdBC7.67bcAB7.73bcAB6.79deCD6.69deCD6.39deCD
注:表中同列数据后不同小写字母表示在P=0.05水平差异显著,不同大写字母表示在P=0.01水平差异显著。
2.3各处理落叶松针叶内蛋白酶抑制剂活性
由表4可以看出,MJA喷施诱导后,TI和CI活性在1~3 d大量增加,3 d时TI活性达到最大,并维持稳定。从第15天开始TI开始下降,TI活性在30 d时、CI活性在25 d与对照相比无差异,诱导效果可达25 d或20 d以上。用MJA缓释处理诱导后,TI和CI活性在1~3 d大量增加,随后维持稳定,直到25 d时与对照相比还有显著差异(P<0.01),诱导效果至少维持25 d。诱导效果,在1~10 d喷施处理好于缓释处理;15~30 d,缓释处理好于喷施处理。喷施ZJ诱导后,TI活性在5 d时达到最大,20 d时与对照相比无差异,诱导效果可达15 d以上。CI活性变化与喷施MJA有相似的趋势,3 d时达到最大,10 d时与对照相比无差异,诱导效果可达5 d以上。用ZJ缓释处理诱导后,TI活性在1~3 d大量增加,随后TI活性维持稳定,直到25 d时与对照相比还有显著差异(P<0.01),诱导效果至少维持25 d;CI活性在1~5 d大量增加,随后CI活性维持稳定,直到15 d时与对照相比还有显著差异(P<0.01),诱导效果至少维持15 d。TI活性在1~5 d、CI活性在1~3 d,喷施处理好于缓释处理;TI活性在15~30 d、CI活性在5~20 d,缓释处理好于喷施处理。

表4 兴安落叶松针叶内蛋白酶抑制剂活性的时序变化

处理CI活性/U·mg-1·min-11d3d5d10d15d20d25d30dCK67.29fgFG76.63fgFG76.63fgFG80.37fgFG72.89fgFG76.63fgFG84.11fgFG87.85fgFGMJA181.30bcBC241.11aA244.85aA237.37aA138.31cdD117.75cdDE80.37fgFG91.59efFZJ115.88cdDE138.31cdD106.54cdDE80.37fgFG72.89fgFG69.16fgFG78.50fgFG65.42fgFGMJAB136.44cdD205.60abB199.99abB201.86abB194.39abB211.21abB128.97cdD95.32efFZJB87.85efF102.80efEF114.01cdDE110.28cdDE100.93efEF74.76fgFG71.03fgFG61.68fgFG
注:表中同列数据后不同小写字母表示在P=0.05水平差异显著,不同大写字母表示在P=0.01水平差异显著。
3结论
本研究结果表明,经过缓释处理的2种外源茉莉酸类化合物,可以使得兴安落叶松针叶内的防御蛋白POD、CAT、PPO、PAL、TI、CI活性显著提高(P<0.01),其变化规律呈现先升高后降低的波动变化,与喷施外源茉莉酸类化合物诱导的变化规律相近。缓释处理的茉莉酸类化合物对兴安落叶松针叶内防御蛋白诱导作用没有直接喷施处理反应迅速,表现为前期诱导效果低于喷施处理,但后期诱导效果好于喷施处理,且缓释处理诱导效果可以维持更长的一段时间。MJA缓释处理后,对POD、CAT、PAL活性的诱导至少可延长10 d,对PPO、TI、CI活性的诱导至少可延长5 d。ZJ缓释处理后,对CAT活性的诱导至少可延长15 d,对POD、PAL、TI、CI活性的诱导至少可延长10 d,对PPO活性的诱导至少可延长5 d。无论缓释与否,施用MJA产生的诱导强度均好于ZJ。
对外源茉莉酸类化合物经过简单的缓释处理后,使其对落叶松抗虫性的诱导增强作用可以得到延长,对于在生产中可持续控制害虫危害具有实践意义。
参考文献
[1]MEYER A, MIERSCH O, BÜTTNER C, et al. Occurrence of the plant growth regulator jasmonic acid in plants[J]. J Plant Growth Regul,1984,3(1):1-8.
[2]CHOI D, BOSTOCK R M, AVDIUSHKO S, et al. Lipid-derived signals that discriminate wound-and pathogen-responsive isoprenoid pathways in plants: Methyl jasmonate and the fungel elicitor arachidonic acid in-duce different 3-hydroxy-3-methylglutaryl-coenzyme a reductase genes and antimicrobial isoprenoids inSolanumtuberosumL.[J]. Proc Natl Acad Sci,1994,91(6):2329-2333.
[3]RICKAUER M, BRODSCHELM W, BOTTIN A, et al. The jasmonate pathway is involved differentially in the regulation of different defence responses in tobacco cells[J]. Planta,1997,202(2):155-162.
[4]MASON H S, DEWALD D B, CREELMAN R A, et al. Coregulation of soybean vegetative storage protein gene expression by methyl jasmonate and soluble sugars[J]. Plant Physiol,1992,98(3):859-867.
[5]SEMBDER G, PARTHIER B. The biochemistry and the physiological and molecular action of jasmonates[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1993,44(4):569-589.
[6]KAWAZU K, MOCHIZUKI A, SUGENO W, et al. Differences in the susceptibility of five herbivore species and developmental stages to tomato resistance induced by methyl jasmonate treatment[J]. Arthropod-Plant Interactions,2013,7(4):415-422.
[7]ZAHEER M, GIRI C C. Multiple shoot induction and jasmonic versus salicylic acid driven elicitation for enhanced andrographolide production inAndrographispaniculata[J]. Plant Cell Tiss Organ Cult,2015,122:553-563.
[8]WAR A R, PAULRAJ M G, IGNACIMUTHU S, et al. Defensive responses in groundnut against chewing and sap-sucking insects[J]. Journal of Plant Growth Regulation,2013,32(2):259-272.
[9]AVDIUSHKO S A, BROWN G C, DAHLMAN D L, et al. Methyl jasmonate exposure induces insect resistance in cabbage and tobacco[J]. Environ Entomol,1997,26(3):642-654.
[10]THALER J S. Jasmonate_inducible plant defences cause increased parasitism of herbivores[J]. Nature,1999,399:686-688.
[11]孟昭军.外源茉莉酸类化合物对两种落叶松的诱导抗虫性研究[D].哈尔滨:东北林业大学,2008.
[12]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:166-168.
[13]王晶英,敖红,张杰,等.植物生理生化实验技术与原理[M].哈尔滨:东北林业大学出版社,2003:169-180.
[14]ZONG N, WANG C Z. Larval feeding induced defensive responses in tobacco: comparison of two sibling species ofHelicoverpawith different diet breadths[J]. Planta,2007,226(1):215-224.
[15]FELTON G W, DONATO K K, BROADWAY R M, et al. Impact of oxidized plant phenolics on the nutritional quality of dietary protein to a noctuid herbivore,Spodopteraexigua[J]. Journal of Insect Physiology,1992,38(4):277-285.
[16]徐伟.兴安落叶松诱导抗虫性研究[D].哈尔滨:东北林业大学,2006.
收稿日期:2015年10月9日。
第一作者简介:林健,男,1982年10月生,东北林业大学林学院,博士研究生;现工作于湖北民族学院,讲师。E-mail:113431577@qq.com。通信作者:严善春,东北林业大学林学院,教授。E-mail:yanshanchun@126.com。
1)黑龙江省重点科技攻关项目(GA09B203-5)。
责任编辑:程红。
