Cd2+胁迫对小桐子幼苗叶片抗氧化系统的影响
2016-05-06王欣欣邓明华文锦芬
王欣欣,邓明华,龚 明,刘 颖,陈 凯,文锦芬*
(1 昆明理工大学建筑学与城市规划学院,昆明 650500;2 云南农业大学 园林园艺学院,昆明 650201;3 云南师范大学 生命科学院,昆明 650500;4 保山学院,云南保山 678000)
Cd2+胁迫对小桐子幼苗叶片抗氧化系统的影响
王欣欣1,邓明华2,龚明3,刘颖1,陈凯4,文锦芬1*
(1 昆明理工大学建筑学与城市规划学院,昆明 650500;2 云南农业大学 园林园艺学院,昆明 650201;3 云南师范大学 生命科学院,昆明 650500;4 保山学院,云南保山 678000)
摘要:以小桐子幼苗为材料,设置不同浓度CdCl2处理,测定Cd(2+)胁迫对小桐子幼苗叶片中可溶性蛋白、丙二醛(MDA)含量,以及5种抗氧化酶活性和 2 种抗氧化剂含量的变化,探讨镉胁迫对小桐子幼苗抗氧化系统的影响。结果表明:(1)Cd(2+)胁迫导致小桐子幼苗叶片中可溶性蛋白含量降低、MDA含量增加;(2)随着镉胁迫时间的延长,幼苗叶片中愈创木酚过氧化物酶(POD)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、抗坏血酸专一性过氧化酶(APX)、谷胱甘肽还原酶(GR)等抗氧化酶活性表现出先升高然后降低的变化趋势;(3)幼苗叶片中还原型抗坏血酸(ASA)和还原型谷胱甘肽(GSH)含量随着胁迫时间延长而降低,但其中氧化型抗坏血酸(DHA)和氧化型谷胱甘肽(GSSG)含量则升高。研究表明,镉胁迫初期能诱导小桐子幼苗抗氧化系统活性显著增强,提高其抗氧化能力,但随着胁迫时间的延长,致使其抗氧化酶的活性和抗氧物质含量下降,植株遭受明显氧化胁迫,幼苗生长受到镉的严重毒害。
关键词:小桐子;Cd(2+)胁迫;抗氧化酶;抗氧化物质
小桐子(JatrophacurcasL.)又名麻疯树、膏桐、臭桐、亮桐、篱笆果、油芦子等,属大戟科(Euphorbiaceae)麻疯树属(JatrophaL.)木本油脂植物,高3~8 m,可提炼桐油[1]。小桐子主要分布于美洲、非洲和亚洲的热带、亚热带地区,它在中国西南地区分布较广,云南、四川、贵州、广东、广西等省资源较丰富,资源量以云南省最多,四川次之[2]。小桐子具有生命力顽强、生长迅速、短期耐寒和耐干旱、种子含油量较高等特性。一般种植3~4年的小桐子年产种子量可达3 000~4 500 kg/hm2,种子含油率在30%~35%之间,正常情况下种子萌发率在70%左右。小桐子油脂的主要成分为油酸、亚油酸、硬脂酸和棕榈酸,通过简单的化学转换和加工提炼就可得到优于目前0号柴油的生物柴油[3]。小桐子提炼的桐油是极其重要的工业用油,可以用来制造油漆和涂料,具有较高的经济价值。
许多研究资料表明,重金属污染已经成为全球环境污染的重要污染物来源,在造成环境污染的众多重金属中,镉的毒性居第二位,仅次于汞[4]。镉具有毒性高、移动性大等特点,被列为水体和土壤的主要污染物,是国际卫生环境委员会和联合国环境规划局(UNEP)拟定的重点环境污染物之一[5]。镉会对生物体产生较大的毒性,在生物体内蓄积的能力也很强。植物体在镉毒害胁迫下不能正常生长发育,而且其生物量呈现出明显下降趋势[6]。在生长发育方面,种子萌发是镉毒害植物最早的阶段,当镉离子浓度达到一定域值时会抑制植物生长,甚至导致机体的死亡[7]。因此,研究镉对植物的毒害机理具有重要的理论和实践意义。
当今世界能源紧缺,利用能源植物发展生物能源是缓解能源危机的途径之一。云南是中国小桐子数量最多,分布最广的省。研究、开发和利用丰富的小桐子资源实现生物能源产业化,是云南省产业发展战略的需求。云南有色金属矿产资源丰富,矿区土壤多种重金属如镉含量偏高,不能生产粮食等经济作物,水土流失严重,在矿区种植小桐子,可为解决矿区水土流失、发展能源产业提供帮助。
1材料和方法
1.1材料与处理
本实验所用小桐子(JatrophacurcasL.)种子购于云南壮大公司。挑选若干健康饱满、大小基本一致的小桐子种子,以1.0%硫酸铜(CuSO4)溶液浸泡消毒30 min后,用去离子水冲洗5次,再置于装有蒸馏水的容器内黑暗中浸泡处理24 h。然后筛选浸泡饱满的种子置于装有蒸馏水的带盖瓷盘中,瓷盘内铺有4层滤纸,置于(26±1) ℃人工培养箱内培养7 d。培养期间每天用蒸馏水补充水分。7 d后,挑选发芽情况一致的种子水培,待幼苗生长至4片叶,挑选生长状况一致的小桐子幼苗进行试验。用海绵将幼苗固定在三角瓶中,用去离子水配置的Cd2+溶液处理材料。依据前期的预备试验结果,处理共设置0(对照)、0.1、0.3和0.5 mol/L等4个Cd2+溶液(以CdCl2配制)浓度水平,每处理10株。每隔一段时间(0、18、36、54和72 h)分别取各处理幼苗叶片迅速置于液氮中冷冻,再于-86 ℃冰箱中保存备用。每处理取3个样品进行测定,重复3次。
1.2测定指标与方法
可溶性蛋白质含量参照考马斯亮蓝法测定[8];根据文献[9]的方法测定丙二醛的含量;本实验5种抗氧化酶提取参照李忠光等[10]修订的方法进行,过氧化物酶(POD)活性的测定按照Ranier等[11]的方法,过氧化氢酶(CAT)活性的测定参照Aebi[12]的方法,超氧化物歧化酶(SOD)活性的测定参照Giannopolitis等[13]的方法,抗坏血酸过氧化物酶(APX)活性的测定按照Nakano等[14]的方法,谷胱甘肽还原酶(GR)活性的测定参照Halliwell等[15]的方法;抗坏血酸(ASA/DHA)和谷胱甘肽(GSH/GSSG)含量的测定参照李忠光等[16]的方法。
1.3数据处理
实验数据以平均值±SE表示,用SPSS 19.0软件进行单因素方差分析,并用Excel 2007作图。
2结果与分析
2.1Cd2+胁迫对小桐子幼苗叶片可溶性蛋白和丙二醛含量的影响
可溶性蛋白有利于维持细胞的代谢,是作为衡量植物生理状况和代谢水平的一项重要指标[17]。由图1,A可知,经相同时间不同浓度Cd2+处理,小桐子幼苗叶片可溶性蛋白含量基本表现出随Cd2+浓度增加而降低的趋势,且明显低于对照组(0.1 mol/L Cd2+处理18 h除外);在相同浓度Cd2+处理下,叶片可溶性蛋白含量随着处理时间的延长基本呈现出逐渐下降的趋势。其中,在实验处理时间达到54~72 h后,3组Cd2+浓度处理叶片可溶性蛋白含量均比对照极显著降低(P<0.01),表明经过长时间Cd2+胁迫处理后,小桐子幼苗细胞已经遭到破坏,无法靠自身修复来对抗逆境胁迫。
MDA是膜脂过氧化产物,常被用来作为衡量脂质过氧化的标准[18]。如图1,B所示,在相同胁迫时间内,小桐子幼苗叶片MDA含量随着Cd2+浓度的增加而比对照快速增加,且浓度越高增加越快、幅度越大,并当Cd2+浓度为0.5 mol/L时已显著高于对照;在相同Cd2+浓度下,叶片中MDA含量随着处理时间的加长而逐渐增加,且高浓度Cd2+胁迫处理极显著高于对照。另外,实验处理36 h后,3个浓度处理组MDA含量均比对照组急剧增加。由此可见,高浓度、长时间的Cd2+胁迫使得小桐子幼苗植物体内MDA含量积累量增加,其膜质过氧化水平升高,造成膜透性增大,膜结构受损伤程度加深。

图1 Cd2+胁迫下小桐子幼苗叶片
2.2Cd2+胁迫对小桐子叶片抗氧化酶活性的影响
正常代谢情况下,植物体内活性氧(ROS)的产生和清除保持一个动态平衡,但是在逆境条件下,植物体内活性氧自由基产生的速度超出了自身抗氧化系统清除活性氧自由基的能力,便会对植物产生伤害。植物体内的活性氧的清除主要由抗氧化酶系统和抗氧化物质来完成的[19]。抗氧化酶类具有高效性和专一性特点,其主要包括 POD、SOD、APX、CAT和GR等[20]。
2.2.1POD活性POD广泛存在于细胞的多个部位,利用愈创木酚为电子供体清除H2O2[21]。如图2,A所示,随着Cd2+胁迫处理时间的延长,各Cd2+浓度处理小桐子叶片POD活性先快速升高,均在处理54 h时达到最大值,并均极显著高于同期对照,随后活性开始出现明显下降的趋势,但仍均显著高于同期对照;当处理时间相同时,小桐子叶片POD活性在整个实验过程中始终表现为0 mol/L(CK)<0.1 mol/L<0.3 mol/L<0.5 mol/L。
2.2.2CAT活性CAT是广泛存在于植物体内的末端氧化酶,也是生物体防御体系的关键酶之一[22]。由图2,B可知,在Cd2+浓度相同情况下,随着Cd2+胁迫处理时间不断加长,小桐子幼苗叶片中CAT活性先是直线上升,后开始逐渐下降;各处理CAT活性均在处理时间为54 h时达到高峰值,0.1、0.3和0.5 mol/L Cd2+处理活性值分别是对照组的2.48、2.37和2.16倍,且差异极显著。在相同处理时间内,各浓度处理叶片的CAT活性始终表现为0.1 mol/L>0.3 mol/L>0.5 mol/L>CK,即胁迫越严重CAT活性越低。
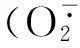
2.2.4APX活性APX是专一性强、通常以抗坏血酸为电子供体的过氧化物酶,主要存在于植物叶绿体和细胞浆中[24]。由图2.D可知,处理时间在0~36 h之内时,小桐子幼苗叶片中APX活性呈直线上升趋势;处理达到36 h后上升速度减慢,并在处理54 h处达到活性值最高峰;随后在处理时间为54~72 h之间时开始逐渐下降。在相同处理时间内,小桐子幼苗叶片中APX活性随着Cd2+胁迫程度加大而增加,整个处理过程中始终表现为0 mol/L(CK)<0.1 mol/L<0.3 mol/L<0.5 mol/L,且其中差异达极显著水平(P<0.01)。
2.2.5GR活性GR一种黄素蛋白氧化还原酶,将氧化型谷胱甘肽GSSG还原成还原型谷胱甘肽GSH,它在重金属胁迫下对活性氧的清除起着极其重要的作用[24]。如图2,E所示,当处理时间相同时,小桐子幼苗叶片中GR活性随着Cd2+胁迫的逐渐增加比对照组逐渐增强,在整个处理过程中基本表现为0 mol/L(CK)<0.1 mol/L<0.3 mol/L<0.5 mol/L,且差异显著;同时,当Cd2+浓度不变情况下,3个浓度处理组的GR活性随着处理时间的不断增加而升高,并均在54 h时达到活性最高值,此时分别为对照组的1.15、1.2及1.43倍,随后开始下降,说明此时小桐子幼苗已经遭受Cd2+的严重毒害,显著抑制了GR的活性。
随着胁迫时间的延长,小桐子幼苗受到的伤害越来越严重,小桐子幼苗质膜过氧化越来越严重,推测小桐子幼苗活性氧积累越来越严重,从而诱导小桐子体内抗氧化酶系统的连锁反应,导致其活性的升高,提高活性氧清除能力,以降低体内活性氧的含量。但在胁迫54 h后,由于小桐子幼苗已经严重受损,因此抗氧化酶系统也出现明显下降。
2.3Cd2+胁迫对小桐子叶片抗坏血酸和谷胱甘肽含量的影响
作为非酶促催化系统的抗坏血酸-谷胱甘肽循环,抗坏血酸和谷胱甘肽是植物体中两个重要的非酶促抗氧化剂,在植物抵抗环境胁迫、清除逆境活性氧积累等方面发挥着重要的作用[24]。
2.3.1抗坏血酸含量在抗氧化系统中,抗坏血酸(包括ASA和DHA两种类型)作为一种小分子抗氧化剂,一方面可以直接清除植物体内因氧化代谢、光合作用及环境胁迫等产生的ROS;另一方面可以通过抗坏血酸-谷胱甘肽循环清除H2O2,从而降低氧化胁迫对植物有机体及其正常代谢的伤害[25]。如图3,A所示,小桐子幼苗叶片中ASA含量随着Cd2+胁迫处理时间的增加而急剧下降,且Cd2+胁迫浓度越大下降幅度越大,其在0.1、0.3及0.5 mol/L Cd2+胁迫处理72 h时分别是对照组的66.0%、55.3%和51.8%,差异均达到显著水平;在试验处理时间相同的情况下,各胁迫处理幼苗叶片ASA含量随着Cd2+浓度增加而不断减少,在整个处理过程中始终表现为CK>0.1 mol/L>0.3 mol/L>0.5 mol/L,且处理间及其与对照间差异显著。同时,图3,B显示,小桐子幼苗叶片中脱氢抗环血酸(DHA)含量随着Cd2+胁迫处理时间的增加而迅速增加,且Cd2+胁迫浓度越大上升幅度越大、速度越快,在0.1、0.3及0.5 mol/L Cd2+胁迫处理72 h时分别是对照组的1.32、1.34和1.35倍,且差异均达到显著水平。随着胁迫时间的不断延长,小桐子体内过氧化现象越来越严重,此时非酶促催化系统的还原型抗坏血酸大量消耗而表现出含量不断降低,同时氧化型抗坏血酸不断生成而表现出含量不断上升。

图3 Cd2+胁迫下小桐子幼苗叶片中ASA
2.3.2谷胱甘肽含量谷胱甘肽是植物体内主要的非蛋白巯基和含量最丰富的低分子量多肽,包括氧化型(GSSG)和还原型(GSH)两种类型,可以直接与活性氧发生反应,同时它还可以作为谷胱甘肽还原酶等抗氧化酶的底物,在清除活性氧的过程中起到极为重要的作用,它与植物的抗逆性有重要关系[26]。如图4,A所示,在胁迫处理时间相同时,小桐子幼苗叶片中GSH含量整体上随Cd2+处理浓度增加而逐渐降低,并在处理间存在显著差异,且Cd2+浓度越高降幅越大;当Cd2+处理浓度相同时,各Cd2+处理叶片中GSH含量随着处理时间的增长均呈现出下降趋势,处理时间越长,下降趋势越明显。同时,各浓度处理小桐子幼苗叶片中GSSG含量随着处理时间的延长而逐渐增加,并在胁迫处理0~18 h内增加缓慢,随后0.5 mol/L Cd2+处理GSSG含量表现出迅速增加趋势,其余处理仍较缓慢增长;处理72 h时,3个处理组GSSG含量分别是对照组的106%、105%和112%;当处理时间相同时,随着Cd2+浓度增加,幼苗叶片中GSSG的含量在整个处理过程中表现为对照<0.3 mol/L<0.1 mol/L<0.5 mol/L(图4,B)。随着胁迫时间的不断延长,小桐子体内过氧化现象越来越严重,此时非酶促催化系统的还原型谷胱甘肽大量消耗而表现出含量不断降低,同时氧化型谷胱甘肽不断生成而表现出含量不断上升。

图4 Cd2+胁迫下小桐子幼苗叶片中GSH和
3讨论
目前关于重金属污染的问题已受到全世界的广泛关注。镉作为一种重金属污染物,以其移动性大、毒性强极易被植物吸收并积累[9]等特点成为最受关注的重金属污染对象之一。大量研究表明,镉诱发植物细胞的氧化胁迫,引起质膜的过氧化,导致膜的损伤[27]。在一定程度上丙二醛的含量可以反映膜结构的受害程度、膜脂过氧化的水平以及植物的自我修复能力。本实验结果表明,随着Cd2+浓度增加和处理时间的加长,小桐子幼苗叶片MDA含量逐渐升高,因而膜脂过氧化程度加剧,导致膜受伤程度加深,从而使质膜透性增大,最终导致植物的抗逆能力减弱。这与张廷婷等[28]关于花生对镉生理响应的研究结果基本相似,他们认为花生对镉胁迫较为敏感,MDA含量增高显著。
有研究者认为,低浓度Cd2+能促进蛋白质的合成,高浓度Cd2+胁迫则会抑制蛋白质的合成[29]。本研究结果表明,小桐子叶片可溶性蛋白含量在0.1 mol/L Cd2+处理12 h时高于对照,可能是因为Cd2+与DNA结合后刺激DNA的活性,从而增加蛋白质的合成量,导致可溶性蛋白含量增加。这种情况的发生可能是植物对重金属毒害的一种解毒机制,以此方法来降低重金属对植物的毒害作用。但是随着Cd2+浓度的增加、处理时间的加长,小桐子叶片蛋白质含量显著降低,也许是植物受到Cd2+严重毒害,破坏了植物细胞组织。本研究的结果与马引利等[30]所报道的结果基本一致。
在活性氧的产生与代谢过程中,抗氧化酶催化不同的反应,终止活性氧的级联反应,并且协同抗氧化剂物质,形成抗氧化系统。酶促抗氧化系统包括SOD、CAT、APX、POD和GR等[31]。已有研究表明,镉胁迫使萝卜幼苗SOD活性先上升后下降,GR活性显著增加[32]。本研究结果表明,随着Cd2+浓度的不断增大,小桐子幼苗叶片中POD、SOD、APX、CAT和GR的活性都不断增强,表明在Cd2+胁迫初期,小桐子幼苗能通过提高抗氧化酶活性来有效清除细胞内多余的活性氧;但随着处理时间的增加,各抗氧化酶在60 h后开始下降,说明在长时间的Cd2+胁迫处理下,植物幼苗叶片受到毒害,致使抗氧化酶活性迅速减弱。 Liu等[33]的研究结果也认为Cd2+胁迫会使龙葵叶片中POD、SOD及APX的活性增强。但也有研究表明,镉胁迫降低了花生的SOD、POD和CAT活性,但是不同的酶其敏感度不同,并表现为CAT>POD>SOD,SOD最不敏感[34]。同时,作为植物体内重要的抗氧化物质ASA和GSH,在清除活性氧自由基方面发挥着重要的作用[35]。逆境环境条件下,植物体内ASA的氧化还原状态反映了植物体细胞内环境的氧化还原状态[36]。本研究结果表明,随着Cd2+浓度的增加和处理时间的加长,小桐子幼苗叶片中ASA和GSH含量快速下降,DHA和GSSG含量显著增加。这与丁继军等[37]报道的土壤重金属胁迫会使石竹幼苗ASA和GSH含量减少的结果基本一致。
综上所述,Cd2+胁迫导致小桐子幼苗叶片中可溶性蛋白含量降低、丙二醛含量增加;5种抗氧化酶活性则先升高然后降低,抗氧化剂ASA和GSH含量降低、DHA和GSSG含量升高。表明在小桐子幼苗遭受Cd2+胁迫的初期,细胞内抗氧化酶活性增强,提高了其抗氧化能力,但随着胁迫时间的延长,其抗氧化酶活性下降,其抗逆能力下降,植株受到氧化胁迫。但Cd2+胁迫对小桐子抗氧化酶基因的表达的影响还有待进一步研究。
参考文献:
[1]SHEN J,PINYOPUSARERK K,BUSH D,etal.AFLP-based molecular characterization of 63 populations ofJatrophacurcasL.grown in provenance trials in China and Vietnam[J].BiomassandBioenergy,2012,37(1): 265-274.
[2]于肇端,王丽娜,曹振兴,等.外源一氧化氮对镉胁迫下黄瓜幼苗生长、活性氧代谢和光合特性的影响[J].云南植物研究,2009,31(6):486-492.
YU ZH D,WANG L N,CAO ZH X,etal.The effects of exogenous nitric oxide on growth,active oxygen metabolism and photosynthetic characteristics in cucumber (Cucumissativus) seedlings under cadmium stress[J].ActaBotanicaYunnanica,2009,31(6):486-492.
[3]DIVAKARA B N,UPADHYAYA H D,WANI S P.Biology and genetic improvement ofJatrophaL.:a review [J].AppliedEnergy,2010,87:732-742.
[4]QIAN W,JUN L.Cloning and characterization of α-β ketoacyl-acyl carrier protein synthase II fromJatrophacurcasL.[J].JournalofPlantPhysiology,2012,169:816-824.
[5]马君贤.重金属镉的环境污染化学[J].当代化工,2007,36(2):192-193.
MA X J The chemistry of the cadmium environment pollution[J].ContemporaryChemicalIndustry,2007,36(2):192-193.
[6]周晓星.柳属植物对重金属镉胁迫的生长和生理响应[D].北京:中国林业科学研究所.
[7]崔玮.张芬琴.金自学.Cd2+处理对两种豆科植物幼苗生长的影响[J].农业环境科学学报.2004,23(1):60-63.
CUI W,ZHANG F Q,JIN Z X.Efects of treatment with Cd2+on seedling growth of two beans[J].JournalofAgro-EnvironmentScience,2004,23(1):60-63.
[8]张志良,翟伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003,3:159-160.
[9]中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,2004:305-306.
[10]李忠光,李江鸿,杜朝昆,等.在单一提取系统中同时测定五种植物抗氧化酶[J].云南师范大学学报,2002,(11):45-48.
LI ZH G,LI J H,DU CH K,etal.Simultaneous measurement of five antioxidant enzyme activities using a single extraction system[J].JournalofYunanNormalUniversity(Natural Sciences Edition),2002,(11):45-48.
[11]RANIER A,CASTAGNA A,BALDAN B,etal.Iron deficiency differently affects peroxidase isoforms in sunflower[J].JournalofExperimentalBotany,2001,354:25-35.
[12]AEBI H.Catalaseinvitro[J].MethodsinEnzymology,1984,105:121-126.
[13]GIANNOPOLITIS C N,RIES S K.Superoxide dismutases I occurrence in higher plants[J].Plantphysiology,1997,4:309-314.
[14]NAKANO Y,ASADA K.Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J].PlantCellPhysiology,1981,22:867-880.
[15]HALLIWELL B,FOYER C H.Properties and physiological of a glutathione reductase purified from spinach leaves by affinity chromatography[J].Planta,1978,139(139):9-17.
[16]李忠光,杜朝昆,龚明.在单一提取系统中同时测定植物ASA/DHA和GSH/GSSG[J].云南师范大学学报(自然科学版),2003,23(3):67-70.
LI ZH G,DU CH K,GONG M.Simultaneous measurement of ASA/DHA and GSH/GSSG using a single extraction system[J].JournalofYunanNormalUniversity(Natural Sciences Edition),2003,23(3):67-70.
[17]田婧.外源亚精胺缓解黄瓜幼苗高温胁迫伤害的生理调节机制和蛋白质组学研究[D].南京:南京农业大学,2012.
[18]中国科学院上海植物生理研究所,上海市植物生理学会.现代植物生理学实验指南[M].北京:科学出版社,2004:305-306.
[19]杨文梅.活性氧对机体的损害作用[J].东吴教学.1990,(1):19-20.
[20]SHIGEOKA S,ISHIKAWA T,TAMOI M.Regulation an function of ascorbate peroxidase isozymes[J].JournalofExperimentalBotany,2002,53:1305-1319.
[21]SHU X,YING L Y,ZHANG Q F.Effort of Pb toxicity on leaf growth,antioxidant enzyme activities,and photosynthesis in cuttings and seedlings ofJatrophacurasL.[J].EnvironmentalScienceandPollutionResearchInternational,2012,19(3):893-902.
[22]樊怀福,郭世荣,段久菊,等.外源NO对Nacl胁迫下黄瓜幼苗生长和谷胱甘肽抗氧化酶系统的影响[J].生态学报,2008,28(6),2 511-2 519.
FAN H F,GUO SH R,DUAN R J,etal.Effects of nitric oxide on the growth and glutathione dependent antioxidative system in cucumber (CucumissativusL.) seedlings under NaCl stress[J].ActaEcologicaSinica,2008,28(6),2 511-2 519.
[23]GIANNOPOLITIS C N,RIESSK.Superoxide dismutases:I.occurrence in higher plants[J].PlantPhysiology,1977,59(2):309-314.
[24]JIANG M Y,ZHANG J H.Effort of abscisic acid on activity oxygen species,antioxidative defence system and oxidative damage in leaves of maize seedlings[J].PlantCellPhysiology,2008,42(11):1 265-1 273.
[25]高俊杰,秦爱国,于贤昌.低温胁迫对嫁接黄瓜叶片抗坏血酸-谷胱甘肽循环的影响[J].园艺学报,2009,36(2):215-220.
GAO J J,QIN A G,YU X CH.Effects of low-temperature stress on the ascorbate-glutahione cycle in the grafted cucumber leaves[J].ActaHorticulturaeSinica,2009,36(2):215-220.
[26]石岩,于振文,位东斌,等.土壤水分胁迫对小麦根系与旗叶衰老的影响[J].西北植物学报,1998,18(2):196-201.
SHI Y,YU ZH W,WEI D B,etal.Effects of soil water stress on the senescence of root system and flag leaves in wheat[J].ActaBotanicaBoreali-OccidentaliaSinica,1998,18(2):196-201.
[27]FORNAZIER R F,FERREIRA R R,VITORIA A P,etal.Effects of cadmium on antioxidant enzyme activities in sugar cane [J].BiologyPlant,2002,45(2):71-97.
[28]张廷婷,闫彩霞,李春娟,等.花生对镉胁迫的生理响应[J].山东农业科学,2013,45(12):48-51,56.
ZHANG Y T,YAN C X,LI CH J,etal.Physiological response of peanut to cadmium stress[J].ShandongAgriculturalSciences,2013,45(12):48-51,56.
[29]马文岳,施国新,徐勤松,等.Cr6+、Cr3+胁迫对黑藻生理生化影响的比较研究[J].广西植物,2004,24(2):161-165.
MA W Y,SHI G X,XU Q S,etal.Comparative studies of toxic effect of Cr6+,Cr3+stress on the physiological and biochemical characteristics ofHydrillaverticillata[J].Guihaia,2004,24(2):161-165.
[30]马引利,佘小平.铝、镉对小麦幼芽生长的影响及其DNA损伤效应研究[J].西北植物学报,2006,26(4):729-735.
MA Y L,SHE X P.Effects and DNA damages of Al3+and Cd2+in wheat seedlings[J].ActaBotanicaBoreali-OccidentaliaSinica,2006,26(4):729-735.
[31]HSIEH T H,LEE J T,YANG P T.Heterology exprssion of theArabidopsisC-repeat/Dehydration response element binding factor 1 gene confers elevated tolerance to chilling and oxidance stresses in transgenic tomato [J].PlantPhysiology,2002,129:1 086-1 094.
[32]汤春芳,刘云国,等.镉胁迫对萝卜幼苗活性氧产生、脂质过氧化和抗氧化酶活性的影响[J].植物生理与分子生物学学报,2004,30(4):469-474.
TANG CH F,LIU Y G,etal.Effects of cadmium stress on active oxygen generation,lipid peroxidation and antioxidant enzyme activities in radish seedlings[J].JournalofPlantPhysiologyandMolecularBiology,2004,30(4):469-474.
[33]LIU J G,ZHANG H G,ZHANG Y X,etal.Silicon attenuates cadmium toxicity inSolanumnigrumL.by reducing cadmium uptake and oxidative stress[J].PlantPhysiologyandBiochemistry,2013,68:1-7.
[34]龚双姣,马陶武,姜业芳,等.胁迫下3种藓类植物抗氧化酶活性变化的比较研究[J].西北植物学报,2008,28(9):1 765-1 771.
GONG SH J,MA T W,JIANG Y W,etal.Antioxidant enzyme activities induced by cadmium stress in three species of mosses[J].ActaBotanicaBoreali-OccidentaliaSinica,2008,28(9):1 765-1 771.
[35]郑小林,陈燕,等.草酸处理对杧果采后果实AsA-GSH循环系统的影响[J].园艺学报,2011,38(9):1 633-1 640.
ZHENG X L,CHEN Y,etal.Effects of oxalic acid treatment on AsA-GSH cycle in mango fruit during storage at room temperature[J].ActaHorticulturaeSinica,2011,38(9):1 633-1 640.
[36]吴锦程,陈建琴,等.外源一氧化氮对低温胁迫下琵琶叶ASA-GSH循环的影响[J].应用生态学报2009,19(6):1 395-1 400.
WU J CH,CHEN J Q,etal.Effects of exogenous NO on ascorbate-glutathione cycle in loquat leaves under low temperature stress[J].ChineseJournalofAppliedEcology,2009,19(6):1 395-1 400.
[37]丁继军,潘远智,刘柿良,等.土壤重金属镉胁迫对石竹幼苗生长的影响及其机理[J].草业学报,2013,12(6):77-85.
DING J J,PAN Y ZH,LIU SH L,etal.Effect and mechanisms of soil cadmium stress onDianthuschinensisseedling growth[J].ActaPrataculturaeSinica,2013,12(6):77-85.
(编辑:裴阿卫)
Effect of Cd2+Stress on Antioxidant System in the Leaves ofJatrophacurcasSeedlings
WANG Xinxin1,DENG Minghua2,GONG Ming3,LIU Ying1,CHEN Kai4,WEN Jinfen1*
(1 Faculty of Architecture and City Planning,Kunming University of Science and Technology,Kunming 650500,China;2 College of Landscape and Horticulture,Yunnan Agricultural University,Kunming 650201,China;3 College of Life Sciences,Yunnan Normal University,Kunming 650500,China;4 Baoshan College,Baoshan,Yunnan 678000,China)
Abstract:Different concentrations of CdCl2 were used to study the influence of cadmium stress on antioxidant system of Jatropha curcas seedlings.Results indicated that:1)the contents of soluble protein decreased,MDA increased.2)The activities of guaiacol peroxidase (POD),catalase (CAT),superoxide dismutase (SOD) and ascorbate specific peroxidase (APX),glutathione reductase (GR) firstly increased and then decreased.3)The antioxidants contents of ascorbic acid (ASA) and glutathione (GSH) decreased;contents of oxidized ascorbic acid (DHA) and oxidized glutathione (GSSG) increased in leaves of J.curcas seedlings under Cd(2+) stress.The results showed that Cd(2+) stress induced the abilities of antioxidative system increase,while the abilities were decreased and the seedlings were harmed after the prolonged treatments.
Key words:Jatropha curcas L.;cadmium stress;antioxidant enzyme;antioxidant substance
中图分类号:Q945.78
文献标志码:A
作者简介:王欣欣(1988-),女,在读硕士研究生,主要从事植物逆境生理方面的研究。E-mail:554740133@qq.com*通信作者:文锦芬,博士,副教授,硕士研究生导师,主要从事植物逆境生理方面的研究。E-mail:wenjg888@163.com
基金项目:国家自然科学基金(31460355,31460059,31260064)
收稿日期:2015-10-25;修改稿收到日期:2016-02-26
文章编号:1000-4025(2016)03-0527-07
doi:10.7606/j.issn.1000-4025.2016.03.0527
