西藏八角莲与桃儿七根及根茎SSH文库的建立
2016-05-06甄梓娟徐元江兰小中
袁 芳,甄梓娟,徐元江,兰小中*
(1 西藏大学 农牧学院,西藏林芝 860000;2 西藏大学 农牧学院-西南大学药用植物联合研发中心,重庆 400715)
西藏八角莲与桃儿七根及根茎SSH文库的建立
袁芳1,2,甄梓娟1,徐元江1,兰小中1,2*
(1 西藏大学 农牧学院,西藏林芝 860000;2 西藏大学 农牧学院-西南大学药用植物联合研发中心,重庆 400715)
摘要:以西藏八角莲(Dysosma tsayuensis Ying)和桃儿七[Sinopodophyllum hexandrum (Royle) Ying]为材料,构建其根及根茎的SSH文库,从中筛选鬼臼类植物属种间与鬼臼毒素生物合成相关的差异表达基因。从文库中随机挑取201个阳性克隆测序后得到183条ESTs。去除载体序列和冗余序列,聚类拼接得到17个西藏八角莲的unique ESTs。经BLAST同源比较和功能查寻,有功能注释的unique ESTs共12个,占70.6%,所编码的蛋白涉及光合作用、合成代谢、转录调控等功能;无功能注释和匹配结果的共5个,占29.4%。该研究成功构建了西藏八角莲和桃儿七SSH文库,为进一步揭示鬼臼毒素生物合成途径及其调控机制奠定了基础。
关键词:西藏八角莲;桃儿七;SSH文库;鬼臼毒素;EST
鬼臼类植物隶属于小檗科(Berberidaceae),包括八角莲属(DysosmaWoodson)、足叶草(鬼臼)属(PodophyllumL.)、桃儿七属(SinopodophyllumYing)和山荷叶属(DiphylleiaMichx.)[1-2]。鬼臼类植物是一类具有显著生物活性,又具有悠久应用历史的药用植物。中国汉代的《神农本草经》中就有鬼臼的记载,在以后的本草典籍中亦多记载,鬼臼类植物主要用于治疗蛇咬伤、痈疖肿毒、跌打、风湿筋骨痛及气管炎等症[3-4]。鬼臼类植物的活性成分主要为木脂素类化合物,其中鬼臼毒素具有高效抗肿瘤活性,已作为合成多种抗癌药物的前体物质[5-10]。
由于过度采挖、生境破坏和植物自身生长缓慢等原因,鬼臼类野生植物资源逐渐枯竭、物种濒危,已难以满足鬼臼毒素生产的需求。人工规范化栽培势在必行,但目前桃儿七、八角莲的栽培刚刚起步,其他来源植物的新资源开发也有待进一步深入[11-13]。此外,虽然化学全合成技术已经有所突破,但复杂的合成过程、极低的合成效率(约为5.0%),使人工全合成鬼臼毒素目前仍难以实现商业化[14-15]。近年来基于生物技术的植物代谢工程,为鬼臼毒素替代资源的开发提供了更多途径,如植物细胞或器官培养、生物转化等,但实现药用植物规范化栽培和植物细胞或器官培养生产鬼臼毒素的前提之一,是必须充分阐明鬼臼毒素的生物合成途径及其调控机制。目前,鬼臼毒素生物合成途径尚不十分清楚,对合成途径中的中间产物、酶、限速步骤等仍知之甚少[16-18]。
就发现与某一性状相关基因的方法来讲,抑制差减杂交(SSH)被认为是一种较为适合的技术,可在转录水平上发现两材料间差异表达的基因。自1996年报道SSH的方法以来,已成功应用在多种植物上,发现了多个与表型性状相关的功能基因,并成功揭示了动植物中一些生命活动的分子机理[19-23]。本研究选用在鬼臼毒素含量上具显著差异的西藏八角莲和桃儿七2种鬼臼类植物作为材料,分别提取根及根茎的mRNA,以西藏八角莲材料的cDNA作检测样品,桃儿七材料的cDNA作参照样品,构建SSH文库,测定和分析文库中的ESTs序列从而发现西藏八角莲根及根茎优势表达的基因。以期为今后鬼臼毒素合成相关基因的确定、从分子水平上探究鬼臼毒素生物合成机理以及功能基因辅助鬼臼类药用植物品种的选育奠定基础。
1材料和方法
1.1植物材料与处理
供试材料西藏八角莲、桃儿七采自西藏林芝市米林县,为避免不同的遗传背景造成的假阳性,将植株移栽至西藏大学农牧学院藏药材种质资源圃栽培。于2014年1月、3月、5月、7月和9月分别从植物材料同一单株上采集根及根茎100 g,置-80 ℃冰箱保存备用。2种植物不同月份采集的根及根茎材料,分别等量混合后用于提取RNA。
1.2SSH文库的构建
西藏八角莲和桃儿七的根及根茎总RNA的提取,采用Fruit-mateTMfor RNA Purification(TaKaRa公司)和RNAiso Plus(TaKaRa公司)进行。总RNA经琼脂糖凝胶电泳和紫外分光光度计检测后进行下一步SSH文库的构建工作。双链cDNA的合成参照SMARTerTMPico PCR cDNA Synthesis Kit(Clontech公司)说明书完成。以西藏八角莲的cDNA为检测样品(tester),桃儿七的cDNA为参照样品(driver),按PCR-SelectTMcDNA Subtraction Kit(Clontech公司)的说明书进行抑制差减杂交。SSH产物用MiniBEST DNA Fragment Purification Kit Ver.4.0(TaKaRa公司)纯化后与pMDTM 18-T Vector连接过夜,转化大肠杆菌DH5α感受态细胞。用含有氨苄青霉素的LB培养基除去未能转化成功的大肠杆菌,采用蓝白斑筛选阳性克隆。挑取白色克隆摇培过夜后,经引物Nested PCR primer 1(5′-TCGAGCGGCCGCCCGGGCAGGT-3′)和Nested PCR primer 2R(5′-AGCGTGGTC- GCGGCCGAGGT-3′)扩增后进一步鉴定阳性克隆。
1.3阳性克隆测序及序列分析
随机选取文库中201个具有唯一扩增条带的阳性克隆,经活化培养后,菌液用MiniBEST Plasmid Purification Kit Ver.4.0(TaKaRa公司)提取质粒DNA,送上海瑞楚生物科技有限公司测序。测序得到的有效EST序列经过Codoncode Aligner 4.0.4软件的处理后,在NCBI(http://www.ncbi.nlm.nih.gov/BLAST)上进行比对分析,并进行功能注释和归类。
2结果与分析
2.1总RNA的质量检测和抑制差减杂交效果分析
本研究中分别提取了西藏八角莲与桃儿七根及根茎的RNA,1%琼脂糖凝胶电泳检测(图1)。结果显示总RNA样品的28S、18S和5S条带清晰,无明显拖尾现象,说明提取的RNA完整性好,几乎无降解。用紫外分光光度计检测RNA的浓度和纯度,结果表明,西藏八角莲和桃儿七RNA样品的OD260/280分别为1.99和2.02,OD260/230分别为2.00和2.01,RNA含量分别为1.90和1.63 μg/μL,说明提取的总RNA无降解,纯度较高,无多糖和蛋白质污染,质量较好,符合建库要求。
由图2可以看出,进行两轮杂交和两轮PCR以后,富集了差异表达的基因,去除了共有的序列,因此弥散的cDNA片段数量减少,条带亮度降低,差减以后cDNA片段整体向下偏移。说明差异表达基因得到了有效地富集和扩增,富集的差异表达片段集中在400~1 000 bp小片段范围内。
2.2SSH文库的PCR鉴定
经过37℃培养箱倒置培养24 h和4 ℃冰箱显色4 h后,LB琼脂平板上出现了明显的蓝色和白色菌落,依据蓝白斑筛选的原理,对在含有氨苄青霉素平板上白色的菌落进行筛选、确认和编号,共发现有1 179个白色菌落和172个蓝色菌落。本实验得到的文库重组率为87.3%,已达到构建文库的重组率标准(80.0%)。
白色克隆经菌落PCR扩增后,扩增产物用1%琼脂糖凝胶电泳检测。电泳图(图3)显示插入片段呈随机分布,长度集中在250~1 500 bp之间,平均大小在750 bp左右。有少数克隆无扩增条带,无扩增条带的克隆将再次采用PCR扩增核实。最后,确定出具有1个扩增条带的克隆共951个,这些克隆所携带的cDNA信息即为本研究所得的cDNA基因文库。

M.DL2000;1.西藏八角莲根及
2.3EST测序分析
随机选取文库中201个阳性克隆进行测序,其中183个测序成功,达到91%。EST序列在Codo-ncode Aligner 4.0.4软件上分析,去除接头序列、载体序列、信号模糊的片段和低质量序列片段,剩余157条有效序列;聚类拼接得到unique ESTs共17个。通过同源比对和功能查询,其中3个没有同源匹配序列;2个为未知功能的假定蛋白,其余12个具有同源匹配序列。
由表1可以看出,有同源匹配序列的unique ESTs参与西藏八角莲植物体内的多种代谢反应,其中次生代谢类序列的比例最大,达到33.3%,其次是能量代谢、转录调控和光合作用类序列(16.7%),参与信号转导、防御反应等过程的序列相对较少(8.3%)。亚麻木脂素脱氢酶、dirigent蛋白、松脂酚-落叶松脂醇还原酶和羧基甲基转移酶是与鬼臼毒素生物合成相关的酶或蛋白。NADH脱氢酶F亚基、ATP合酶β亚基、1,5 -二磷酸核酮糖羧化酶和PSI III型叶绿素a/b结合蛋白是植物光合作用过程中光合电子传递和光合磷酸化所必需的酶复合体的组分。植物初生代谢通过光合作用、柠檬酸循环等途径,为次生代谢提供能量和一些小分子化合物原料。MYB转录因子和WRKY转录因子参与植物的初生和次生代谢反应,在损伤、衰老、发育、代谢物质调节等方面都起到了重要的作用。无功能注释和未匹配的unique ESTs可能属于新的功能基因,需进一步研究了解其可能的功能。所有这些unique ESTs可能与西藏八角莲与桃儿七根及根茎的鬼臼毒素含量存在差异有关。
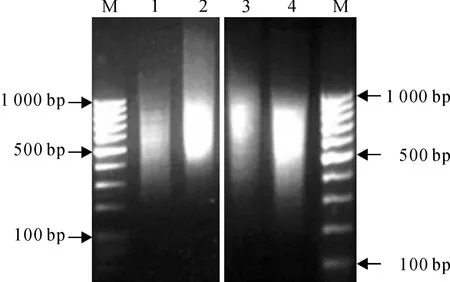
M.DL1000;1.差减样品第一轮PCR;2.未差减样品第一轮PCR;
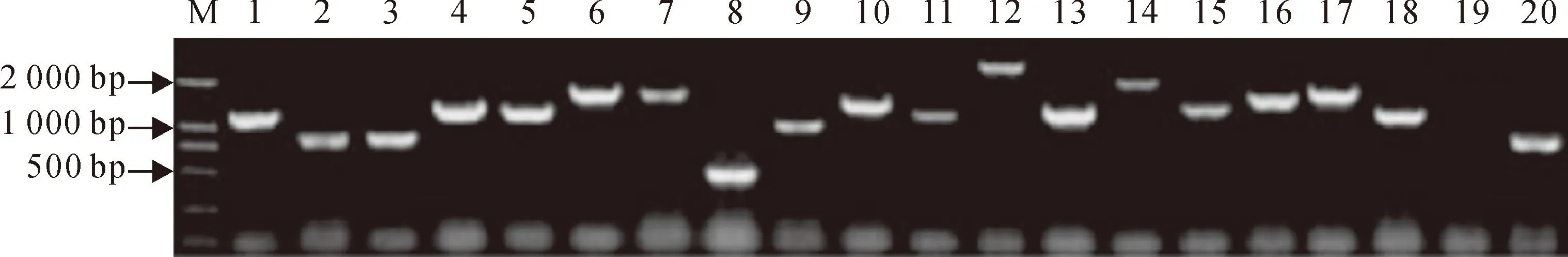
M.DL2000;1~24.SSH文库中随机挑取的白色克隆

EST编号ESTNo.同源基因片段编码的蛋白(生物种)GeneproductofDNAhomology(Species)期望值E-value功能分类Functionalclassification1亚麻木脂素脱氢酶(桃儿七)Secoisolariciresinoldehydrogenase[Sinopodophyllumhexandrum(Royle)Ying]5e-94次生代谢Secondarymetabolism4NADH脱氢酶亚基F基因;叶绿体(山荷叶属)NADHdehydrogenasesubunitFgene;chloroplast(Diphylleiacymosa)8e-147能量代谢Energymetabolism5受体信号蛋白丝氨酸/苏氨酸激酶(拟南芥)Receptorsignallingproteinserine/threoninekinase(Ara-bidopsisthaliana)4e-136信号转导Signaltransduction7MYB转录因子(桃儿七)MYBtranscriptionfactor[Sinopodophyllumhexandrum(Royle)Ying]1e-4转录Transcription8Dirigent蛋白(拟南芥)Dirigentprotein(Arabidopsisthaliana)4e-19次生代谢Secondarymetabolism9松脂酚-落叶松脂醇还原酶(亚麻属)Pinoresinol-lariciresinolreductase(Linumalbum)2e-69次生代谢Secondarymetabolism10羧基甲基转移酶(拟南芥)Carboxylmethyltransferase(Arabidopsisthaliana)3e-27次生代谢Secondarymetabolism111,5-二磷酸核酮糖羧化酶(山荷叶属)Ribulose1,5-bisphosphatecarboxylase(Diphylleiacymosa)8e-85光合作用Photosynthesis13WRKY转录因子(桃儿七)WRKYtranscriptionfactor[Sinopodophyllumhexandrum(Royle)Ying]6e-29转录Transcription14细胞色素P450(桃儿七)CytochromeP450[Sinopodophyllumhexandrum(Royle)Ying]1e-09防御和应激反应Defenseandstressresponse16ATP合酶β亚基基因;叶绿体(山荷叶属)ATPsynthasebetasubunitgene;chloroplast(Diphylleiacymosa)1e-104能量代谢Energymetabolism17PSⅠⅢ型叶绿素a/b结合蛋白(拟南芥)PSⅠtypeⅢchlorophylla/b-bindingprotein(Arabidopsisthaliana)8e-147光合作用Photosynthesis
3讨论
西藏八角莲和桃儿七是国家三级保护植物,在中国西藏东南部均有分布,其中西藏八角莲为西藏特有的八角莲属植物种。其植株内含量极微的具抗肿瘤和抗病毒活性的鬼臼类木脂素,具有很高的药用价值。近年来的研究表明,桃儿七根及根茎的鬼臼毒素含量在4.0~67.0 mg/g[2,4-5,11]。与西藏八角莲相关的此类研究较少,钟国辉等[6]用HPLC法测定西藏八角莲根及根茎的鬼臼毒素含量为0.2 mg/g。两者的鬼臼毒素含量相差较大,这与用HPLC法测定鬼臼毒素含量的溶液浓度和色谱条件相关外,也表明鬼臼毒素合成能力在物种间与物种内的变异、鬼臼毒素代谢对环境因子的响应与调控机制等问题都值得进一步研究揭示。
由于西藏八角莲的自然分布具有显著的地域局限性,对其鬼臼毒素代谢途径的分子生物学研究较桃儿七晚十余年。至2016年1月10日,NCBI网站Genebank数据库中西藏八角莲只有34条DNA序列,而桃儿七的DNA序列达到35 607条。除开环异落叶松脂醇脱氢酶基因(DtSD)[24]和松脂醇合成酶基因(DtPS)[25]被克隆外,其他众多功能基因尚未被克隆。鬼臼毒素来源植物遗传信息的匮乏是限制鬼臼毒素生物合成途径及其调控机制研究的重要原因。构建SSH文库是发现差异表达基因,实施表达序列标签(EST)测序计划,进行功能基因研究较好的方法,目前已成功应用于植物中差异表达基因的研究。
本研究首次成功构建了西藏八角莲与桃儿七根及根茎SSH文库,获得西藏八角莲优势表达EST的克隆951个。随机挑选201个克隆进行序列测定和分析,聚类拼接得到unique ESTs共17个,70.6%的unique ESTs有同源匹配序列,新序列出现的比例为29.4%。所以,本研究的EST数目只占SSH文库EST总数的一小部分。虽然部分测序结果所获得的信息不够全面,但从这些有限的信息里可以大致了解这2种鬼臼类药用植物根及根茎差异表达基因的生物学功能及表达丰度,并为后续开展西藏八角莲代谢途径功能基因的克隆和分析,以及发掘影响鬼臼类药用植物鬼臼毒素合成能力的关键因子奠定了基础。
参考文献:
[1]廖矛川.鬼臼类植物化学系统学和资源利用研究[D].北京:中国协和医科大学中国医学科学院,1995.
[2]陈毓亨.我国鬼臼类植物资源的研究[J].药学学报,1979,14(2):101-106.
CHEN Y H.A study on the resources of Chinese podophyllin plants[J].ActaPharmaceuticaSinica,1979,14(2):101-106.
[3]上海市中医文化馆.神农本草经之鬼臼[DB/OL].[2015-11-25].http://www.pharmnet.com.cn/tcm/knowledge/detail/103222.html.
[4]黄坤,蒋伟,赵纪峰,等.濒危药用植物桃儿七中鬼臼毒素和总木脂素含量测定[J].中国中药杂志,2012,(10):1 360-1 365.
HUANG K,JIANG W,ZHAO J F,etal.Determination of podophyllotoxin and total lignans inSinopodophyllumemodi[J].ChinaJournalofChineseMateriaMedica,2012,(10):1 360-1 365.
[5]李艳玲,徐文华,周国英,等.HPLC法测定青海栽培与野生桃儿七中2种木脂素类的含量[J].天然产物研究与开发,2015,(27):94-98.
LI Y L,XU W H,ZHOU G Y,etal.Determination of two lignans in Qinghai cultivated and wildSinopodophyllumhexandrum(Royle) Ying by HPLC[J].NaturalProductResearchandDevelopment,2015,(27):94-98.
[6]钟国辉,权红,袁雷,等.西藏八角莲不同部位鬼臼毒素的HPLC分析[J].安徽农业科学,2011,39(6):3 262-3 264,3 315.
ZHONG G H,QUAN H,YUAN L,etal.Analysis of podophyllotoxin in different parts ofD.tsayuensis(Hance) M.Cheng by HPLC[J].JournalofAnhuiAgriculturalSciences,2011,39(6):3 262-3 264,3 315.
[7]何军忠,袁家代,李娅,等.八角莲愈伤组织和组培品及野生品中鬼臼毒素的HPLC分析[J].四川师范大学学报(自然科学版),2015,38(4):543-549.
HE J Z,YUAN J D,LI Y,etal.Analysis of podophyllotoxin among callus,tissue culture seedling and wildDysosmaversipellis(Hance) M.Cheng by HPLC[J].JournalofSichuanNormalUniversity(Natural Science),2015,38(4):543-549.
[8]战风娇,杨尚军,白少岩.南方山荷叶根的化学成分研究[J].中成药,2013,35(3):553-556.
ZHAN F J,YANG S J,BAI S Y.Chemical constituents of roots ofDiphylleiasinensisH.L.Li[J].ChineseTraditionalPatentMedicine,2013,35(3):553-556.
[9]中药大辞典.鬼臼[DB/OL].[2015-11-25].http://tool.zyy123.com/cd/1403.html.
[10]陈洁君,赵长琦.鬼臼毒素药源植物及其资源[J].生物学通报,2013,48(5):3-7.
[11]伍奥林,李敏,等.地形因子对桃儿七鬼臼毒素含量的影响与生态适宜度研究[J].中国中药杂志,2015,40(12):2 299-2 303.
WU A L,LI M,etal.Effect of topographical factors on podophyllotoxin content inSinopodophyllumhexandrumand study on ecological suitability[J].ChinaJournalofChineseMateriaMedica,2015,40(12):2 299-2 303.
[12]梁世君.桃儿七人工育苗技术[J].农业科技与信息,2014,434(9):56-57.
[13]杨涛,张军,武小龙,等.野生濒危中藏药桃儿七人工育苗技术[J].中药材,2012,35(12):1 897-1 901.
[14]XU H,LV M,TIAN X.A review on hemisynthesis,biosynthesis,biological activities,mode of action,and structure-activity relationship of podophyllotoxins:2003-2007[J].CurrentMedicinalChemistry,2009,16(3):327.
[15]ANDREWS R C,TEAGUE S J,MEYERS A I.Asymmetric total synthesisof (-) -podophyllotoxin[J].JournaloftheAmericanChemicalSociety,1988,110(23):7 854.
[16]YOUSEFZADI M,SHARIFI M,etal.Podophyllotoxin:current approaches to its biotechnological production and future challenges[J].EngineeringinLifeSciences,2010,10(4):281.
[17]YOU Y.Podophyllotoxin derivatives:current synthetic approaches for new anticancer agents[J].CurrentPharmaceuticalDesign,2005,11(13):1 695.
[18]PAN J,CHEN S,YANG M,etal.An update on lignans:natural products and synthesis[J].NaturalProductReports,2009,26(10):1 251.
[19]DIATCHENKO L,LIU Y F,etal.Suppression subtractive hybridization:A method for generating differentially regulated or tissue-specific cDNA probes and libraries[J].ProceedingsoftheNationalAcademyofSciences,1996,93(12):6 025-6 030.
[20]张重义,范华敏,杨艳会,等.连作地黄cDNA消减文库的构建及分析[J].中国中药杂志,2011,36(3):276-280.
ZHANG Z Y,FAN H M,YANG Y H,etal.Construction and analysis of suppression subtractive cDNA libraries of continuous mono cultureRehmanniaglutinosa[J].ChinaJournalofChineseMateriaMedica,2011,36(3):276-280.
[21]ASHUTOSH K,SHUKLA,AJIT K,etal.Transcriptome analysis inCatharanthusroseusleaves and roots for comparative terpenoid indole alkaloid profiles[J].JournalofExperimentalBotany,2006,57(14):3 921-3 932.
[22]LI D M,etal.Identification of warm day and cool night conditions induced flowering-related genes in aPhalaenopsisorchidhybrid by suppression subtractive hybridization[J].GeneticsandMolecularResearch,2014,13(3):7 037-7 051C.
[23]杨嫦丽,王有国,王祥宁,等.镰刀菌诱导的泸定百合SSH文库构建及抗病相关基因筛选[J].西北植物学报,2014,34(11):2 170-2 175.
YANG C L,WANG Y G,WANG X N,etal.Construction ofLiliumsargentiaeSSH library induced byFusariumoxysporumand screening of the resistance related gene[J].ActaBotanicaBoreali-OccidentaliaSinica,2014,34(11):2 170-2 175.
[24]LAN X Z,REN S X,YANG Y J,etal.Molecular cloning and characterization of the secoisolariciresinol dehydrogenase gene involved in podophyllotoxin biosynthetic pathway from Tibet Dysosma[J].JournalofMedicinalPlantsResearch,2010,4(6):484-489.
[25]LAN X Z,REN S X,YANG Y J,etal.Molecular cloning and characterization of the gene encoding pinoresinol synthase from Tibet Dysosma[J].JournalofMedicinalPlantsResearch,2011,5(18):4 470-4 474.
(编辑:宋亚珍)
Construction of Suppression Subtractive Hybridization Library from the Root and Rhizome ofDysosmatsayuensisYing
andSinopodophyllumhexandrum(Royle) Ying YUAN Fang1,2,ZHEN Zijuan1,XU Yuanjiang1,LAN Xiaozhong1,2*
(1 Agriculture and Animal Husbandry College,Tibet University,Linzhi,Tibet 860000,China;2 TAAHC-SWU Medicinal Plants Joint Research and Development Center,Chongqing 400715,China)
Abstract:In order to screening podophyllotoxin biosynthesis related differentially express genes among podophyllin plant species,we constructed a suppression subtractive hybridization(SSH) library from root and rhizome of Dysosma tsayuensis Ying and Sinopodophyllum hexandrum (Royle) Ying.201 positive clones randomly picked from the SSH library were sequenced,and then 183 qualified sequence ESTs which represent 17 unique ESTs through pre-processing,assembling,clustering,annotation and functional classification from Dysosma tsayuensis were obtained.Among them,12 unique ESTs which annotated with database were further classified into functional groups including photosynthesis ,biosynthetic metabolism,transcriptional regulation,etc,accouted for 70.6%.5 unique ESTs were non-annotated or did not match any entry in the databases,accouted for 29.4%.These results showed that we successfully constructed a SSH library of Dysosma tsayuensis Ying and Sinopodophyllum hexandrum (Royle) Ying,which provided a foundation for revealing the podophyllotoxin biosynthetic pathway and its regulation mechanism.
Key words:Dysosma tsayuensis Ying;Sinopodophyllum hexandrum (Royle) Ying;SSH library;podophyllotoxin;EST
中图分类号:Q785
文献标志码:A
作者简介:袁芳(1983-),硕士,讲师,主要从事药用植物分子生物学研究。E-mail:yfsamantha-06@163.com*通信作者:兰小中,博士,教授,主要从事药用植物资源与开发利用。E-mail:lanxiaozhong@163.com
基金项目:西藏自然基金项目(2014019);西藏特色农牧资源研发协同创新中心建设资助项目(2014-2015)
收稿日期:2015-12-06;修改稿收到日期:2016-02-01
文章编号:1000-4025(2016)03-0467-05
doi:10.7606/j.issn.1000-4025.2016.03.0467
