‘丰水’梨二次开花过程中枝皮和花芽有机营养变化特征
2016-05-06张全军钟必凤李文贵邓家林张绍铃
张全军,钟必凤,李文贵,邓家林,张绍铃
(1 四川省农业科学院园艺研究所/农业部西南地区园艺作物生物学及种质创制重点实验室,成都 610066;2 南京农业大学 梨工程技术研究中心,南京210095)
‘丰水’梨二次开花过程中枝皮和花芽有机营养变化特征
张全军1,钟必凤1,李文贵1,邓家林1,张绍铃2
(1 四川省农业科学院园艺研究所/农业部西南地区园艺作物生物学及种质创制重点实验室,成都 610066;2 南京农业大学 梨工程技术研究中心,南京210095)
摘要:为了探讨砂梨二次开花与枝皮和花芽营养之间的关系,分析了‘丰水’梨去叶后二次开花过程中枝皮和花芽有机营养的变化。结果显示:(1)‘丰水’梨从去叶后第6天出现萌芽现象,在第2周萌芽率迅猛增长,至第42天萌芽率增至91%,满树呈春天开花现象。(2)去叶后初期‘丰水’梨枝皮中可溶性糖含量逐渐增加,并于第12天时达到高峰后迅速下降,且枝皮中可溶性糖和淀粉含量迅速降低的时期与花芽萌芽率快速提高期同步;去叶后枝皮中可溶性蛋白质含量急剧降低,而花芽中游离氨基酸的含量迅速增加。(3) ‘丰水’梨花芽萌芽率与枝皮、花芽中的淀粉和可溶性蛋白质含量呈极显著或显著负相关关系,而与花芽中可溶性糖含量呈显著正相关关系。研究表明,砂梨枝皮、花芽中有机营养物质及其活跃状态是影响其花芽萌动的重要原因。
关键词:砂梨;二次花;营养条件;可溶性糖;淀粉;可溶性蛋白
按照正常的物候期,在中国梨开花期应该是3~5月份,但在南方地区当年形成的花芽在8~10月会出现异常开花的现象[1-2],生产上称为‘二次开花’,该现象在新西兰、南非、巴西被称为‘芽败育’(bud abortion)[3]或‘跳芽’(bud jump)[4-5]。砂梨二次开花会消耗树体大量营养,导致花量少、花质差、着果少、果实小,虽然也能形成少量果实,但随着气温的下降,果实逐渐停止生长,最后脱落,失去经济价值。目前中国南方地区几乎所有低海拔早熟梨产区都存在着秋季二次开花的现象,造成的损失在15%~30%,个别果园在发生较重的年份达70%以上。黄新忠等[6]认为砂梨二次开花与早期落叶紧密相关;钟必凤等[1]的试验结果表明,早期落叶降低了砂梨花芽中ABA的含量,从而使激素比值发生改变,导致生长促进型激素占主导地位,阻止自然休眠的花芽进入休眠或促使进入浅休眠部分花芽解除休眠,所以出现砂梨二次开花现象。赵志国等[7]认为砂梨二次花的发生与该现象发生前2~4个月内树体无机营养元素水平无直接关系。但迄今关于树体有机营养与砂梨二次开花关系的研究未见报道。
果树萌发期间需用的养料与能量主要来自它的贮藏物质的转化和利用;其贮藏物质主要有蛋白质、淀粉和脂肪。在完成花芽分化之后的休眠期内,树体内的营养物质发生转变,如细胞液浓度提高,原生质粘性增强,原生质膜形成拟脂层使透性减弱等[8]。这些生理变化一方面有利于果树防止失水和提高抗逆性,另一方面积极为储备再生长准备物质基础[9]。鉴于砂梨二次开花与早期落叶的紧密关系[10],本研究采取100%去叶处理‘丰水’梨促花措施,探讨其二次开花过程中相关营养生理指标的变化及其与砂梨花芽萌动、二次开花的关系,期望对砂梨二次开花的调控提供重要的借鉴。
1材料和方法
1.1材料和试验地
本试验于2012年在南京农业大学江浦农场进行,试验品种为8年生‘丰水’梨,试验树生长结果正常,长势和立地条件基本一致。根据南京气象局的资料,南京属亚热带季风气候,雨量充沛,年降水1 200 mm,四季分明,年平均温度15.4 ℃,年极端气温最高39.7 ℃,最低-13.1 ℃,年平均降水量1 106 mm。
1.2方法
1.2.1花芽分化时期的观察于6月10日开始,每隔5~10 d取均匀一致的花芽,每次取样均为20个芽。对部分芽样进行剥芽并统计鳞片数,采用半薄切片观察,并制作石蜡切片。
1.2.2试验处理在‘丰水’梨花芽分化完成后,即‘丰水’梨采果后的8月20日,进行全树人工100%去叶处理,以不去叶为对照,5株小区,4次重复。每6 d取1次混合芽和一年生枝皮进行测试分析。
1.2.3测定项目及方法枝条萌芽率从开始处理后的42 d内每隔6 d统计1次;萌芽率=萌芽数/枝条总芽数×100%。参考《植物生理实验指导》[11],淀粉含量采用蒽酮比色法测定;淀粉酶活性的测定 采用3,5-二硝基水杨酸比色法;可溶性糖含量采用蒽酮比色法测定;氨基酸含量采用茚三酮比色法测定;可溶性蛋白质含量采用考马斯亮蓝法测定。
1.3数据处理
实验数据处理采用Excel软件完成,差异性显著性检验采用DPS软件完成。
2结果与分析
2.1‘丰水’梨花芽分化时期和二次开花现象观察
2.1.1花芽分化从6月上旬开始,通过半薄切片和石蜡切片的观察,明确了‘丰水’梨花芽形态分化始于6月中、下旬,生长点于7月上旬开始膨大隆起,接着花序的小花原基开始分化,为花芽分化发端期;7月下旬萼片原基形成开始,为原基分化期;8月上旬花芽分化基本完成(图1)。
2.1.2枝条萌芽率如图2所示,在南京试验点自然气候条件下,‘丰水’梨从去叶后第6天开始出现萌芽现象,并在随后2周内萌芽率迅猛增长,出现二次开花现象;从第24天起萌芽率增速减缓,到第42天萌芽率增至91%,满树呈春天开花现象。同时,相对来讲,未去叶处理的‘丰水’梨在第12天出现零星萌芽,随着秋季气温的延续,到第42天萌芽率仅12.3%,虽然其萌芽率动态变化与去叶处理‘丰水’梨保持相似的趋势,但萌芽率一直保持在相对较低的水平。这可能与未去叶‘丰水’梨保持正常的营养生长状态,抑制了生殖生长有关。

图1 8月15日‘丰水’梨花芽的石蜡切片(×40)
2.2‘丰水’梨二次开花过程中枝皮和花芽生理特征变化
2.2.1枝皮和花芽淀粉含量图3显示,在去叶后的整个萌芽二次开花过程中(0~42 d),‘丰水’梨去叶处理的枝皮淀粉含量呈递减趋势,并且一直低于未去叶对照,淀粉含量最低值仅仅为0.03 mg·g-1;而未处理枝皮淀粉含量在第0~12天呈缓慢递增趋势,在第12天后缓慢减少,最后淀粉含量稳定在0.08 mg·g-1左右。在去叶后24 d,经去叶处理的‘丰水’梨大部分花芽已经呈萌动开花状态,所以花芽中淀粉含量停止取样分析。图3显示,未去叶对照花芽中淀粉含量在第6天后呈缓慢递增趋势,由0.072 mg·g-1增至0.083 mg·g-1,但于0~24 d维持在0.05~0.08 mg·g-1范围内,明显低于同期对照的枝皮淀粉含量(0.09~0.14 mg·g-1);与枝皮中淀粉含量变化相似,去叶处理的花芽淀粉含量也表现出逐渐降低趋势,且始终低于同期的对照处理。可见,去叶处理不同程度地降低了‘丰水’梨枝皮和花芽淀粉含量,且去叶时间越长降幅越大。
2.2.2枝皮淀粉酶活性如图4 所示,在去叶处理后的第6天,去叶处理‘丰水’梨枝皮α-淀粉酶活性先由1.1 mg·g-1·min-1增至1.6 mg·g-1·min-1,而后呈递减状态,于第18天降至1.2 mg·g-1·min-1,而后略微升高,此后持续降低,又在第42天降低至0.6 mg·g-1·min-1;同时,在整个去叶处理后阶段(0~42 d),对照枝皮α-淀粉酶活性低于同期的去叶处理,且一直稳定在0.8~1.1 mg·g-1·min-1之间,起伏波动不大。在‘丰水’梨去叶后的过程中,去叶处理枝皮β-淀粉酶活性大体上均呈现先增加再降低、略呈平稳状态后又升高的趋势(图4);而对照枝皮β-淀粉酶活性在0~42 d内呈递减趋势,由3.4 mg·g-1·min-1缓慢降至2.0 mg·g-1·min-1,变化较平稳。总之,在整个观察过程中,‘丰水’梨枝皮中2种淀粉酶活性在未去叶处理下波动变化的幅度较小,而在去叶处理下变化较明显。
2.2.3枝皮和花芽可溶性糖含量在‘丰水’梨去叶处理后二次开花过程中,去叶处理枝皮中可溶性糖含量呈现先略微增加又持续降低的变化趋势,并在去叶处理第42天降至0.1 mg·g-1,而对照枝皮中可溶性糖含量虽也呈缓慢降低趋势,但一直保持在0.22~0.25 mg·g-1,呈较稳定状态(图5)。同时,在整个去叶后二次开花过程中,对照花芽中可溶性糖含量显著低于同期的去叶处理,且稳定保持在0.10~0.12 mg·g-1之间,而去叶处理可溶性糖含量先在第6天缓慢递增,于第12天增至0.16 mg·g-1,随后保持在平稳状态(图5)。可见,去叶处理引起‘丰水’梨枝皮和花芽中可溶性糖含量明显波动,但枝皮中有降低趋势,而花芽中则呈上升趋势,且枝皮中波动幅度更大。

图2 去叶后‘丰水’梨萌芽率动态变化

图3 去叶后‘丰水’梨枝皮和花芽内淀粉含量变化

图4 去叶处理后‘丰水’梨枝皮α-淀粉酶和
2.2.4枝皮和花芽游离氨基酸含量由图6 可以看出:在去叶后‘丰水’梨萌芽二次开花过程中,去叶处理‘丰水’梨枝皮游离氨基酸含量始终低于同期的对照,且呈现先明显降低后缓慢增加趋势,并处理后第12天降低到最低值(1.60 mg·g-1),于第42天又缓慢增至2.21 mg·g-1。从整体来看(图6),‘丰水’梨花芽中游离氨基酸含量低于枝皮;去叶处理花芽中游离氨基酸含量始终高于同期的对照,其中的对照花芽游离氨基酸含量波动在2.30~2.45 mg·g-1之间,而去叶处理花芽游离氨基酸含量从第6天开始缓慢上升,至第42天达最高值(2.68 mg·g-1)。可见,去叶处理明显降低了‘丰水’梨枝皮氨基酸含量,而花芽中氨基酸含量增高。
2.2.5枝皮和花芽可溶性蛋白含量在去叶后萌芽二次开花整个过程中,去叶处理‘丰水’梨枝皮可溶性蛋白质含量始终低于对照,且差距逐渐增大(图7)。其中,对照枝皮可溶性蛋白质含量呈缓慢递减趋势,并在第18天降至谷值(0.13 mg·g-1),随后缓慢上升,到第42天增至0.19 mg·g-1;而去叶处理枝皮可溶性蛋白质含量一直呈递减趋势,至第42天时减至0.07 mg·g-1。同时,在花芽萌动过程中(图7),无论是对照还是去叶处理,花芽中可溶性蛋白质含量都呈缓慢递减趋势,去叶处理可溶性蛋白质含量递减速度高于同期的对照,其值始终低于对照,到去叶第24天降至最低值(0.075 mg·g-1)。可见,去叶处理明显降低了‘丰水’梨枝皮和花芽中可溶性蛋白含量,且枝皮中下降的幅度更大。
2.3二次开花过程中萌芽率与枝皮、花芽营养相关指标的关系
对‘丰水’梨二次开花过程中萌芽率与枝皮和花芽营养指标进行相关性分析的结果(表1、2)表明,‘丰水’梨萌芽率与枝皮淀粉含量和可溶性蛋白含量呈极显著的负相关关系(r分别为-0.931和-0.934),与可溶性糖含量、β-淀粉酶活性呈显著的负相关关系,与花芽中淀粉、可溶性蛋白含量亦呈显著的负相关,而与花芽中可溶性糖呈正相关关系。说明枝皮营养物质及其活跃状态是影响砂梨花芽萌动的重要原因。

图5 去叶处理后‘丰水’梨枝皮和花芽可溶性糖含量变化

图6 去叶处理后‘丰水’梨枝皮和花芽游离氨基酸含量变化

图7 去叶处理后‘丰水’梨枝皮和花芽中蛋白质含量变化
同时,砂梨枝皮β-淀粉酶活性与淀粉含量、可溶性蛋白和游离氨基酸含量之间的相关系数均达到极显著水平,这些证明在砂梨花芽萌动过程中,枝皮和花芽中贮藏营养成分之间存在的转换关系。

表1 ‘丰水’梨萌芽率与枝皮有机营养物质含量的相关性系数
注:*和**分别表示相关性在0.05和0.01水平达到显著水平;下同。
Note:*and ** stand for the correlation is significant at 0.05 and 0.01 level,respectively;the same as below.
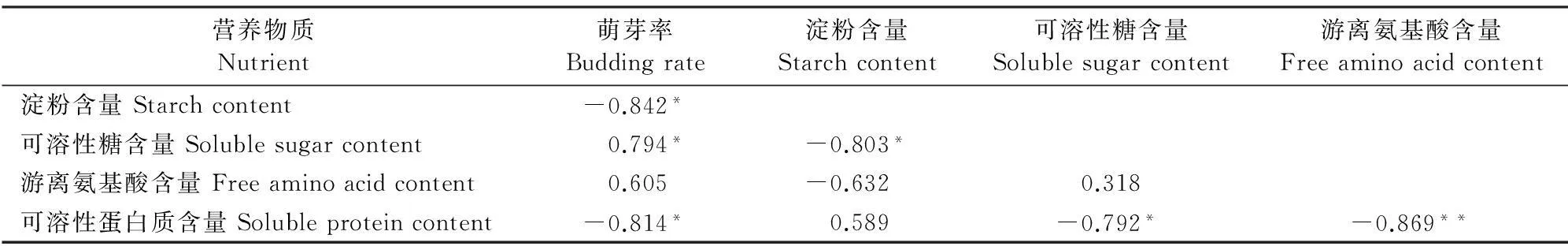
表2 ‘丰水’梨萌芽率与花芽有机营养物质含量的相关性系数
3讨论
3.1二次开花过程中枝条营养运输特征
南方砂梨二次开花的本质就是花芽分化完成后避开休眠或者在浅休眠阶段解除休眠,诱导树体连续生长发育的结果。黄新忠等[6]认为砂梨二次开花与早期落叶紧密相关。日本的林真二[12]指出,多雨的梨产区,叶片生产的同化养分较少,树体内碳水化合物合成减少;此时新梢伸展迅速,对氮和碳水化合物的消耗极多,同时树体吸收的大量氮素难以消化转变为蛋白质,树体内硝态氮或非蛋白质氮暂时增多,导致落叶从而引发二次开花的发生。赵志国等[7]认为砂梨二次花的发生与该现象发生前2~4个月内树体无机营养元素水平无直接关系。关于树体有机营养与砂梨二次开花的研究还未见报道。果树内贮藏的碳水化合物是树体抵御冬季严寒、冬季休眠消耗、萌芽和春季起始生长的物质基础[13]。Amold[14]对苹果根与梢的皮部全蛋白质含量作了测定,发现在低温累积过程中,全蛋白质含量通常呈增加趋势,直到叶芽低温需求量被满足,然后蛋白质开始降解。本试验中去叶处理‘丰水’梨枝皮淀粉和可溶性糖含量均下降,而花芽糖含量却略有升高;说明去叶处理后花芽萌动需要消耗大量的营养物质,去叶促进了枝皮淀粉向花芽可溶性糖的转化,为代谢变化提供物质及能量。随着去叶时间的增加,淀粉酶将不易溶解的大分子淀粉分解为易溶解吸收的小分子可溶性糖,所以,花芽中可溶性糖含量是一个逐渐增加的过程。本试验还发现,枝皮蛋白质含量急剧降低,花芽中游离氨基酸的含量迅速增加也进一步证实了枝皮贮藏营养的供给关系。
本试验还表明,‘丰水’梨萌芽率与枝皮淀粉和可溶性蛋白含量呈极显著的负相关关系,与可溶性糖含量、β-淀粉酶活性呈显著的负相关,与花芽中淀粉和可溶性蛋白含量亦呈显著的负相关,而与中花芽可溶性糖呈正相关关系,表明了可溶性糖和二次花芽萌动的紧密关系;Mason[15]认为除了生长素及激素的平衡能够调节顶花芽的萌动之外,糖的积累也能够促进花芽的萌动并限制BRANCHED1(BRC1)基因的表达,这与本研究的结果一致。但是枝条和花芽的营养状态是如何影响二次花发生的还有待于进一步研究。
3.2去叶对‘丰水’梨二次开花的影响和开花逆转现象
去叶能促使成熟的花芽萌动、开花等[16]。去叶一般在花芽分化完成后自然休眠发生前进行,分为人工去叶和化学去叶,这样可以使树体避开休眠,进入下一生长周期。因此,花芽形成的时间和休眠发展的进程对于去叶而言至关重要[17],去叶时间过早影响花芽分化,过晚则休眠深度过深降低萌芽率,这就需要根据不同树种的花芽分化进程和休眠发展进程的界定选择各自合适的去叶时间。本研究选择在梨果实采收后花芽分化完成以后全部去叶,满足了成花的条件,试验处理达到了预期的花芽萌动和开花的目的。关于去叶使树体避开休眠的原理,研究认为去叶限制了芽内ABA的累积,并且使赤霉素含量升高[16]。
另外,本研究在去叶的过程中还发现,花芽在‘丰水’梨全部去叶后生长过程中可以直接抽出枝条。开花逆转现象[18]的发生,说明分生组织的活动方式不仅可以从营养生长状态转向生殖发育状态,而且可以从生殖发育状态逆转回营养生长状态[19]。本研究同时验证了在砂梨开花逆转过程中伴随着枝皮和花芽有机营养的转换。
参考文献:
[1]钟必凤,张全军,李文贵,等.南方砂梨返花过程中内源激素含量变化及其与秋季返花的关系[J].西北植物学报,2014,34(12):2 453-2 458.
ZHONG B F,ZHANG Q J,LI W G,etal. Variation of endogenous hormone ofPyruspyrifoliaNakai in South China during returning bloom and its relationship with returning bloom[J].ActaBot.Boreal.-Occident.Sin,2014,34(12):2 453-2 458.
[2]LIU G Q,LI W S,ZHENG P H,etal.Transcriptomic analysis of ‘Suli’ pear (Pyruspyrifoliawhite pear group) buds during the dormancy by RNA-Seq [J].BMCGenomics,2012,13:700.
[3]DU PLOOY P,JACOBS G,COOK NC.Quantification of bearing habit on the basis of lateral bud growth of seven pear cultivars grown under conditions of inadequate winter chilling in South Africa [J].Sci.Hortic-Amsterdam,2002,95:185-192.
[4]OH S,KLINAC D.Relationship between incidence of floral bud death and temperature fluctuation during winter in Japanese Pear(Pyruspyrifoliacv.Hosui)under New Zealand climate conditions [J].Kor.J.HortSci.Technol.,2003,44:162-166.
[5]ROBSON R Y,AKEMI K H,etal. "Floral Primordia Necrosis" incidence in mixed buds of Japanese pear (Pyruspyrifolia(Burm.) Nakai var.culta) ‘Housui’ Grown under mild winter conditions and the possible relation with water dynamics [J].J.Japan.SocietyHort.Sci.,2010,79(3):246-257.
[6]黄新忠,陈义挺,雷龑,等.福建梨早期大量落叶诱因与防控策略[J].中国农学通报,2010,26(2):91-95.
HUANG X Z,CHEN Y T,LEI Y,etal.Causes and control strategies of a large number of early falling leaves of pear in Fujian [J].ChineseAgriculturalScienceBulletin,2010,26(2):91-95.
[7]赵志国,黄宁珍,唐凤鸾,等.桂北南方优质早熟梨生理异常现象成因研究[J].广西科学,2011,18(3):298-303.
ZHAO Z G,HUANG N Z,TANG F L,etal.Research on the cause of physiologic abnormity of south-early-ripening-pear in northern Guangxi[J].GuangxiSciences,2011,18(3):298-303.
[8]SIMINOVITCH D.Evidence from increase in ribonucleic acid and protein synthesis in autumn for increase in protoplasm during the frost-hardening of block locust bark cells[J].Can.J.Bot.,1963,41:1 301-1 308.
[9]YOUNG E,CYTOKININ,JOLUBJE.Carbohydrcte concentrations in xylen sap of apple during dormancy and bud bread [J].J.Am.Soc.HortSci,1989,114(2):297-300.
[10]张全军,钟必凤,李文贵,等.南方砂梨返花返青发生特性及其与早期落叶的关系[J].西南农业学报,2013,26(3):1 160-1 163.
ZHANG Q J,ZHONG B F,LI W G,etal.Reflorescence and refoliation characteristics ofPyruspyrifoliaNakai in south China and its relationship with early defoliation[J].SouthwestChinaJ.Agric.Sci,2013,26(3):1 160-1 163.
[11]李合生,植物生理实验指导[M].北京:高等教育出版社,2003
[12]林真二.梨[M]//吴耕民,译.北京:中国农业出版社,1981:34.
[13]KAZUO IWASAKI,ROBERT J.WEAVER.Effects of chilling,calcium cyanamide,and bud scale removal on bud break,rooting,and inhibitor content of buds of‘Zinfandelgrape (VitisviniferaL.)[J].J.Am.Soc.Sci.,1977,102(5):584-587.
[14]AMOLD M A,YOUNG E.Gronth and protein content of apple in response to root and shoot temperature following chilling[J].Hortscience,1990,25(12):1 583-1 588.
[15]MASON M G,ROSS J J,BABST B A,etal.Sugar demand,not auxin,is the initial regulator of apical dominance [J].P.Natl.Acad.Sci.USA,2014,111:6 092-6 097.
[16]王海波,王孝梯,刘凤之,等.落叶果树无休眠栽培的原理与技术体系[J].果树学报,2007,24(2):210-214.
WANG H B,WANG X T,LIU F Z,etal.Principles and technical systems of non-dormancy culture on deciduous fruit tree[J].JournalofFruitScience,2007,24(2):210-214.
[17]彭抒昂,罗充,章文才.钙和钙调素在梨花芽分化中的动态研究[J].武汉植物学研究,1999,17(2):178-180.
PENG S A,LUO C,ZHANG W C.Studies on the changes of calcium and Calmodulin during flower differentiation of pear[J].JournalofWuhanBotanicalResearch,1999,17(2):178-180.
[18]吴存祥,韩天富.植物开花逆转研究进展[J].植物学通报,2002,19(5):523-529.
WU C X,HAN T F.Progress in study of flowering reversion in plants [J].ChineseBulletinofBotany,2002,19(5):523-529.
[19 ]BATTEY N H,LYNDON R F .Reversion of flowering[J].Bot.Rev.,1990,56:162-189.
(编辑:裴阿卫)
Variation of Organic Nutrition on Shoot and Flower Bud of ‘Hosui’Pear (PyruspyrifoliaNakai) during Reflorescence Period
ZHANG Quanjun1,ZHONG Bifeng1,LI Wengui1,DENG Jialin1,ZHANG Shaoling2
(1 Horticultural Research Institute of Sichuan Academy of Agricultural Sciences/Key Laboratory of Horticultural Crops,Biology and Germplasm Enhancement in Southwest Regions,Ministry of Agriculture,Chengdu 610066,China;2 Center of Engineering and Technology Research,Nanjing Agricultural University,Nanjing 210095,China)
Abstract:To elucidate the relationship between reflorescence and nutrition conditions,were investigated the organic nutrition changes in shoots and flower buds from the Pyrus pyrifolia cv.Hosui during reflorescence.The results showed that:(1)along with the bud break at 6 d defoliated by hand,the budding rate was keeping low rising,and flowers opened fully at 42 d.(2)The soluble sugar was increased firstly when the tree defoliated by hand.However,the soluble sugar content was decreased at the 12 d of rapid increasing stage for budding rate.The budding rate increasing stage was consistent with starch contents reducing periods in shoots.In addition,protein content in shoots was decreased to promote rapid increasing for the free amino acid content in the flower buds.(3)The related positive or negative correlation for budding rate and starch content,soluble protein content in flower bud and shoot reached at the 1% significant level,respectively.The positive correlation for budding rate and soluble sugar content in flower bud were 0.794,reached at the 5% significant level.It was indicated the nutrition conditions played important roles in the reflorescence occurrence for Pyrus pyrifolia cv.Hosui.
Key words:Pyrus pyrifolia Nakai;reflorescence;nutrition condition;soluble sugar;starch;soluble protein
中图分类号:Q945.6
文献标志码:A
作者简介:张全军(1975-),男,博士,副研究员,从事果树栽培生理与育种工作。E-mail:124317090@qq.com
基金项目:国家梨产业技术体系建设项目(NYCYTX29-37);四川省应用基础研究项目(15JC0096)
收稿日期:2015-10-29;修改稿收到日期:2016-03-11
文章编号:1000-4025(2016)03-0493-06
doi:10.7606/j.issn.1000-4025.2016.03.0493
