CD59 RNAi逆转录病毒载体转染卵巢癌细胞株A2780的构建
2016-05-06臧金林李红梅方建红周东风
臧金林, 李红梅, 方建红, 周东风
临床与基础研究
CD59 RNAi逆转录病毒载体转染卵巢癌细胞株A2780的构建
臧金林, 李红梅, 方建红, 周东风
目的 获得携带针对人CD59基因 pSUPER retro RNAi 逆转录病毒载体的卵巢癌细胞株A2780。方法 设计能转录产生靶向CD59小发夹RNA (shRNA)转染逆转录病毒载体pSUPER retro neo+gfp质粒,构建pSUPER-siCD59重组质粒,将重组质粒导入卵巢癌细胞株A2780内。鉴定转染后细胞株能形成稳定的扩增。 结果 重组质粒经PCR凝胶电泳、核苷酸测序证实与设计序列一致;重组质粒转染卵巢癌细胞株A2780,可稳定表达绿色荧光蛋白。结论 携带针对人CD59基因 pSUPER retro RNAi 逆转录病毒载体的卵巢癌细胞株A2780的建立为深入进行肿瘤细胞研究奠定了基础。
siRNA; CD59; 逆转录病毒载体; 卵巢癌细胞株A2780
CD59与肿瘤的无序生长及转移密切相关[1-3]。诸多相关研究证实,在肠道、卵巢、前列腺癌、非何杰金淋巴瘤等肿瘤细胞膜表面存在CD59 等一系列的膜补体调节蛋白,使得肿瘤细胞逃脱了自身的免疫监视以及靶向单抗治疗中由补体介导的溶细胞作用[2,4-6]。本研究利用小干扰RNA技术,将携带靶向CD59基因发夹状短链RNA导入卵巢癌细胞株A2780细胞,并观察细胞株的稳定扩增,以为筛选稳定扩增的转染后卵巢癌细胞株A2780细胞,进一步研究补体介导的溶细胞活性、诱导细胞凋亡以及相关的动物实验奠定基础。
1 材料与方法
1.1 材料 人类卵巢癌细胞系A2780、大肠杆菌JM109及兔抗A2780细胞多抗由本实验室保存,pSUPER retro neo+gfp质粒由青岛大学医学院罗兵教授提供,限制性核酸内切酶、T4 DNA连接酶购自Fermentas公司,Lipofectamne 2000转染试剂和总RNA提取试剂盒来自Invitrogen,Access RT-PCR A1250试剂盒来自Promega,靶向CD59的60bp oligos由上海生物工程技术服务有限公司合成。
1.2 靶向CD59基因发夹状短链RNA设计 应用美国Oligo Engine公司提供的siRNA设计软件及参照pSUPER载体说明书构建能有效抑制CD59基因表达的载体,选出1条针对CD59基因小发夹RNA序列作为实验组。如下:5′-GATCCCCTGAGCTAACGTACTACTGCTTCAAGAGAGCAGTAGTACGTTAGCTCATTTTTA-3′,As 5′-AGCTTAAAAATGAGCTAACGTACTACTGCTCTCTTGAAGCAGTAGTAC GTTAGCTCAGGG-3′。带下划线的序列为靶序列,之间为SPACE区,两端为BglⅡ和HindⅢ两个酶切粘性末端,可与 BglⅡ和HindⅢ两个酶切后的 pSUPER retro载体进行连接。
1.3 重组载体的构建 选用美国Oligo Engine公司的有BglⅡ和HindⅢ两个酶切位点的pSUPER retro neo+gfp质粒作为载体,经过寡核苷酸链退火,BglⅡ和HindⅢ两个酶酶切,在T4DNA酶作用下与上述合成的小发夹RNA双链连接,构成重组质粒。在大肠杆菌 JM109里转化。经过抽提纯化。
1.4 重组载体的鉴定 根据pSUPER retro neo+gfp质粒序列设计一对引物,具体如下:pSUPER-a:5′-CCTTTATCCAGCCCTCACTC-3′,pSUPER-s:5′- AGACTGCCTTGGGAAAAG CG-3′。其扩增产物为395 bp,包含嵌入的60 nt寡核苷酸序列和其两侧翼序列。将重组质粒进行PCR鉴定。将阳性质粒送上海生物工程有限公司测序。
1.5 感染卵巢癌A2780细胞 Phoenix A用DMEM常规培养。按说明书利用Lipofectine 2000将pSUPER-siCD59质粒导入Phoenix A细胞。分为正常细胞组、实验组(T)和对照组(C)共3组。24 h后,观察绿色荧光,估算转染效率。分别于转染后72 h 收集病毒上清,在醋酸纤维素膜上过滤。收集培养的A2780细胞,在Polybrene作用下感染A2780细胞。于转染后48 h收获A2780细胞的mRNA和蛋白。采用Access RT-PCR A1250试剂盒进一步检测目的基因mRNA的表达。在SDS聚丙烯酰胺凝胶电泳。在凝胶呈像系统照相,观察CD59mRNA相对表达水平。
2 结果
2.1 重组质粒靶序列鉴定 取3 μl PCR反应产物行琼脂糖凝胶电泳,电泳结果显示,395 bp的条带为阳性质粒,将阳性质粒送上海生物工程有限公司测序,测序结果与设计合成的序列完全吻合(见图1)。

图1 阳性质粒CD59基因小发夹RNA序列测序图
2.2 转染卵巢癌A2780细胞株鉴定以及RT-PCR鉴定结果 卵巢癌细胞CD59蛋白染色为棕黄色,结果显示CD59着色主要定位于细胞膜,也可见于细胞浆(图2A)。稳定转染后,在倒置荧光显微镜下观察各组A2780细胞(图2B为未转染细胞组,图2C为转染pSUPER-siCD59重组载体组;图2D为转染pSUPER-siCD59-C对照组)绿色荧光蛋白的表达,每孔寻找3个具有代表性的视野,各观察100个细胞,计算出各孔载体转染效率均约为70%。RT-PCR方法检测目的基因mRNA的表达。取2 μl RT-PCR产物上样,行凝胶电泳。在凝胶呈像系统照相。电泳结果显示CD59基因在实验组的表达降低,正常细胞组及对照组CD59的mRNA表达量基本一致 (图3)。
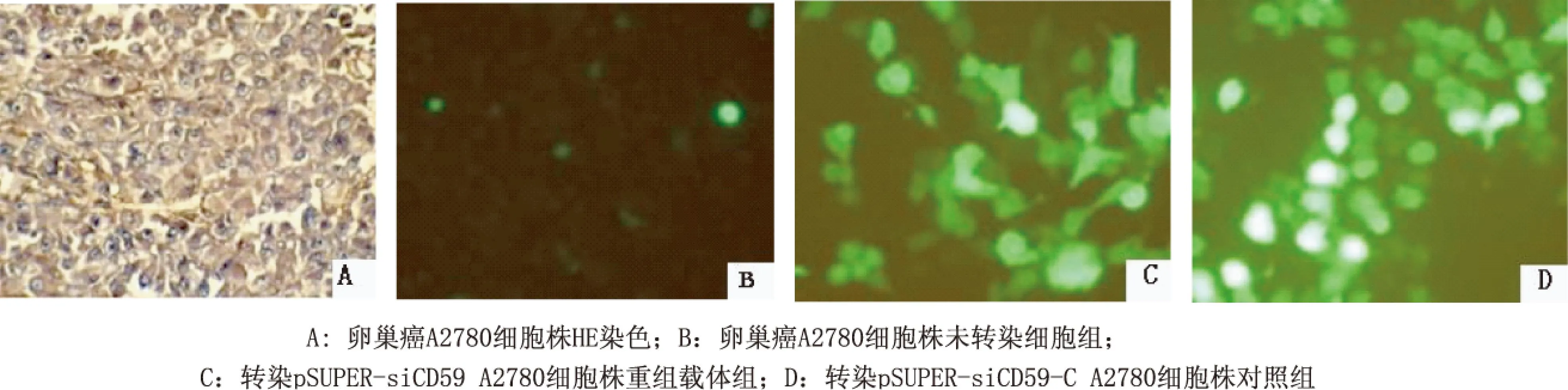
图2 CD59蛋白在卵巢癌组织中高表达及重组载体转染效果图

图3 pSUPER-siCD59 mRNA RT-PCR结果
3 讨论
1998年由SUGITA等[7]人发现并报道了一种以糖基磷酸酯肌醇(GPI)锚定于细胞膜表面的糖蛋白,即CD59,又名保护素,膜反应性溶破抑制剂等。CD59目前已知有两个重要功能[8-9]:(1)通过干扰C8和(或)C9相互作用,C9多聚化或C9插入细胞膜内阻止补体攻膜复合物(MAC)形成。(2)作为CD2天然配体,参与T细胞激活和粘附。国外学者发现在肠道、卵巢及前列腺等多种实体肿瘤细胞中有CD59 分子的高表达,并与肿瘤的失控性生长和恶性转化密切相关[10]。因此使补体调节蛋白不表达,或者失活,无疑是一种肿瘤治疗策略。
RNA干扰(RNAi)是指一种由双链RNA(dsRNA)诱发的基因沉默现象。dsRNA被Dicer 酶加工后产生的RNA或者miRNA可以引导沉默复合物找到与其有互补序列的mRNA并且与其结合,通过Ago酶的作用剪切靶向mRNA,从而达到在转录后水平沉默基因的目的。RNAi不但是一种有效的研究工具,还具有优秀的临床应用前景。所以该技术已被广泛用于探索基因功能和传染性疾病(如HIV)及恶性肿瘤的治疗领域。shRNA介导的基因沉默具有高度特异性[11-14]。目前认为以载体为基础的shRNA表达系统在抑制基因表达方面比siRNA而言具有效率高、费用低、持续时间长等优点。慢病毒载体具有可感染分裂期细胞和非分裂期细胞。目的基因整合至靶细胞基因组后具有可长期稳定目的基因表达、转染效率很高、生物安全性高、免疫反应小等优点,有望成为理想的基因转移载体[15]。我们建立了无辅助病毒的亲嗜性和兼亲嗜性包装细胞Phoenix A做为慢病毒载体,其可识别一种广泛存在于哺乳动物细胞表面的受体。通过脂质体转染将逆转录病毒质粒导入Phoenix A。这种方法较以前大大缩短实验时间,步骤简化,效率高。本实验成功地将pSUPER-siCD59导入包装细胞Phoenix A,为进一步转染A2780细胞奠定了基础。
本研究通过重组质粒pSUPER-siCD59经脂质体法转染包装细胞Phoenix A,再进一步感染A2780细胞。pSUPER带有荧光,经过包装后的重组质粒感染A2780细胞后,在倒置荧光显微镜下可观察到绿色荧光,说明转染成功。RT-PCR方法检测目的基因mRNA的表达,电泳结果显示CD59基因在实验组的表达降低。说明我们设计的小干涉RNA在卵巢癌A2780细胞株增值过程中已经起到作用。成功获得pSUPER-siCD59-A2780细胞株后,在分子水平上为进一步研究补体介导的溶细胞活性、诱导细胞凋亡以及动物实验奠定了基础。
[1] FONSATTI E, ALTOMONTE M, CORAL S, et al. Emerging role of protectin (CD59) in humoral immunotherapy of solid malignancies[J]. Clin Ter, 2000, 151(3):187-193.
[2] FISHEISON Z, DONIN N, ZELL S, et al. Obstacles to cancer immunotherapy: expression of membrane complement regulatory proteins (mCRPs)in tumors[J].Mol Immunol, 2003,40(2/4):109-123.
[3] FONSATTI E, ALTOMONTE M, CORAL S. Emerging role of protein (CD59)in tumor immunotherapy of solid malignancies[J].Clin Ter,2000,151(3):187-193.
[5] DEN C , FONSATTI E , SIGALOTTI L, et al . Recombinant transmembrane CD59(CD59TM) confers complement resistance to GPI anchored protein de-fective melanoma cells[J]. J Cell Physiol, 2002, 190(2):200-206 .
[6] 秦诚, 蔡小勇. 补体调节蛋白 CD46、CD55 及CD59 在肿瘤免疫治疗中的研究进展[J]. 癌症, 2006, 25(11):1450-1453.
[7] KAWAGUCHI Y, TABATA A, NAGAMUNE H, et al. Profiles of ILY, VLY and sm-hpaf interaction with human CD59[J]. Anticancer Res, 2013, 33(7):2901-2904.
[8] 钟丹丹, 高美华, 李伟伟, 等. CD59-linker-CD2 融合基因真核表达系统的构建[J]. 医学研究生学报, 2011, 24(1):15-19.
[9] FERREIRA V P,PANGBURN M K. Factor H mediated cell surface protection from complement is critical for the survival of PNH erythrocytes[J].Blood,2007,110(6):2190-2192.
[10] ZILLER F, MACOR P, BULLA R, et al.Controlling complement resistanc in cancer by using human monoclonal antibodiesthatne utralize complement-Regulatory proteins D55 and CD59[J] .Eur J Immunol,2005, 35(7):2175-2183.
[11] AOKI Y, CIOCA D P, OIDAIR H, et al. RNA interference may be more potent than antisense RNA in human cancer cell lines[J]. Clin Exp Pharmacol Physiol, 2003, 30(1-2):96-102.
[12] WOHIBOLD L, VAN DER KUIP H, MIETHING C, et al. Inhibition of bcr-abl gene expression by small interfering RNA sensitizes for imatinib mesylate(STI571)[J]. Blood, 2003, 102(6): 2236-2239.
[13] BERNSTEIN E, CAUDY A A, HAMMOND S M, et al. Role for a bidentate ribonuclease in the initiation step of RNA interference[J]. Nature,2001, 409(6818):363-366.
[14] AGAMI R. RNAi and related mechanisms and their potential use for therapy[J]. Curr Opin Chem Biol,2002,6(6):829-834.
[15] YANG H, HE S, QUAN Z, et al. Small interfering RNA-mediates caveolin-1 knockout on plasminogen activator inhibitor-1 expression in insulin-stimulated human vascular endothelial cells[J]. Acta Biochim Biophys Sin, 2007, 39(3):224-233.
Construction of ovarian cancer cell line A2780 transfected with human RNAi CD59 retroviral vector
ZANGJinlin1,LIHongmei1,FANGJianhong2,ZHOUDongfeng1.
(1.DepartmentofGeneralSurgery,QingdaoMunicipalHospital,Qingdao266011,China; 2.DepartmentofObstetricsandGynecology,People’sHospitalofChengyangDistrict,Qingdao266000,China)
Corresponding author:FANGJianhong,E-mail:fjhqd@163.com
Objective To construct and screen the stable cell clone of pSUPER gene retro RNAi of CD59 in A2780 by using the expression vector of siRNA. Methods 60 bp oligonucleotide sequences targeting CD59 RNA were cloned into pSUPER retro neo+gfp plasmid, and the recombinant plasmid was transfected into ovarian cancer cell line A2780. The stable cell clones can be formed after the transfection. Results The recombinant vector was identified by PCR and restriction enzyme digestion. The recombinant vector was transfected into ovarian cancer cell line A2780, which can be stably expressed in green fluorescent protein. Conclusions pSUPER retro RNAi of CD59 gene in A2780 was established as a basis for further study on human ovarian cancer.
siRNA; CD59; Retroviral vector; Ovarian cancer cell A2780
266011 山东 青岛,青岛青岛市市立医院 普外科(臧金林,李红梅,周东风);266000 山东 青岛,
青岛市城阳人民医院 妇产科(方建红)
臧金林,男,主治医师,研究方向:结直肠肿瘤基础与临床,E-mail: talkxyz@163.com
方建红,女,副主任医师,研究方向:妇科肿瘤基础研究与临床治疗,E-mail: fjhqd@163.com
10.3969/j.issn.1674-4136.2016.01.010
1674-4136(2016)01-0033-04
2015-11-12][本文编辑:李 庆]
