红花水煎液内服对硬皮病小鼠皮肤RORγt表达的影响
2016-05-05梁娟吕军影胡谋波郑雪嘉
梁娟 吕军影 胡谋波 郑雪嘉
【摘 要】目的:观察红花水煎液对硬皮病小鼠皮肤RORγt表达的影响,探讨红花抗SSc皮肤纤维化的免疫机制。方法:将32只BALB/C小鼠随机分为空白对照组、模型对照组、醋酸泼尼松组、红花组,每组8只。除空白对照组外,其余3组注射博来霉素缓冲液诱导硬皮病模型,同时予生理盐水(空白对照组和模型对照组)、醋酸泼尼松(醋酸泼尼松组)、红花水煎液(红花组)灌胃处理28 d。取小鼠皮肤,苏木素-伊红染色测真皮厚度及评价皮肤炎症程度;免疫组化法、蛋白质印迹法检测皮肤RORγt的蛋白表达水平。结果:各造模组小鼠皮肤均有不同程度增厚,炎性细胞浸润,炎症评分、RORγt蛋白表达均不同程度升高,与空白对照组比较,差异有统计学意义(P < 0.05)。与模型对照组比较,醋酸泼尼松组和红花组小鼠真皮厚度及皮肤炎症评分、RORγt蛋白表达下降,差异均有统计学意义
(P < 0.05)。与醋酸泼尼松组比较,红花组真皮厚度降低,差异有统计学意义(P < 0.05),皮肤炎症评分及RORγt蛋白表达差异无统计学意义(P > 0.05)。结论:红花水煎液能降低硬皮病小鼠皮肤RORγt蛋白表达,抑制免疫炎症反应而具有抗皮肤纤维化的治疗作用。
【关键词】 硬皮病;红花;RORγt;炎症反应;抗皮肤纤维化;小鼠
doi:10.3969/j.issn.2095-4174.2016.04.001
Effect of Saflfower Decoction on the Expression of Skin RORγt in Mice with Scleroderma
LIANG Juan,LYU Jun-ying,HU Mou-bo,ZHENG Xue-jia
【ABSTRACT】 Objective:To observe the effect of safflower decoction on the expression of skin RORγt in mice with scleroderma to explore the immune mechanism of safflower for anti-SSc skin fibrosis.Methods:
32 BALB /C mice were randomly divided into a blank control group,a model control group,a prednisone acetate group,and a safflower group,8 rats in each group.Except for the blank control group,the other 3 groups were given injection of bleomycin damping fluid to establish scleroderma models.Meanwhile,intragastric administration was given to the control and model control groups with normal saline,to the prednisone acetate group with prednisone acetate,and to the safflower group with safflower decoction for 28 days.Hematoxylin-eosin was used to measure the thickness of skin and evaluate the degree of skin inflammation.Immunohistochemistry method and Western blot were used to detect the expression level of skin RORγt.Results:Skin of Models in each group had various degrees of thickening and inflammatory cell infiltration.Inflammation score and RORγt protein expression were increased in various degrees,and the difference was statistically significant (P < 0.05) compared with the blank control group.Compared with the control group,the dermal thickness,skin inflammation score and RORγt protein expression of the prednisone acetate group and the safflower group were decreased,and the difference was statistically significant (P < 0.05).Compared with the prednisone acetate group,the dermal thickness of the safflower group was decreased,the difference being statistically significant (P < 0.05) and the differences of skin inflammation score and RORγt protein expression having no statistical significance (P > 0.05).Conclusion:Safflower decoction can decrease the expression of RORγt protein expression in mice with scleroderma and suppress the immune inflammatory reaction,having a therapeutic effect on skin fibrosis.
【Keywords】 scleroderma;safflower;RORγt;inflammatory reaction;anti skin fibrosis;mice
系统性硬皮病(systemic scleroderma,SSc)是一种以局限性或弥漫性皮肤及内脏器官结缔组织纤维化或硬化,最后发展至萎缩为特点的自身免疫性疾病。研究发现,本病发生、发展过程中出现了免疫系统异常活化的现象,特别是细胞介导的免疫反应在SSc发病中占主要作用[1]。SSc患者中辅助性T细胞17(T helper cell 17,Th17)免疫应答明显增强,对疾病具有至关重要的作用[2]。
维甲酸相关孤儿受体γt(retinoic acid-related orphan receptor γt,RORγt)被认为是Th17细胞的特异性转录调控因子[3],调节白细胞介素-17(interleukin 17,
IL-17)的分泌,影响炎症效应,通过对RORγt的抑制可阻止初始CD4+T细胞向Th17的分化,降低免疫应答反应,这对于SSc的发病机制和新干预措施的研究具有重要意义。红花能够抑制炎症反应[4],
是否可通过降低RORγt的表达而抑制Th17细胞的分化,从而达到抗炎、抗皮肤纤维化作用,目前尚未见报道。因此,本实验通过红花干预治疗硬皮小鼠模型,观察转录因子RORγt在皮肤中的表达变化,探讨红花抗SSc皮肤纤维化的免疫机制。
1 材料与方法
1.1 动物与分组 32只BALB/C小鼠,SPF级,雌性,体质量18~22 g,购于广西医科大学动物实验中心,动物许可证号SCXK桂2014-0002。在清洁级环境中分笼适应性饲养2 d后给予编号,将32只小鼠随机分为空白对照组、模型对照组、醋酸泼尼松组和红花组,每组8只。
1.2 主要药物 注射用盐酸博来霉素(日本化药株式会社,批号140372)溶于高压灭菌的0.01 M
PBS(pH = 7.2)中,制成浓度为200 μg·mL-1
缓冲液,过滤除菌后分装于EP管中,4 ℃保存备用。红花(新疆产,批号140901)采用常规方法加水煎煮并浓缩成浓度为1 g·mL-1的红花水煎液,
4 ℃保存备用。醋酸泼尼松片(广东华南药业集团有限公司,批号141123)溶于蒸馏水中制成浓度为0.45 mg·mL-1混悬液,现配现用。以上药物均购于本院药房。兔抗小鼠RORγt多克隆抗体(Abcam公司)SP检测试剂盒、DAB显色试剂盒(北京中杉)二抗HRP标记山羊抗兔IgG(CST公司)RIPA细胞裂解液、ECL发光试剂盒、BCA蛋白浓度测定试剂盒(碧云天公司)。
1.3 模型制备及给药 按照国内外文献方法[5-6],将所有小鼠背部中央区被毛剃除后皮下注射,除空白对照组注射质量分数为0.01 M PBS(pH = 7.2)
(每次0.1 mL,每日1次,共28 d)外,其余各组均注射质量分数为200 μg·mL-1的注射用盐酸博来霉素缓冲液(每次0.1 mL,每日1次,共28 d)。造模开始即行药物干预治疗,根据小鼠与人折算系数表,计算出小鼠(体质量20 g)使用醋酸泼尼松剂量为0.09 mg·d-1,红花剂量为30 mg·d-1。灌胃前用蒸馏水将备用药物稀释成相应浓度,醋酸泼尼松组给予醋酸泼尼松溶液0.2 mL·d-1灌胃,红花组给予红花水煎液0.2 mL·d-1灌胃,空白对照组和模型对照组给予等容量生理盐水灌胃,共28 d。
2 标本制备及指标检测
2.1 取 材 用药结束后第2天,所有小鼠给予2 mL·kg-1腹腔注射质量分数为10%的水合氯醛麻醉。取背部皮肤,一部分放入质量分数为10%的甲醛溶液固定、脱水、石蜡包埋,连续制取
4 μm切片,用于苏木素-伊红染色(HE染色)和免疫组化;一部分于-80 ℃保存,用于蛋白质印迹法(Western blot)测定。
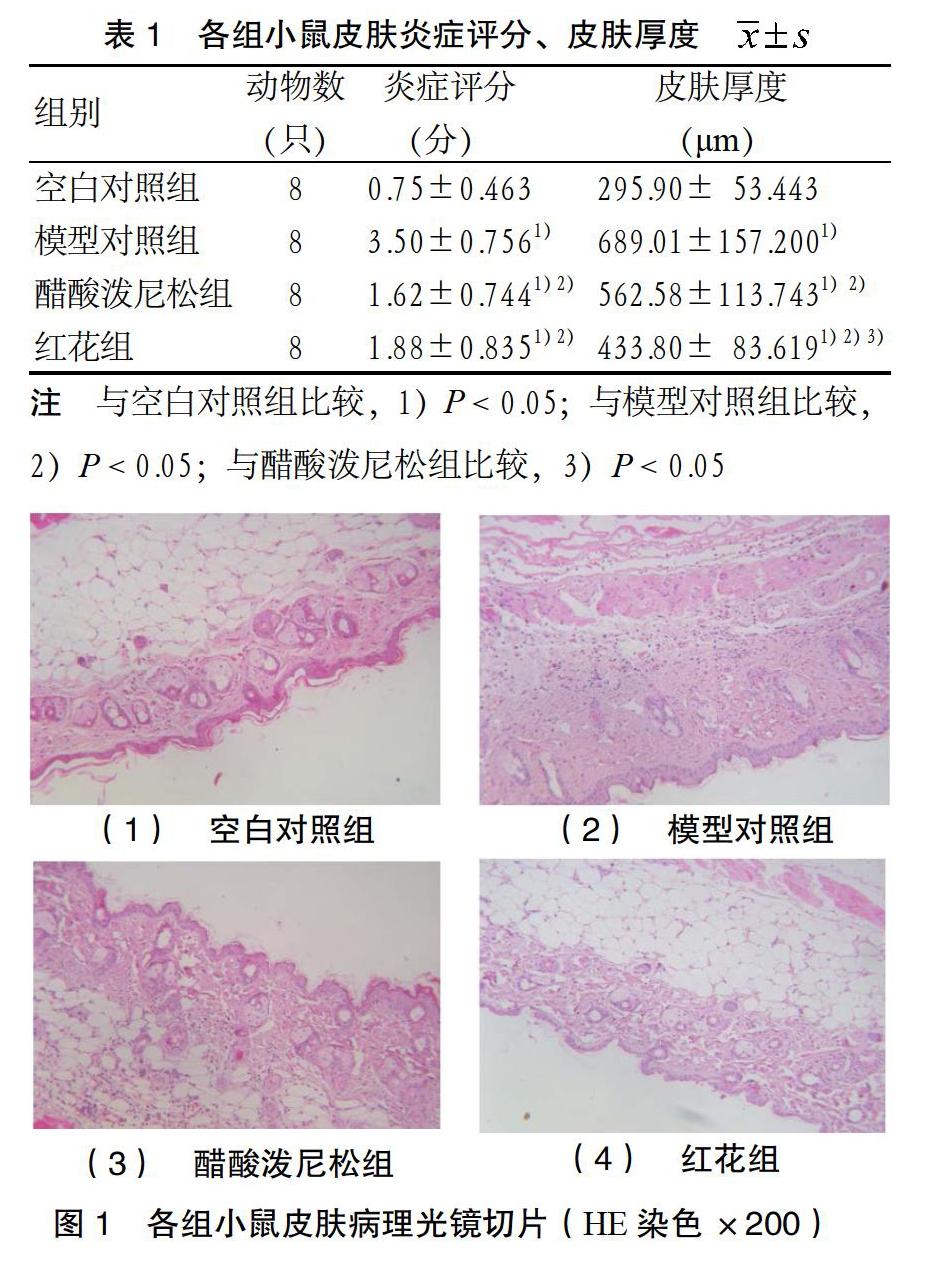
2.2 真皮厚度及炎症评分 石蜡切片行HE染色:二甲苯、酒精脱蜡至水,苏木素浸染,质量分数为1%的盐酸酒精分化,质量分数为0.5%的伊红溶液复染,再脱水透明封片。在光镜下(× 200倍)观察皮肤炎症情况,HE染色结果示胶原纤维、粘液、软骨呈蓝色,肌纤维、纤维素和红细胞染粉红色、胞核染蓝黑色。并采用病理图像分析仪系统软件,每只小鼠的切片随机取5处测定真皮厚度,并按照文献[7]的方法计算皮肤炎症积分:0,没有;1,少许;2,轻度;3,中度;4,重度。
2.3 免疫组化检测 石蜡切片脱蜡至水,PBS洗3 min×3次,置于柠檬酸盐缓冲溶液中进行抗原热修复,PBS洗3 min × 3次,质量分数为3%的过氧化氢溶液室温孵育10 min,PBS洗3 min × 3次,按照SP检测试剂盒操作步骤进行检测,一抗使用兔多克隆抗体RORγt,DAB显色试剂盒进行显色,封片后镜下观察结果,采用Olmpus图像采集系统和Image-pro plus 6.0图像分析软件进行定量分析,每张切片随机选取5个视野(× 400倍),以细胞浆、细胞核内出现棕黄色颗粒为阳性,测定每个视野下染色的平均光密度值(IOD)=总光密度/阳性面积。
2.4 Western blot检测 皮肤组织剪碎后置于匀浆器中,加入RIPA裂解液,4 ℃裂解30 min,高速离心后取上清液按照BCA试剂盒说明书测蛋白浓度,再加入适量蛋白上样缓冲液,沸水浴5 min变性蛋白分装后-20 ℃保存。用质量分数为10%的SDS-PAGE凝胶电泳后转印蛋白到PVDF膜上,质量分数为5%的脱脂牛奶封闭1.5 h,一抗兔多克隆RORγt(1∶300)孵育4 ℃过夜,常温摇床下孵育二抗。以GAPDH(1∶10000)作为内参。ECL压片显影,拍照得到图片后采用Image J软件读取内参、目的蛋白条带的积分灰度值,相对含量即为目的积分灰度值(IOD)/内参积分灰度值(IOD)。
2.5 统计学方法 采用SPSS 16.0软件进行统计分析。计量资料以表示,如果符合正态分布和方差齐性,样本均数的比较采用完全随机设计的方差分析和q检验,否则采用秩和检验。以P < 0.05为差异有统计学意义。
3 结 果
3.1 真皮厚度及炎症评分 小鼠皮肤HE染色显示,空白对照组小鼠皮肤结构完整,无或有少许淋巴细胞等炎性细胞浸润。模型对照组小鼠皮肤明显增厚,胶原纤维明显增生,真皮小血管周围可见大量炎性细胞浸润,皮肤附属器萎缩。醋酸泼尼松组和红花组小鼠皮肤炎症细胞浸润减轻,皮肤厚度降低,纤维增生缓解。与空白对照组比较,各组小鼠真皮厚度增加,炎症评分不同程度升高,差异有统计学意义(P < 0.05);与模型对照组比较,醋酸泼尼松组和红花组真皮厚度及炎症评分降低,差异有统计学意义(P < 0.05);与醋酸泼尼松组比较,红花组真皮厚度降低,差异有统计学意义
(P < 0.05),皮肤炎症评分差异无统计学意义
(P > 0.05)。见表1、图1。
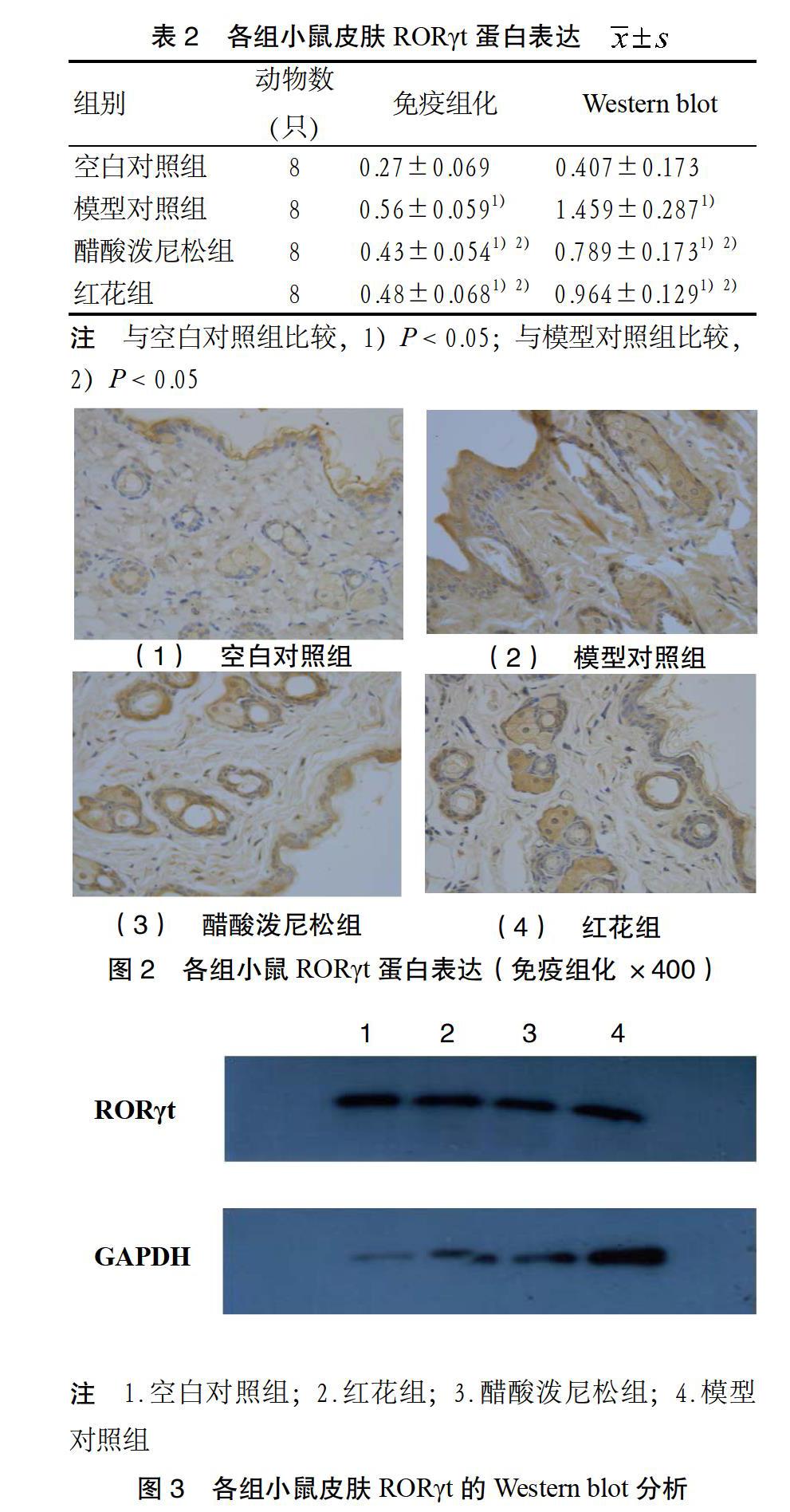
3.2 RORγt表达水平 免疫组化分析显示,各组小鼠皮肤均可见阳性细胞表达,空白对照组呈弱表达。Western blot分析显示,在蛋白相对分子量为58 kD及36 kD处可见特异性阳性条带,分别是RORγt及GAPDH蛋白表达。与空白对照组比较,造模小鼠皮肤RORγt表达水平均增强,差异有统计学意义(P < 0.05);与模型对照组比较,醋酸泼尼松组和红花组小鼠皮肤RORγt表达水平减弱,差异有统计学意义(P < 0.05);
与醋酸泼尼松组比较,红花组小鼠皮肤RORγt表达水平差异无统计学意义(P > 0.05)。见表2、
图2、图3。
4 讨 论
SSc也称硬皮病,是一种以皮肤及内脏器官(包括心、肺、肾和消化道等)进行性增厚致纤维化、硬化为主要表现的自身免疫性疾病。当前研究表明,免疫系统的活化和失调、血管改变、结缔组织代谢异常以及三者之间的相互影响是SSc的主要发病机制,其中免疫反应异常在SSc的发病中起着主导作用,是SSc血管病变和纤维化过程中的一个关键因素[1]。研究发现,T淋巴细胞活化在SSc的发生、发展过程中发挥至关重要的作用。T细胞激活分泌大量的细胞因子、炎症介质等导致内皮细胞损伤,刺激成纤维细胞,进而导致组织器官纤维化及功能障碍[8]。
Th17细胞是近年来新发现的一个T细胞亚群,主要由CD4+T淋巴细胞分泌产生,以分泌IL-17因子为特征而不同于传统的Th1和Th2细胞[9]。Th17细胞能够介导炎性反应、清除细胞外病原菌引起的感染,尤其在人类自身免疫性疾病、炎症反应的发生发展中发挥着重要作用[10]。RORγt、RORα是Th17分化过程中2种转录因子,调节Th17细胞分化[11]。有研究表明,在初始T细胞内转入编码RORγt的逆转录病毒可以诱导其分化Th17细胞,分泌IL-17,相反,在RORγt基因敲除的小鼠中Th17细胞分化严重受损[3],这证明了RORγt在Th17细胞分化中的重要作用,也是目前常用的检测Th17基因转录的标志,可在一定程度上反应Th17细胞的水平和功能活性[12]。本实验造模小鼠皮肤的RORγt蛋白表达及炎症评分均升高,真皮厚度增加,说明Th17细胞参与了SSc免疫炎症反应,通过致炎作用促进皮肤组织纤维化的形成。
近来研究表明,糖皮质激素并不是仅有免疫抑制功能,而是对机体有双向调节作用,主要体现在抗炎与促炎作用以及对于免疫细胞和免疫应答过程中的不同调节作用[13]。醋酸泼尼松是临床上广泛应用于治疗SSc的中效肾上腺皮质激素,可抑制SSc患者病理性免疫反应,对免疫过程中许多环节起抑制作用,特别是在免疫反应的早期阶段发挥治疗作用,但也可抑制患者自身免疫系统功能,产生多种副作用[14]。活血化瘀中药临床上已被广泛应用于SSc等胶原合成异常增多性疾病的治疗,它们单独或联合应用能不同程度改善患者症状。红花是一种传统的活血化瘀中药,具有抗炎、抗氧化、抗血栓等作用[15],有研究表明,SSc患者通过使用红花注射液治疗后,雷诺氏现象明显减轻,皮肤软化,关节活动度增强[16]。对SSc患者皮肤成纤维细胞培养中发现红花能显著促进SSc患者皮肤成纤维细胞的胶原合成[17]。而笔者前期实验研究发现,红花能够降低血管内皮生长因子(VEGF)及Ⅰ型胶原蛋白(COL-Ⅰ)、Ⅲ型胶原蛋白(COL-Ⅲ)的表达,具有抗纤维化作用[18-19]。本实验通过红花干预治疗后小鼠真皮厚度、炎症评分和皮肤组织中的RORγt蛋白均显著下降,表明红花可能通过抑制RORγt的表达,发挥抑制免疫炎症反应作用,而达到抗纤维化作用。与醋酸泼尼松组比较,①红花组小鼠炎症评分和RORγt蛋白表达差异无统计学意义(P > 0.05),说明红花水煎液的免疫抑制、抗炎作用与醋酸泼尼松相似;②红花组小鼠真皮厚度降低显著,可能与红花抗过氧化、清除氧自由基、改善血管微循环等多靶点、多环节作用有关;③本实验醋酸泼尼松组小鼠炎症评分及RORγt表达均略低于红花组,但真皮厚度减低不如红花组,且观察小鼠一般情况发现,醋酸泼尼松组较红花组小鼠活动量减少,毛发粗糙无光泽,再生较少,体质量明显减轻。说明醋酸泼尼松抗炎作用显著,但可引起消化道系统溃疡、免疫系统功能降低等较强毒副作用;传统中药红花毒副作用较小,可增强非特异性免疫功能,对抗醋酸泼尼松免疫抑制作用[20]。
5 参考文献
[1] Greenblatt MB,Aliprantis AO.The immune pathogenesis of scleroderma:context is everything[J].Curr Rheumatol Rep,2013,15(1):297.
[2] Fenoglio D,Battaglia F,Parodi A,et al.Alteration of Th17 and Treg cell subpopulations co-exist in patients affected with systemic sclerosis[J].Clin Immunol,2011,139(3):249-257.
[3] Ivanov II,McKenzie BS,Zhou L,et al.The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+T helper cells[J].Cell,2006,126(6):1121-1133.
[4] 张宇,郑为超.红花黄素抗炎作用机制研究概况[J].江苏中医药,2010,42(9):77-79.
[5] 毛越苹,易娟娟,齐庆,等.博来霉素诱导硬皮病动物模型的建立及免疫学特征检测[J].中国皮肤性病学杂志,2013,27(7):673-676.
[6] Ishikawa H,Takeda K,Okamoto A,et al.Induction of autoimmunity in a bleomycin-induced murine model of experimental systemic sclerosis:an important role for CD4+T cells[J].J Invest Dermatol,2009,129(7):1688-1695.
[7] Yamamoto T,Takagawa S,Katayama I,et al.Effect of superoxide dismutase on bleomycin-induced dermal sclerosis:implications for the treatment of systemic
sclerosis[J].J Invest Dermatol,1999,113(5):843-847.
[8] Chizzolini C.T cells,B cells,and polarized immune response in the pathogenesis of fibrosis and systemic sclerosis[J].Curr Opin Rheumatol,2008,20(6):707-712.
[9] 刘高勤,吴鸿雅,张光波,等.人重组IL-17/His蛋白的原核表达、纯化及其生物学活性[J].细胞与分子免疫学Ⅰ杂志,2007,23(8):715-718.
[10] Afzali B,Lombardi G,Lechler RI,et al.The role of T helper 17 (Th17) and regulatory T cells (Treg) in human organ transplantation and autoimmune
disease[J].Clin Exp Immunol,2007,148(1):32-46.
[11] Iwakura Y,Ishigame H,Saijo S,et al.Functional specialization of interleukin-17 family members[J].Immunity,2011,34(2):149-162.
[12] Zhou L,Littman DR.Transcriptional regulatory networks in Th17 cell differentiation[J].Curr Opin Immunol,2009,21(2):146-152.
[13] 李鑫,杨蕊,臧强,等.糖皮质激素的药理作用机制研究进展[J].国际药学研究杂志,2009,36(1):27-30.
[14] 王伟铭,陈洪宇,刘华锋,等.糖皮质激素常见副作用的中西医结合治疗[J].中华肾病研究电子杂志,2015,4(4):173-176.
[15] 陈梦,赵丕文,孙艳玲,等.红花及其主要成分的药理作用研究进展[J].环球中医药,2012,5(7):556-560.
[16] 唐冬菊,任雷生,王琳,等.活血化瘀类中药制剂治疗系统性硬皮病一例[J].光明中医,2009,24(7):1370-1371.
[17] 朱鹭冰,李明.活血化瘀中药对系统性硬皮病患者皮肤成纤维细胞胶原合成的影响[J].中国中西医结合皮肤性病学杂志,2004,3(4):205-207.
[18] 杨欢欢,吕军影,黄李平,等.红花水煎液内服对硬皮病小鼠皮肤血管内皮生长因子表达的影响[J].风湿病与关节炎,2014,3(4):26-30.
[19] 杨欢欢,吕军影,黄李平,等.红花水煎液内服对硬皮小鼠皮肤COL-Ⅰ、COL-Ⅲ表达的影响[J].时珍国医国药,2014,25(9):2115-2117.
[20] 王晓菲,金鸣.红花抗炎作用机制研究进展[J].山西医药杂志,2007,36(1):51-53.
收稿日期:2015-12-14;修回日期:2016-01-18
