洋河大曲中糖化酶高产霉菌的筛选鉴定及固态发酵条件优化
2016-05-05谢玉球周二干苗秀珍葛向阳江苏洋河股份有限公司江苏宿迁3800江南大学江苏无锡4
谢玉球,时 晓,周二干,苗秀珍,朱 超,葛向阳(.江苏洋河股份有限公司,江苏宿迁3800;.江南大学,江苏无锡4)
洋河大曲中糖化酶高产霉菌的筛选鉴定及固态发酵条件优化
谢玉球1,时晓1,周二干1,苗秀珍1,朱超1,葛向阳2
(1.江苏洋河股份有限公司,江苏宿迁223800;2.江南大学,江苏无锡214122)
摘要:从洋河酒厂中高温大曲中利用透明圈初筛得到5株霉菌,通过固态发酵测定酶活复筛的方法分离出1株产糖化酶且酶活性较高的霉菌菌株(编号YH-01),根据其形态特征和ITS序列分析,该菌株为米曲霉(Aspergillus oryzae)。以该菌株为出发菌株,通过单因素试验和正交试验,优化固态发酵条件,测得糖化酶在料水比5∶3、装料量40 g/500 mL、发酵时间6 d时活力最高。
关键词:微生物;洋河大曲;糖化酶;筛选;鉴定;固态发酵
糖化酶是淀粉糖化酶(Glucoamylase EC.3.2.1.3)的简称,又称为γ-淀粉酶(γ- amylase),因发酵工业中大量用作淀粉糖化剂,习惯上简称糖化酶。糖化酶能从淀粉非还原性末端依次切下一个葡萄糖单位,将淀粉水解成葡萄糖,因此,它广泛运用于酒精、白酒酿造、抗生素、氨基酸、有机酸、甘油、纺织、日化等生物工业中[1]。糖化酶是我国产量最大、应用最广的酶制剂之一。在传统的酿酒工艺中,采用的是自然接种,网罗自然界中的微生物[2],不同微生物最佳生长和产酶条件不同,而制备强化大曲能够有效的提高原料利用率、降低生产成本、缩短生产周期等。本实验利用传统的分离方法和分子生物学相结合,筛选出糖化酶活性强的菌种,为葡萄糖生产或制备强化大曲应用于酿酒生产提供理论依据。
1 材料和方法
1.1材料、试剂与仪器
1.1.1材料
大曲样取自江苏洋河酒厂股份有限公司制曲厂房。
1.1.2主要药品与试剂
硫酸铜(CuSO4·5H2O),次甲基蓝,酒石酸钾钠,氢氧化钠,亚铁氰化钾,0.1 %标准葡萄糖溶液,2 %可溶性淀粉溶液,醋酸-醋酸钠缓冲溶液(pH4.6),1 mol/L氢氧化钠溶液,TE溶液,溶菌酶,SDS,蛋白酶K,饱和酚-氯仿,无水酒精,10×PCR缓冲液,dNTPs,Taq DNA聚合酶。
1.1.3仪器及设备
恒温振荡摇床,恒温培养箱,数字滴定器,离心机,显微镜,恒温振荡水浴锅,PCR扩增仪。
1.1.4培养基
分离培养基:可溶性淀粉0.5 g,硝酸钠3.0 g,磷酸氢二钾1.0 g,氯化钾0.5 g,硫酸镁0.5 g,硫酸亚铁0.01 g,蔗糖30.0 g,曲药浸汁(取曲药200 g,加入1000 mL水煮沸30 min,4层纱布过滤后抽滤至澄清)200 mL,琼脂20.0 g,蒸馏水800 mL,氯霉素105 U,去氧胆酸钠30.0 mg,pH6.0±0.2,0.1 MPa,121℃条件下灭菌20 min,冷却至约50℃,倒6~7块平板/100mL,冷却备用。

图1 初筛后各霉菌PDA平板菌落形态
PDA培养基:200 g土豆,洗净去皮切成小块,加水1000 mL,煮沸20 min,纱布过滤,滤液加水补足1000 mL,再加入20 g葡萄糖和20 g琼脂,在0.1 MPa,121℃条件下灭菌20 min。
固体发酵培养基:麸皮∶水=5∶3,搅拌均匀后取分装到500 mL三角瓶中,每瓶45 g/500 mL,在0.1 MPa,121℃条件下灭菌20 min。
1.2实验方法
1.2.1初筛
称取5 g大曲粉,放入盛有45 mL无菌水并带有玻璃珠的三角瓶中。振摇10 min,振荡混匀后静置,吸取上清液1 mL加入9 mL无菌水试管中,依次进行梯度稀释,制成10-3、10-4、10-5、10-6、10-7的溶液,吸取各梯度溶液0.1 mL于分离培养基上涂布均匀,置于30℃培养箱中正置培养3~4 d。观察分离培养基平板长出的菌落周围有无透明水解圈,取水解圈较大者接种于PDA平板上划线分离至纯种,菌种试管斜面保存。
1.2.2复筛
初筛中选择水解圈较大的5株菌,进行复筛实验,取直径1 cm的各菌株霉菌琼脂小块放入霉菌固体培养基中摇晃均匀后,在30℃下培养3~7 d至长出孢子。
称取相当于5.0 g绝干曲的曲粉,放在250 mL三角瓶中,加水(90-5×水分%)mL,缓冲液10 mL,在30℃水浴中浸泡1 h,每隔15 min搅拌1次。然后用干滤纸过滤,弃去最初5 mL,接收50 mL澄清滤液备用得粗酶提取液后进行糖化酶活力的测定。酶活力越高,生产性能越好。
1.2.3高产糖化酶菌株的鉴定
菌株鉴定采用传统丝状真菌形态学特征与分子生物学相结合的方法,以菌落特征、颜色和显微形态为依据[3-5],同时以研磨法提取的丝状真菌染色体DNA为模板,扩增待鉴定菌株的ITS序列,采用BLAST搜索程序,把实验中得到的实验信息与基因库中的基因序列进行比对,获得同源性分析结果。
1.2.4菌株生产性能的单因素及正交实验优化
分别从料水比、装料量、培养时间等因素通过单因素试验对菌株培养条件进行比较后,确定出产酶条件较好的因素水平,采用L9(34)表进行正交试验设计,以确定目标菌株的最佳培养条件。
2 结果与分析
2.1菌株筛选结果
从洋河大曲中选择水解圈较大的5株霉菌,图1为这5株霉菌在PDA平板上分离纯化后的菌落形态。经过复筛,测得酶活(见图2)。YH-01的糖化酶活性在3~6 d内为最高,在6 d时达到最高,为3683.34 U/g;其次是菌株2-005、0-002、0-001。
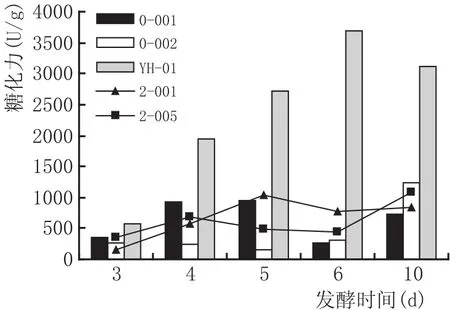
图2 各霉菌糖化酶活力曲线
2.2鉴定
菌株在PDA培养基上生长快,表面初期呈白色、黄色或淡黄绿色,后变黄褐色,菌丝呈黄绿色,显微镜下观察菌丝有隔膜、分生孢子梗下有足细胞。初步鉴定为曲霉。菌落如图1中YH-01,菌丝体、孢子囊见图3、图4。
通过16S rDNA基因序列分析,菌株测序鉴定blast比对结果见图5。YH-01菌株为米曲霉(Aspergillus oryza)。
2.3不同料水比对菌株产糖化酶的影响
选取酶活最高的菌株YH-01作为实验菌株。料水比设置为5∶1、5∶2、5∶3、5∶4、5∶5,按上述料水比加水,料水混合均匀后,按照45 g/500 mL的装料量,分装到500 mL三角瓶中,0.01 MPa灭菌20 min,冷却后接种,接种量按1.2.2方法进行,置于30℃恒温培养箱中培养4 d,取样测定糖化酶活力,结果见表1。

图3 菌丝体

图4 分生孢子梗及孢子囊

图5 YH-01的测序鉴定blast比对结果
由表1可以看出,料水比在5∶3时,YH-01酶活最高,微生物的一切生化反应都离不开水,适宜的水分含量直接影响微生物对营养物质的利用效率,且米曲霉是好氧的微生物,当料水比低于5∶3,麸曲中心含有未被消耗的淀粉颗粒,料水比在5∶3时,麸皮湿润疏松,通气性好,观察发现菌丝均匀密集,曲呈棉絮状,不易摇散,当料水比高于5∶3时,原料发黏,透气性差,不利于菌丝的生长。资料表明[6],营养菌丝是酶的主要来源,气生菌丝或分生孢子梗酶活很低或根本没有,因此,曲霉菌丝生长越旺盛,酶活相对就会高些。因此,采用5∶3的料水比做后续试验。

表1 不同料水比对YH-01产糖化酶的影响
2.4不同装料量对菌株产糖化酶的影响
按照料水比5∶3,分别以35 g/500 mL、45 g/500 mL、55 g/500 mL和65 g/500 mL、75 g/500 mL的装料量制备成固体培养基,接种后,30℃恒温培养4 d,取样测定糖化酶活力,结果见表2。

表2 不同装料量对YH-01产糖化酶的影响
由表2可以看出,随着装料量的增加,目的菌株酶活降低,在没用摇床培养的情况下,装料量越少,越有利于霉菌菌丝的大量生长,但是装料量太少,原料间距大,不利于菌丝的生成,且浪费试验用三角瓶数量,而装料量越多易造成菌丝生长不均匀,浪费原料,因此,选择装料量为45 g/500 mL。
2.5不同发酵时间对菌株产糖化酶的影响
料水比5∶3,装料量45 g/500 mL,灭菌冷却后接种,从第3天开始取样测定糖化酶活力,结果见表3。

表3 不同发酵时间对YH-01产糖化酶的影响
由表3可以看出,从第3天开始,YH-01菌株的糖化酶活力在3~6 d内随着培养时间的增加,糖化酶活力呈直线上升趋势,于第6天达到峰值3683.34 U/g干曲,之后随营养物质消耗和水分减少及孢子数增加,酶活力则快速下降。因此,YH-01菌株麸曲培养6 d酶活性最高。
2.6目标菌株生产性能的正交试验优化
通过单因素发酵产酶试验确定,在料水比5∶3、装料量45 g/500 mL、培养时间为6 d时,米曲霉所产糖化酶活性最大。因此,试验采取不同料水比、装料量、发酵时间3个因素,每一因素选择3个水平,以期获得最佳产酶条件,试验设计和结果见表4、表5。

表4 目标菌株产酶条件正交试验因素水平表
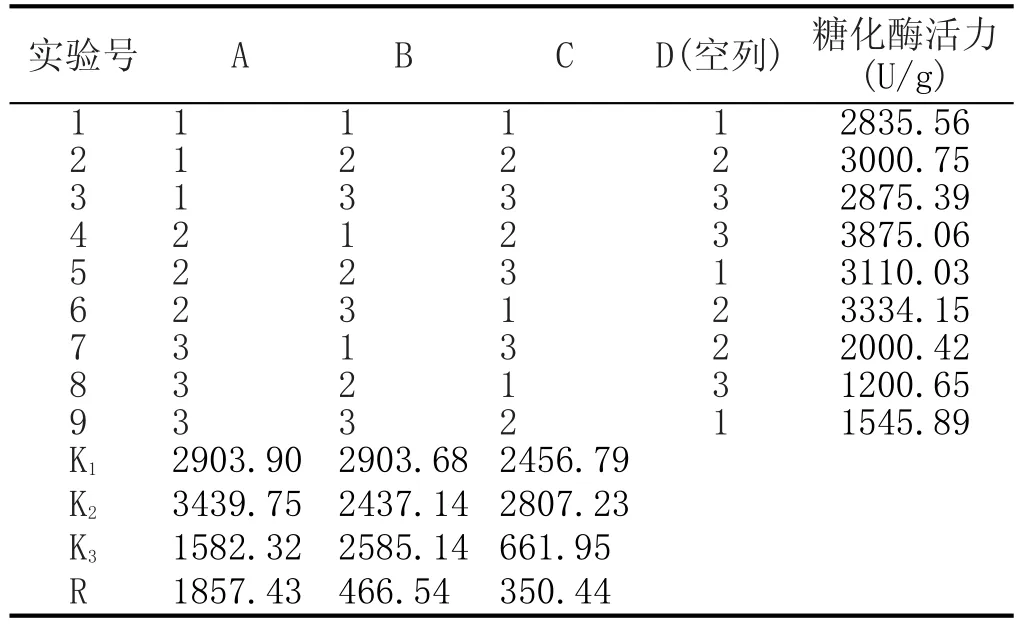
表5 目标菌株产酶条件正交试验结果
由表5可知,YH-01产糖化酶最佳工艺组合为:A2B1C2,即料水比为5∶3,装料量为40 g/500 mL,发酵时间6 d。3个因素对YH-01产糖化酶活强弱顺序依次为A>B>C,即料水比>装料量>发酵时间。
3 结论
从洋河大曲中分离出5株糖化力较高的菌株,其中酶活最高的菌株YH-01经过分子鉴定为米曲霉,以YH-01作为出发菌株进行固态发酵条件优化,该菌株在料水比5∶3、装料量40 g/500 mL、发酵时间6 d时酶活最高,糖化酶活力为3875.06 U/g干曲。将进一步对该菌株酶的形成条件以及其固体发酵产酶的温度、pH值、接种量、翻曲时间等进行条件优化,提高产酶率。因米曲霉具有较为丰富的酶系,拥有较高的蛋白酶活性,后续将研究不同曲料pH值、培养温度、培养时间对米曲霉产蛋白酶活力的影响,最终制备强化大曲应用于酿酒生产。
参考文献:
[1]武金霞,王沛,李晓明.糖化酶的研究进展及趋势[J].自然杂志, 2003,25(3):161-163.
[2]肖冬光.白酒生产技术[M].北京:化学工业出版社,2005.
[3]陈声明,张立钦.微生物学研究技术[M].北京:科学出版社, 2006.
[4]乔宗伟,张文学.浓香型白酒糟醅微生物分离培养基的选择和研究[J].酿酒科技, 2004(6):30-32.
[5] Lane D J, Pace B, Olsen G J, et al. Rapid determination of 16S ribosomal RNAsequences for phylogenetic analyses[J]. Proc Natl Acad Sci,1985,82:6955-6959.
[6]康明官.日本清酒技术[M].北京:轻工业出版社,1986:35-36.
Separation and Identification of Mold Strain with High-Yield of Glucoamylase from Yanghe Daqu and Optimization of Its Solid-State Fermentation Conditions
XIE Yuqiu1, SHI Xiao1, ZHOU Ergan1, MIAO Xiuzhen1, ZHU Chao1and GE Xiangyang2
(1.Yanghe Distillery Co.Ltd., Suqian, Jiangsu 223800; 2.Jiangnan University, Wuxi, Jiangsu 214122,China)
Abstract:Five mold strains were separated from Yanghe Daqu by transparent circle primary screening, then a strain YH-01 with high-yield of glucoamylase was separated from the five strains by measurement of enzyme activity after solid fermentation. According to its morphological characteristics and ITS sequence analysis, YH-01 was Aspergillus oryzae. Through single factor test and orthogonal tests, solid fermentation conditions of YH-01 were optimized and summed up as follows: the ratio of bran and water was 5∶3, loading capacity was 40 g/500 mL, and 6 d fermentation time. Under above conditions, the activity of glucoamylase was the highest.
Key words:microbe; Yanghe Daqu; glucoamylase; screening; identification; solid-state fermentation
通讯作者:苗秀珍,硕士,研究方向:工业微生物育种,E-mail:bilbobaggins@126.com。
作者简介:谢玉球(1957-),男,江苏宿迁人,高级工程师,高级评酒师,国家白酒评委,现任江苏洋河酒厂股份有限公司总工艺师。
收稿日期:2016-02-02
DOI:10.13746/j.njkj.2016040
中图分类号:TS262.3;TQ925.7;Q93-3
文献标识码:A
文章编号:1001-9286(2016)04-0039-04
优先数字出版时间:2016-03-04;地址:http://www.cnki.net/kcms/detail/52.1051.ts.20160304.1442.008.html。
