不同分子类型乳腺癌骨形态发生蛋白6表达的临床意义
2016-05-04王增辉杨艳玲马振玲李宗富李润华
丁 梅,胡 芬,王增辉,杨艳玲,马振玲,李宗富,李润华
063000河北省唐山市协和医院(丁梅,王增辉,杨艳玲,马振玲,李宗富,李润华);华北理工大学生命科学院(胡芬)
·论著·
不同分子类型乳腺癌骨形态发生蛋白6表达的临床意义
丁 梅,胡 芬,王增辉,杨艳玲,马振玲,李宗富,李润华
063000河北省唐山市协和医院(丁梅,王增辉,杨艳玲,马振玲,李宗富,李润华);华北理工大学生命科学院(胡芬)
【摘要】目的 探讨不同分子类型乳腺癌患者骨形态发生蛋白6(BMP-6)表达情况及其与临床病理特征的关系。方法选取2013年1月—2015年3月在唐山市协和医院普外科接受手术并经病理证实的女性乳腺癌患者426例,其中Luminal A型149例,Luminal B型97例,表皮生长因子受体2(Her-2)阳性型72例,Basal-like型108例。采用实时荧光定量反转录PCR检测不同分子类型乳腺癌BMP-6 mRNA表达情况,采用免疫组织化学染色法检测不同分子类型乳腺癌BMP-6表达情况,并对不同分子类型乳腺癌患者临床特征进行比较。结果不同分子类型乳腺癌组织BMP-6 mRNA表达水平比较,差异有统计学意义(P<0.05);其中Basal-like型BMP-6 mRNA表达水平低于Luminal A型(P<0.05)。不同分子类型乳腺癌组织BMP-6 mRNA表达水平均低于癌旁组织(P<0.01)。不同分子类型乳腺癌组织BMP-6表达水平比较,差异有统计学意义(χ2=19.01,P=0.02);其中Luminal A型阴性(-)率低于Basal-like型(χ2=5.17,P=0.002);Luminal A型强阳性(+++)率高于Basal-like型(χ2=8.84,P<0.001)。不同分子类型乳腺癌患者淋巴结转移率比较,差异无统计学意义(P>0.05);不同分子类型乳腺癌患者肿瘤最大径分布、内脏转移率比较,差异均有统计学意义(P<0.01);其中Basal-like型内脏转移率高于Luminal A型(χ2=14.71,P<0.001)。结论BMP-6在不同分子类型乳腺癌中的表达具有差异性,临床或可对不同类型的乳腺癌患者采取不同的BMP-6治疗方案。
【关键词】乳腺肿瘤;骨形态发生蛋白质6;分子分类
丁梅,胡芬,王增辉,等.不同分子类型乳腺癌骨形态发生蛋白6表达的临床意义[J].中国全科医学,2016,19(11):1305-1309.[www.chinagp.net]
Ding M,Hu F,Wang ZH,et al.Clinical significance of the expression of bone morphogenetic proteins 6 in different types of breast cancer[J].Chinese General Practice,2016,19(11):1305-1309.
乳腺癌是女性常见的恶性肿瘤,全世界乳腺癌患者约占癌症患者的10%,且每年新发病例为100万,我国约占15万[1]。乳腺癌的发病率呈逐年上升趋势,有研究显示,2002年新检出的乳腺癌例数为1 151 298例,是1975年的2倍[2]。乳腺癌好发骨转移,Paget通过对753例乳腺癌患者研究发现,骨微环境适合乳腺癌细胞生存、增殖,且乳腺癌细胞分泌的因子也会进一步改造骨微环境,并由此提出“种子-土壤”理论[3]。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)是转化生长因子β(TGF-β)超家族成员,BMPs目前已发现有40多种,其中BMP-6是从鼠胎盘cDNA文库中分离得到[4]。BMP-6是生长、分化多功能调节因子,最初因其能够诱导骨和软骨形成而得名,对骨骼再生修复、胚胎发育均有重要作用,在软骨细胞成熟、角蛋白形成早期、血清素神经元、胎儿平滑肌发育中均有表达[5]。近年研究表明,BMP-6在乳腺癌、唾液腺癌、前列腺癌中均有表达,推测或与肿瘤骨转移相关[6]。BMP-6在乳腺癌中的具体作用机制尚不清楚,本研究拟对不同分子类型乳腺癌患者的BMP-6表达情况进行观察,为乳腺癌辅助治疗和预后评析提供参考。
1资料与方法
1.1临床资料选取2013年1月—2015年3月在唐山市协和医院普外科接受手术并经病理证实的女性乳腺癌患者426例,年龄26~68岁,平均年龄(48.1±9.1)岁;Luminal A型149例,Luminal B型97例,表皮生长因子受体2(Her-2)阳性型72例,Basal-like型108例;初诊肿瘤最大径<2 cm 155例,2~5 cm 162例,>5 cm 109例;内脏转移80例,非内脏转移50例;淋巴结转移140例。
1.2诊断、分型与排除标准
1.2.1乳腺癌诊断根据我国2011年发布的行业标准诊断:乳房肿物质硬、固定、伴有皮肤凹陷或腋窝淋巴结肿大、短期肿物明显增大等为首发症状;或可出现乳头近期回缩、血性溢液,单侧乳头乳晕皮肤湿疹样改变且常规治疗无改善;经影像或病理检查明确诊断[7]。
1.2.2乳腺癌分子分型标准根据2011年第12届St.Gallen国际乳腺癌会议共识的分型标准:Luminal A型为雌激素受体(estrogen receptor,ER)和/或孕激素受体(progestin receptor,PR)阳性、Her-2阴性、细胞核相关抗原(nuclear-associated antigen)Ki-67<14%;Luminal B型为ER和/或PR阳性、Her-2阴性或阳性、Ki-67≥15%;Her-2阳性型为ER和/或PR阴性、Her-2阳性;Basal-like型(三阴性型)为ER、PR、Her-2阴性[2]。
1.2.3转移分类内脏转移指发生在肺、肝、脑等脏器的远处转移;非内脏转移指发生在骨、软组织为主的转移。
1.2.4排除标准男性乳腺癌、其他恶性肿瘤或相关肿瘤病史;术前进行放、化疗,内分泌等全身治疗者;病理、病历、免疫组织化学资料不全者。
1.3检测方法
1.3.1实时荧光定量反转录PCR(RT-qPCR)患者于乳腺癌术中取癌组织和癌旁组织各一份,于术后30 min内投入液氮进行保存。两部分组织的RT-qPCR操作步骤相同,以癌组织的操作步骤为例,具体如下。取0.1 g人乳腺癌组织置于研钵中(研钵需预冷),加入液氮研磨至粉末状,加入Trizol试剂(Inveitrogen公司)1 ml,混匀,转入Eppendorf管(1.5 ml,无核酸酶)中,放置5 min,室温离心(12 000×g)5 min,将上清液转移至新的Eppendorf管(1.5 ml,无核酸酶)中;加入1/5体积氯仿,振荡混匀15 s,放置15 min,室温离心(12 000×g,4 ℃)15 min;吸取上层水相,置于另一离心管,加入2/3体积异丙醇混匀,放置5~10 min,室温离心(12 000×g,4 ℃)10 min;弃上清液,加入1 ml 75%乙醇,振荡离心管,悬浮沉淀,离心(8 000×g,4 ℃)5 min;弃上清液,室温沉淀RNA 5~10 min,加去离子水溶解RNA样品,冻存(-20 ℃)。在0.2 ml Eppendorf管中加入RNA 2 μl、5×RT Buffer 4 μl、dNTP Mix 2 μl、RNase Inhibitor 0.5 μl、Oligo 2 μl、AMV反转录酶2 μl、ddH2O 7.5 μl,室温下放置10 min,42 ℃孵育1 h,75 ℃加热15 min,-20 ℃冻存。采用Gene Runner软件设计引物,引物由上海生工公司合成并提供。BMP-6(308 bp)上游引物5′-CAACAGAGTCGTAATCGCTCTACC-3′(+1 323~+1 346)、下游引物5′-TTAGTGGCATCCACAAGCTCT-3′(+1 701~+1 721);GAPDH基因(982 bp)上游引物5′-TGAAGGTCGGTGTGAACGGAT-3′、下游引物5′-CATGTAGGCCATGAGGTCCACCAC-3′。在0.2 ml反应管中加入cDNA 2 μl、dNTP Mixture 2 μl、F-primer 1 μl、R-primer 1 μl、10×PCR Buffer 2.5 μl、ROX 0.5 μl、EverGreen 0.5 μl、Taq DNA聚合酶0.4 μl、ddH2O 15.1 μl,94 ℃预变性3 min,按以下步骤进行循环,94 ℃变性30 s,64 ℃延伸60 s,40个循环。每个样本做3次检验,取平均值。
1.3.2免疫组织化学染色检测SP9100免疫组织化学试剂盒、DAB显色试剂盒、鼠抗人Actin及辣根酶标记山羊抗小鼠IgG(H+L)抗体均采购于北京天根公司,鼠抗人BMP-6单克隆抗体购于Abcam公司。将冻存的标本置于100 ml甲醛溶液(中性)中固定,石蜡包埋,连续切片(厚度2 μm)呈蜡带,分隔蜡带并放于45 ℃温水上,用粘片剂防止蜡片滑脱,调整蜡片位置将其置于载玻片中央,抗原修复,封闭,应用SP法染色,DAB发色,苏木素复染,脱水,透明,封固,以PBS代替一抗作阴性对照。应用显微镜观察,由两位经验丰富的病理科医师进行观察,镜下棕黄色颗粒即为BMP-6表达,以同一显微镜倍数(×40)观察全片,确定肿瘤浸润边缘,选择10个高倍(×400)视野,每个视野计数100个肿瘤细胞,分析不同视野下染色细胞百分数(阳性细胞占计数同类细胞比例)及染色程度。以阳性染色<10%为阴性(-);阳性染色10%~30%为弱阳性(+);阳性染色31%~50%为阳性(++);阳性染色>50%为强阳性(+++)。
1.3.3ER、PR、Her-2、Ki-67判断采用免疫组织化学方法对乳腺癌肿瘤标本进行石蜡包埋、切片、染色、洗涤,在切片上加入ER、PR、Her-2、Ki-67一抗、二抗,以DAB显色,选择10个显微镜(×400)视野,每个视野计数100个肿瘤细胞,分析不同视野下染色细胞百分数。ER、PR染色细胞数<10%或细胞核无染色为阴性(-)、染色细胞数>10%为阳性(+);Ki-67染色细胞数<30%或细胞核无染色为阴性(-)、染色细胞数≥30%为阳性(+);运用DAKOHercep Test系统判定Her-2阴性表达为(-或+)、阳性为(++或+++)。

2结果
2.1不同分子类型乳腺癌BMP-6mRNA表达水平比较不同分子类型乳腺癌癌旁组织BMP-6mRNA表达水平比较,差异无统计学意义(P>0.05);不同分子类型乳腺癌组织BMP-6mRNA表达水平比较,差异有统计学意义(P<0.05);其中Basal-like型BMP-6mRNA低于LuminalA型,差异有统计学意义(P<0.05)。不同分子类型乳腺癌组织BMP-6mRNA表达水平均低于癌旁组织,差异有统计学意义(P<0.01,见表1)。

Table 1Comparison of the mRNA expression of BMP-6 among different molecule types of breast cancer tissues
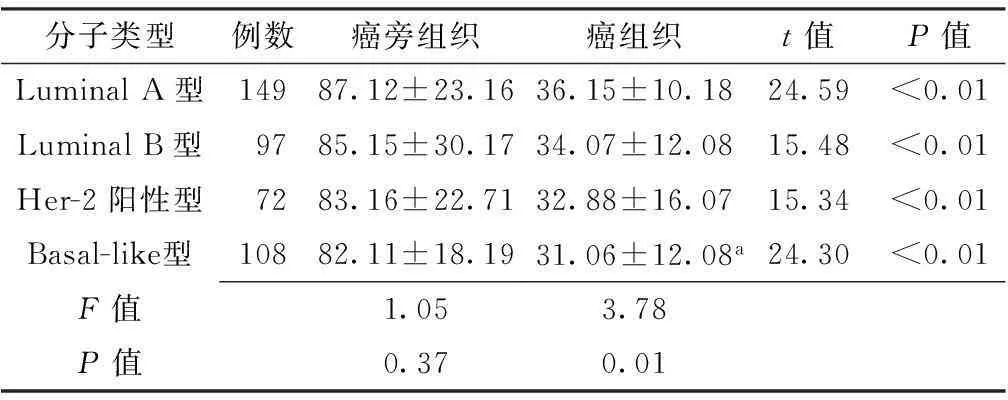
分子类型例数癌旁组织癌组织t值P值LuminalA型14987.12±23.1636.15±10.1824.59<0.01LuminalB型9785.15±30.1734.07±12.0815.48<0.01Her-2阳性型7283.16±22.7132.88±16.0715.34<0.01Basal-like型10882.11±18.1931.06±12.08a24.30<0.01F值1.053.78P值0.370.01
注:与Luminal A型比较,aP<0.05;Her-2=表皮生长因子受体2
2.2不同分子类型乳腺癌组织BMP-6表达水平比较不同分子类型乳腺癌组织BMP-6表达水平比较,差异有统计学意义(χ2=19.01,P=0.02)。其中Luminal A型阴性(-)率低于Basal-like型,差异有统计学意义(χ2=5.17,P=0.002);Luminal A强阳性(+++)率高于Basal-like型,差异有统计学意义(χ2=8.84,P<0.001,见表2)。
表2不同分子类型乳腺癌组织BMP-6表达水平比较〔n(%)〕
Table 2Comparison of the protein expression of BMP-6 among different molecule types of breast cancer tissues

分子类型例数阴性(-)弱阳性(+)阳性(++)强阳性(+++)LuminalA型14912(8.1)60(40.3)50(33.6)27(18.0)LuminalB型9710(10.3)47(48.5)26(26.8)14(14.4)Her-2阳性型729(12.5)36(50.0)17(23.6)10(13.9)Basal-like型10822(20.4)50(46.3)30(27.8)6(5.5)
2.3不同分子类型乳腺癌患者临床特征比较不同分子类型乳腺癌患者淋巴结转移率比较,差异无统计学意义(P>0.05);不同分子类型乳腺癌患者肿瘤最大径分布、内脏转移率比较,差异均有统计学意义(P<0.01);其中Basal-like型内脏转移率高于Luminal A型,差异有统计学意义(χ2=14.71,P<0.001,见表3)。
3讨论
表3不同分子类型乳腺癌患者临床特征比较〔n(%)〕
Table 3Comparison of clinical features among different molecule types of breast cancer patients

临床特征例数LuminalA型(n=149)LuminalB型(n=97)Her-2阳性型(n=72)Basal-like型(n=108)χ2值P值肿瘤最大径(cm)69.69<0.01 <215571(47.7)38(39.2)25(34.7)21(19.5) 2~516258(38.9)45(46.4)31(43.1)28(25.9) >510920(13.4)14(14.4)16(22.2)59(54.6)淋巴结转移3.510.32 阳性14043(28.9)31(32.0)23(31.9)43(39.8) 阴性286106(71.1)66(68.0)49(68.1)65(60.2)转移13.96<0.01 内脏转移8016(10.7)19(19.6)13(18.1)32(29.6) 非内脏转移5023(15.4)11(11.3)9(12.5)7(6.5)
乳腺癌是北美女性癌症的第二大死因,在我国该病的发病率也逐年增高。乳腺细胞系的增殖受甾体类固醇激素和肽类激素调节,雌激素能够促进乳腺上皮细胞增生,有研究指出乳腺上皮细胞在致癌因素作用下会发生恶变,而雌激素-受体系统又会使恶变细胞获得优势生长,形成肿瘤[8]。雌激素会直接对含ER的乳腺癌细胞产生作用,对癌细胞基因的表达、表型特征进行调节,刺激癌细胞的自分泌,使生长因子水平得到提升,而降低抑制生长因子水平[9]。BMP-6是一种能够在乳腺癌中表达的生长因子,有学者认为BMP-6是雌激素的选择性调节基因,其表达量受雌激素剂量的控制[10],亦有研究发现BMP-6与表皮生长因子具有相关性[11]。鉴于此,本研究对不同分子类型乳腺癌BMP-6水平进行观察,结果显示,RT-qPCR法测定的BMP-6 mRNA在癌旁组织及癌组织中均存在,但癌组织中BMP-6 mRNA表达水平明显低于癌旁组织;且Luminal A型BMP-6 mRNA表达水平高于Basal-like型;免疫组织化学染色的结果与BMP-6 mRNA表达水平一致,Luminal A型BMP-6强阳性(+++)率高于Basal-like型。有研究指出,Luminal A型ER基因表达程度最高,且GATA3、XBP1、CKB、CK18等与雌激素相关的基因水平均有上调;Basal-like型ER、PR均为阴性[12]。由此可见,BMP-6水平与ER、PR可能存在一定的反馈性调节关系,有报道指出1/2ERE区域的BMP-6启动因子BMP6 PLR的启动子活性在10-7mol/L时,雌激素作用能够提高60%[13]。张磊[14]通过对ER阳性的乳腺癌细胞MCF-7的72 h后半定量反转录PCR测定BMP-6表达水平发现,与ER阴性的乳腺癌细胞MDA-MB-231比较,MCF-7中的BMP-6表达水平明显高于MDA-MB-231(P<0.05);且雌激素10-5、10-7mol/L能够促进BMP-6的表达(P<0.05)。结合本次观察推测,BMP-6与雌激素的剂量相关性不仅体现于雌激素相关细胞,亦表现于乳腺癌的分子类型中,但本次观察的Luminal B型、Her-2阳性型的BMP-6表达水平并未表现出组间差异,是否可以参考BMP-6区分乳腺癌类型尚有待大样本观察。
Ki-67表达水平是公认的肿瘤细胞增殖特异性指标,其表达指数和病理分级是评价肿瘤细胞分化程度、增殖活性的有效指标。刘更等[15]在对80例乳腺癌组织的BMP-6表达水平进行观察时发现,Ki-67表达≤20%的BMP-6阴性率为55.17%,>20%且<40%的BMP-6阴性率为34.78%,≥40%的BMP-6阴性率为46.43%,两组间有明显差异(P<0.05),BMP-6随着Ki-67的增高而减弱。推测BMP-6可能广泛参与了肿瘤细胞增殖、侵袭、转移的调控过程。有研究显示BMP-6、BMP-7通过抑制P38信号途径、类固醇硫酸酯的表达来抑制雌激素介导乳腺癌细胞的增殖[16],也有学者认为BMP-6可以通过δEF1调控E-cadherin,进而实现对上皮间质转移的抑制[17]。
从各型的病理特征看,Luminal A型肿瘤体积较小、转移率较低且多非内脏转移;Basal-like型肿瘤体积较大、内脏转移率较高,预后较差。章乐虹等[18]对693例确诊的乳腺癌患者进行不同分子亚型的转移观察,Luminal A型的无病生存率、总生存率均高,非内脏转移率为7.84%,复发风险曲线低平,预后最好;Basal-like型无病生存率、总生存率均低,内脏转移率为19.54%,复发风险曲线峰值高,出现时间早,本研究结果与之一致,均说明Luminal A型的预后较好。影响乳腺癌预后的因素较多,如化疗方案、患者对治疗的敏感性、术式、患者自身因素等,本次观察的患者均在本院进行规范的手术及化疗,各分型间的病理、预后特征主要是不同类型间的差异形成。国外有报道显示,乳腺癌细胞系MDA-MB-453、BT-20和已经发生转移的乳腺癌标本中均可检测到低水平的BMP-6,且BMP-6具有抑制乳腺癌MDA-MB-231细胞侵袭、迁移的作用,并认为BMP-6与乳腺癌转移呈负相关[19]。王川[20]在对乳腺癌MCF-7细胞的观察中发现,经过BMP-6处理后的细胞,可通过MAPK/P38/AP-1抑制基质金属蛋白酶(matrix metallo proteinase,MMP)-9启动子活性。在乳腺癌细胞中,MMP-9的水平越高,淋巴转移率、复发率越高,由上述推测Luminal A型的高水平BMP-6表达或与其较好的预后相关。
在Luminal A型的转移患者中,有11.40%(17/149)的患者发生了骨转移,是4型中最高者。BMP-6包括23个氨基酸的N端信号肽和490个氨基酸的BMP-6前肽,前肽中有4个保守双碱性氨基酸残基的酶切点,该点在蛋白水解酶的作用下可产生具有139个氨基酸的活性成熟肽,分泌的BMPs成熟肽可形成同源二聚体或异源二聚体,其中的异源二聚体的诱骨活性较强[21],或许是Luminal A型易发生骨转移的重要机制。
综上所述,BMP-6在乳腺癌不同分子类型中的表达水平存在差异,其中预后较好的Luminal A型BMP-6表达水平较高,Basal-like型表达水平较低,临床或可对不同分子类型的乳腺癌患者采取不同方案的BMP-6治疗,但这仍需进行大量的实验及临床研究。本次观察采选病例地域有限,在下一步研究中拟对不同民族、地区的乳腺癌患者进行分型观察,为BMP-6的临床应用提供参考。
作者贡献:丁梅进行试验设计与实施、撰写论文、成文并对文章负责;王增辉、杨艳玲、马振玲、李宗富、李润华进行试验实施、评估、资料收集;胡芬进行质量控制及审校。
本文无利益冲突。
参考文献
[1]Wang F,Li SJ,Weng J,et al.Research on the relationship between the subtypes of breast cancer and breast cancer susceptibility expression[J].International Journal of Immunology,2014,37(4):349-351.(in Chinese)
汪菲,李嗣杰,瓮洁,等.乳腺癌易感基因1的表达与乳腺癌亚型关系的实验研究[J].国际免疫学杂志,2014,37(4):349-351.
[2]张少华,江泽飞.2011年St.Gallen国际乳腺癌治疗专家共识相关问题解读[J].中国实用外科杂志,2011,31(10):918-919.
[3]Ribatti D,Mangialardi G,Vacca A.Stephen Paget and the ′seed and soil′ theory of metastatic dissemination[J].Clinical and Experimental Medicine,2006,6(4):145-149.
[4]荀建军,贾志峰,冯建刚.BMP-2表达与乳腺癌骨转移的关系[J].山东医药,2011,51(22):2789-2793.
[5]Jia P,Xu YJ,Qian ZM.Recent advances in the relationship between BMP-6 and iron-overload osteoporosis[J].Chinese Journal of Endocrinology and Metabolism,2011,27(2):905-908.(in Chinese)
贾鹏,徐又佳,钱忠明.骨形态生发蛋白6和铁超载骨质疏松关系的最新进展[J].中华内分泌代谢杂志,2011,27(2):905-908.
[6]王喜艳,徐邦生,高银峰,等.BMP-6对卵巢功能和生殖能力作用的研究进展[J].生殖与避孕,2011,31(9):2687-2690.
[7]中华人民共和国卫生部.WS 338-2011 乳腺癌诊断[S].2011.
[8]陈淑玲,王庭槐.雌激素信号途径与血管内皮生长因子信号途径的交互作用介导乳腺癌耐药性[J].生理科学进展,2013,44(2):887-890.
[9]Liu YH,Jiang SQ,Zhang JS.Role of estrogen receptor-related receptors in breast cancer:a review of recent studies[J].Journal of Environment and Health,2014,31(8):2687-2690.(in Chinese)
刘英华,姜淑卿,张静姝.雌激素相关受体与乳腺癌关系研究进展[J].环境与健康杂志,2014,31(8):2687-2690.
[10]米东.PTHrP和BMP-6在乳腺癌中的表达机制研究——hBMP-6在毕赤酵母中的分泌表达[D].天津:南开大学,2010.
[11]Yang JH,Zhao L,Yang S,et al.Expression of recombinant human BMP-6 in escherichia coli and its purification and bioassay in vitro[J].Chinese Journal of Biotechnology,2003,19(5):556-559.(in Chinese)
阳菊华,赵丽,杨爽,等.重组人骨形态发生蛋白-6的表达、纯化及其活性分析[J].生物工程学报,2003,19(5):556-559.
[12]Hao L,Yu RS,Cui F,et al.Breast cancer subtypes based on ER/PR and Her2 expression:comparison of mr imaging features[J].National Medical Journal of China,2013,93(11):881-886.(in Chinese)
郝亮,余日胜,崔凤,等.雌激素受体、孕激素受体和人类上皮因子受体2表达的乳腺癌亚型的MRI表现特征分析对照研究[J].中华医学杂志,2013,93(11):881-886.
[13]Wach S,Schirmacher P,Protschka M,et al.Overexpression of bone morphogenetic protein-6(BMP-6)in murine epidermis suppresses skin rumor formation by induction of apoptosis and downregulation of fos/jun family members[J].Oncogene,2001,20(53):7761-7769.
[14]张磊.雌激素对乳腺癌中骨形态发生蛋白-6的表达影响[D].天津:南开大学,2008.
[15]Liu G,Lian WJ,Zhou HY,et al.Expression and clinical significance of bone morphogenetic protein 6 in human breast cancer[J].Journal of Sichuan University(Medical Science Edition),2014,45(2):249-253.(in Chinese)
刘更,连文静,周鸿鹰,等.BMP6在乳腺癌组织的表达及意义[J].四川大学学报:医学版,2014,45(2):249-253.
[16]张明.BMP6在乳腺癌中的表达调控及CyclinD1翻译后调控Runx3的分子机制[D].天津:南开大学,2008.
[17]王兆奇.人乳腺癌细胞MCF-7中BMP-6/TGF-β对δEF1启动子活性调控的研究[D].天津:南开大学,2008.
[18]Zhang LH,Peng YH,Zha ZQ,et al.The analysis of breast cancer molecular typing for time and location of distant metastasis[J].Chinese Journal of Clinicians(Electronic Edition),2012,6(11):2911-2914.(in Chinese)
章乐虹,彭艳华,查中青,等.乳腺癌分子分型与远处转移时间及部位的分析[J].中华临床医师杂志:电子版,2012,6(11):2911-2914.
[19]Sugiura K,Su YQ,Eppig JJ.Does bone morphogenetic protein 6(BMP6) affect female fertility in the mouse?[J].Biol Reprod,2010,83(6):997-1004.
[20]王川.乳腺癌MCF-7细胞中BMP-6通过HO-1调控MMP-9表达的机制研究[D].天津:南开大学,2011.
[21]Frota IM,Leitão CC,Costa JJ,et al.Levels of BMP-6 mRNA in goat ovarian follicles and in vitro effects of BMP-6 on secondary follicle development[J].Zygote,2013,21(3):270-278.
(本文编辑:贾萌萌)
Clinical Significance of the Expression of Bone Morphogenetic Proteins 6 in Different Types of Breast Cancer
DINGMei,HUFen,WANGZeng-hui,etal.
TangshanXieheHospital,Tangshan063000,China
【Abstract】ObjectiveTo investigate the expression of bone morphogenetic proteins 6(BMP-6)of different types of breast cancer and its relation with clinical pathological characteristics.MethodsFrom January 2013 to March 2015,we enrolled 426 females patients who were diagnosed with breast cancer by surgery and pathology in the Department of General Surgery of Tangshan Xiehe Hospital.Among these patients,there were 149 Luminal A patients,97 Luminal B patients,72 Her-2 positive patients and 108 Basal-like patients.Real-time fluorescent quantitative PCR was adopted to detect the mRNA expression of BMP-6 of different molecular types,and immunohistochemistry assay was used to detect the protein expression of BMP-6 of different molecular types.Comparison of clinical features among different molecular types of breast cancer patients was made.ResultsSignificant differences were noted in BMP-6 mRNA expression level among different molecular types of cancer tissues(P<0.05);BMP-6 mRNA level of Basal-like patients was lower than that of Luminal A patients(P<0.05).Different molecular types of cancer tissues all had lower BMP-6 mRNA level than para-cinoma tissues(P<0.01).Different molecular types of cancer tissues were significantly different in the protein expression level of BMP-6(χ2=19.01,P=0.02);the negative rate(-)of Luminal A type was lower than that of Basal-like type(χ2=5.17,P=0.002);the positive(+++) rate of Luminal A was higher than Basal-like type(χ2=8.84,P<0.001).Different molecular types of patients were not significantly different in the lymphatic metastasis rate(P>0.05),and were significantly different in tumor size and viscera metastasis rate(P<0.01);Basal-like patients had higher viscera metastasis rate than Luminal A patients(χ2=14.71,P<0.001).ConclusionDifferences exist in the expression of BMP-6 among breast cancer tissues of different molecular types,so different BMP-6 treatment regimens can be adopted for different types of breast cancer patients in clinical practice.
【Key words】Breast neoplasms;Bone morphogenetic protein 6;Molecular typing
(收稿日期:2015-07-06;修回日期:2015-12-20)
【中图分类号】R 737.9
【文献标识码】A
doi:10.3969/j.issn.1007-9572.2016.11.016
通信作者:胡芬,063000河北省唐山市,华北理工大学生命科学院;E-mail:ihufen@126.com
基金项目:国家自然科学基金资助项目(81302323)——BMP-6调控mmp表达抑制乳腺癌细胞转移的功能和机理研究(2013-57-0352);河北省自然科学基金资助项目(c2014209140)——BMP-6调控mmp-1表达抑制乳腺癌细胞转移的功能和机制研究
