脱毒菜籽多肽毒理学试验研究
2016-05-02李云亮王禹程黄姗芬马海乐
◎杨 雪,李云亮,王禹程,黄姗芬,马海乐
(江苏大学食品与生物工程学院,江苏 镇江 212013)
油菜籽在我国油料作物中占重要地位,年产量达1 400万t以上[1]。菜籽粕是食品工业生产中菜籽榨油后的副产物,约占油菜籽的50%~55%[2]。菜籽粕中的蛋白含量高达30%~45%,其生物效价和利用率极高,甚至超过脱脂大豆粕和酪蛋白[3,4],是优质的植物蛋白资源。然而每年仅有少数菜籽粕掺入饲料使用,其余未被有效利用,造成大量经济损失和资源浪费。
菜籽粕中含有毒性成分,如硫甙、植酸、单宁和芥子碱等。硫甙本身无毒,但其经芥子酶可分解成异硫氰酸酯、恶唑烷硫酮和腈等有毒物,严重影响菜籽粕的应用价值[5,6],在使用前须进行脱毒处理。目前常用的脱毒方法包括物理脱毒法、化学脱毒法和生物脱毒法。有研究表明,采用硫酸溶液脱毒后菜籽粕中毒性物质的脱除率高于90%,且蛋白质的含量升高、氨基酸组成基本维持不变[7]。
多肽的生物学活性研究是食品科学的研究热点之一[8,9],有研究表明,菜籽蛋白经过酶解形成的菜籽多肽有一定的保健功效,尤其是抗氧化活性[10]及降血压活性[11]。此外,菜籽多肽还有其他生物学功能,如解酒[12]、抗肿瘤[13]等。因此,开发菜籽多肽有助于提高菜籽粕资源的利用[14]。而长期食用脱毒后的菜籽蛋白制备的菜籽多肽是否对机体会产生毒副作用还有待探索。
本试验以小鼠为研究对象,进行急性经口毒性试验、鼠伤寒沙门氏菌/哺乳动物微粒体酶试验、骨髓细胞微核试验和睾丸染色体畸变试验,对脱毒菜籽多肽的食用安全性进行初步评价,为进一步的开发应用提供参考。
1 材料与方法
1.1 试验材料
1.1.1 样品
脱毒菜籽多肽(多肽含量≥85%,江苏天琦生物科技有限公司,江苏镇江)。
1.1.2 菌株
经鉴定基因型符合要求的TA97a、TA98、TA100和TA102,各菌株过夜培养液细菌浓度均在109个/mL或以上。
1.1.3 S9混合液
由Aroclor1254诱导的大鼠肝匀浆制成10% S9混合液。
1.1.4 试验动物
健康ICR小鼠95只,其中雄性60只、雌性35只。分成3批进行试验,第一批20只,雌雄各半,体重18.5~21.6 g,用于小鼠急性经口毒性试验。第二批50只,雌雄各半,体重25~30 g,用于小鼠骨髓细胞微核试验。第三批25只雄性小鼠,体重25~30 g。用于小鼠睾丸染色体畸变试验。南京医科大学实验动物中心提供,清洁级,合格证号:SCXK(苏)2013-0005 号。实验动物屏障环境设施使用许可证号:SYXK(苏)2012-0037 号。灭菌鼠饲料来源及合格证号:苏州双狮实验动物饲料科技有限公司,苏饲审(2009)05032。饲料和无菌水自由食用。
1.2 试验方法
1.2.1 小鼠急性经口毒性试验
采用最大耐受量试验法(GB 15193.3-2014),每组雌雄小鼠各10只,设计剂量为15 g/kg·BW,分两次灌胃给予,间隔4 h,每次灌胃容量均为20 mL/kg·BW。
1.2.2 鼠伤寒沙门菌/哺乳动物微粒体酶试验
利用平板掺入法测定(GB 15193.4-2014),试验共设5个剂量组,1个溶剂对照组,一个空白对照组即自发回变组,另设4个阳性对照组,阳性对照物叠氮钠(NaN3)、敌克松(Dexon)、2-氨基芴(2-AF)和1,8-二羟基蒽醌分别用灭菌水和DMSO溶解,所用剂量分别为1.5、50、10、50 μg/皿。
1.2.3 小鼠骨髓细胞微核试验
参照GB 15193.5-2014,小鼠分雌雄按体重随机分入2.5、5、10 g/kg·BW各3个剂量组、1个溶剂对照组(纯净水)和1个阳性对照组(环磷酰胺40 mg/kg·BW),每组10只,雌雄各半。各组均采用30 h两次灌胃法,每次灌胃容量为20 mL/kg·BW,第2次灌胃后6 h杀鼠,取股骨骨髓悬于小牛血清中直接涂片、固定、染色,镜检嗜多染红细胞1 000个/鼠,计数具有微核的细胞,观察嗜多染红细胞和正染红细胞比率(PCE/NCE)。
1.2.4 小鼠睾丸染色体畸变试验
参照GB 15193.8-2014,分别称取脱毒菜籽多肽2.5、5、10 g加纯净水至20 mL配制成受试剂量。阳性对照取环磷酰胺40 mg加生理盐水至10 mL混合均匀。小鼠按体重随机分入3个剂量组、1个溶剂对照组(纯净水)和1个阳性对照组(环磷酰胺40 mg/kg·BW),每组5只小鼠。阳性对照组连续5 d,每次灌胃容量均为20 mL/kg,每天一次。各组动物均于处死前6 h腹腔注射秋水仙素4 mg/kg,试验第14 d杀鼠取睾丸,拉开曲细精管,低渗,固定,软化,制片,染色,镜检,观察细胞数100个/只。
1.3 统计学处理
各项测定指标均用spss16.0软件进行单因素方差分析。
2 结果与分析
2.1 小鼠急性经口毒性试验
观察小鼠灌胃后两周内的体重以及中毒表现,脱毒菜籽多肽对小鼠体重的影响见表1。
表1 脱毒菜籽多肽对小鼠体重的影响表

表1 脱毒菜籽多肽对小鼠体重的影响表
?
从表1可以看出,脱毒菜籽多肽对动物体重增长无明显影响。经口给予动物后未见明显中毒表现,观察期内无动物死亡。脱毒菜籽多肽对雌雄小鼠经口最大耐受剂量均大于1.5 g/kg·BW,根据小鼠急性经口毒性分级标准,该脱毒菜籽多肽属无毒级。
2.2 鼠伤寒沙门氏菌/哺乳动物微粒体酶试验
脱毒菜籽多肽对小鼠伤寒沙门氏菌/哺乳动物微粒体酶试验结果见表2。
表2 脱毒菜籽多肽对小鼠伤寒沙门菌/哺乳动物微粒体酶试验结果表

表2 脱毒菜籽多肽对小鼠伤寒沙门菌/哺乳动物微粒体酶试验结果表
?
由表2中结果可知,两次试验各剂量组的回变菌落数,不论加S9与否均为超过相应的溶剂对照值的两倍,也无剂量-反应关系。剂量达5 000 μg/皿,不论加S9与否,脱毒菜籽多肽对标准测试菌株TA97a、TA98、TA100和TA102均未检出明显的诱变活性。
2.3 小鼠骨髓细胞微核试验
脱毒菜籽多肽对小鼠骨髓细胞微核试验结果见表3。
表3 脱毒菜籽多肽对小鼠骨髓嗜多染红细胞微核试验结果表
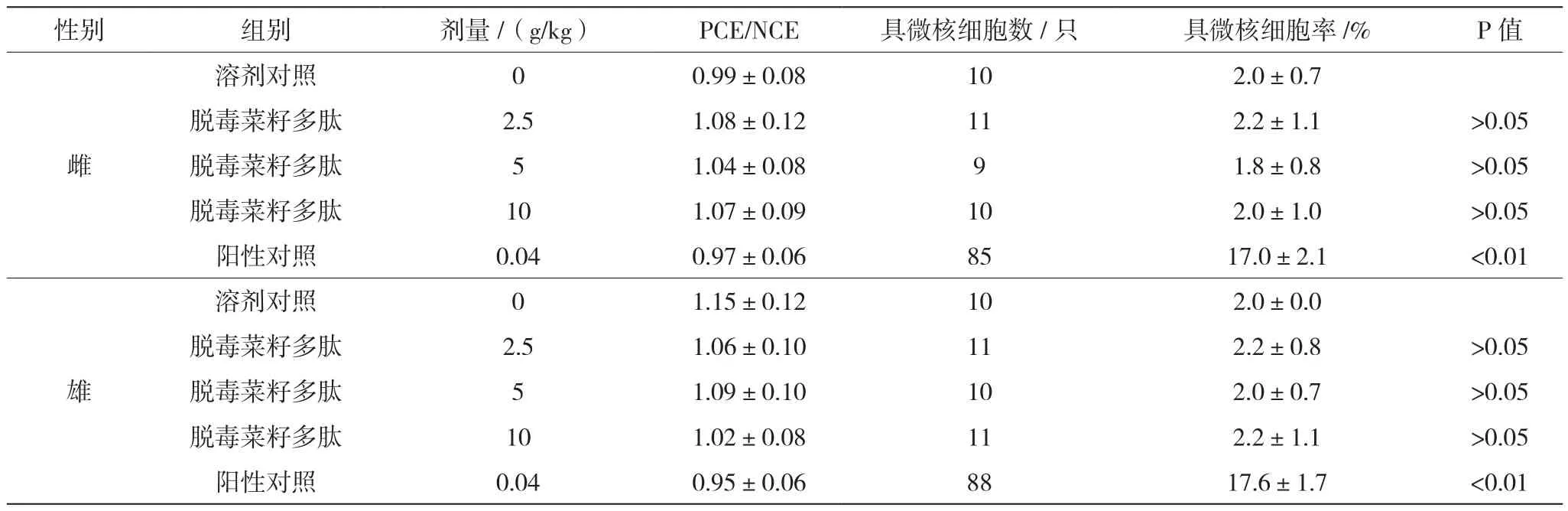
表3 脱毒菜籽多肽对小鼠骨髓嗜多染红细胞微核试验结果表
?
各菜籽多肽受试物的微核率与溶剂对照组相比,均无显著性差异,也无剂量-反应关系,阳性对照组微核率与溶剂对照组相比则有统计学显著性差异(P<0.01)。受试物各剂量组动物的PCE占红细胞总数的比例不少于对照组的20%,提示骨髓红细胞系统的增殖并无明显受抑,对嗜多染红细胞微核的观察无明显影响。在2.5、5、10 g/kg受试剂量下,脱毒菜籽多肽没有对雌雄小鼠骨髓嗜多染红细胞致微核作用。
2.4 小鼠睾丸染色体畸变试验
脱毒菜籽多肽对小鼠睾丸染色体畸变试验结果见表4。
表4 脱毒菜籽多肽对小鼠睾丸初级精母细胞染色体畸变试验结果表

表4 脱毒菜籽多肽对小鼠睾丸初级精母细胞染色体畸变试验结果表
a:断裂、断片、三价体、四价体等,★★:与对照值比较P<0.01。
?
脱毒菜籽多肽各剂量组小鼠具有染色体畸变的初级精母细胞率与溶剂对照值之间均无统计学差异,也无剂量-反应关系。阳性对照值与溶剂对照值之间有统计学显著性差异(P<0.01)。在2.5、5、10 g/kg受试剂量下,脱毒菜籽多肽没有对雄性小鼠睾丸初级精母细胞染色体的诱变活性。
3 讨论
本文通过小鼠急性经口毒性试验、鼠伤寒沙门氏菌/哺乳动物微粒体酶试验、小鼠骨髓细胞微核试验、小鼠睾丸染色体畸变试验研究了脱毒菜籽多肽毒理学特性。急性毒性试验中,脱毒菜籽多肽对雌雄小鼠经口最大耐受剂量均大于15 g/kg·BW。鼠伤寒沙门氏菌/哺乳动物微粒体酶试验可在基因水平上反映生物体遗传物质的损伤情况,本实验中,脱毒菜籽多肽的添加剂量达5 mg/皿时,加及不加S9对标准测试菌株TA97a、TA98、TA100和TA102均没有明显诱变活性,说明饲喂脱毒菜籽多肽以后,小鼠既没有间接诱变活性,也没有直接诱变活性。小鼠骨髓细胞微核试验可以反映受试物对哺乳动物骨髓细胞染色体的作用能力,以检测致突变物对遗传物质的损伤情况。小鼠睾丸染色体畸变试验反映了生殖系统在外来诱变剂作用下的变异现象。这2项遗传毒性试验结果均为阴性,表明脱毒菜籽多肽对体细胞和生殖细胞没有致突变性。
4 结论
通过小鼠急性经口毒性试验可知,脱毒菜籽多肽属于无毒级;通过鼠伤寒沙门氏菌/哺乳动物微粒体酶试验可知,脱毒菜籽多肽对小鼠既没有间接诱变活性,也没有直接诱变活性;通过小鼠骨髓细胞微核试验可知,脱毒菜籽多肽对小鼠遗传物质无损伤作用;通过睾丸染色体畸变试验可知,脱毒菜籽多肽对小鼠生殖系统无诱变作用。
由此可得出最终结论,脱毒菜籽多肽具有良好的食用安全性,可以作为一种保健食品原料进行开发、利用。
参考文献:
[1]刘敏佳.菜籽粕的抗营养因子及其脱毒研究进展[J].湖北畜牧兽医,2016,37(3):9-12.
[2]丁 艳,李丽倩,曹 蓉,等.油菜籽饼粕中硫苷的酶解条件优化及降解产物分析[J].中国农业科学,2014,47(2):383-393.
[3]Berot S,Compoint J,Larre C,et al. Large scale purification of rapeseed proteins (Brassica napusl L.)[J].Journal of Chromatography B,2005,818(1):35-42.
[4]Yoshie S Y,Wada Y,Schott M,et al.Functional and bioactive properties of rapeseed protein concentrates and sensory analysis of food application with rapeseed protein concentrates[J]. LWT-Food Science and Technology,2006,39(5):503-512.
[5]邱良伟,顾拥建,沙文锋,等.复合微生物固态发酵菜籽粕的研究[J].安徽农业科学,2015,43(3):209-211.
[6]罗仓学,史 兰,李振尧.菜籽粕脱毒及菜籽蛋白提取工艺优化[J].食品与发酵科技,2013,19(6):50-54.
[7]兰文菊,彭密军,彭 胜,等.酸溶液对菜籽粕脱毒工艺探讨[J].中国粮油学报,2012,27(11):67-71.
[8]Yoon K A,Kim K,Kim A Y,et al.Selective antitumor activities of venom peptides from the lesser paper wasp Parapolybia varia[J]. Journal of Asia-Pacific Entomology,2016,19(3):821-828.
[9]Kim H,Jang J H,Kim S C,et al.Enhancement of the antimicrobial activity and selectivity of GNU7 against Gramnegative bacteria by fusion with LPS-targeting peptide[J].Peptides,2016,82(5):60-66.
[10]He Rong,Ju Xingrong,Yuan Jian,et al. Antioxidant activities of rapeseed peptides produced by solid state fermentation[J].Food Research International,2012,49(1):432-438.
[11]Makinen S,Streng T,Larsen L B,et al. Angiotensin I-converting enzyme inhibitory and antihypertensive properties of potato and rapeseed protein-derived peptides[J].Journal of Functional Foods,2016,25:160-173.
[12]王薇星.菜籽蛋白的制备及其酶解产物的醒酒功效[D].金华:浙江师范大学,2012.
[13]曾晓波,吴谋成,李小定,等.菜籽肽对S180肿瘤细胞体外生长影响的研究[J].营养学报,2004,26(3):216-219.
[14]Wang Bei,Meng Tingting,Ma Haile,et al.Mechanism study of dual-frequency ultrasound assisted enzymolysis on rapeseed protein by immobilized Alcalase[J].Ultrasonics Sonochemistry,2016,32(3):307-313.
