不同强度有氧运动对SHR动脉平滑肌MaxiK通道功能重构的影响
2016-05-02徐召霞赵腾腾石丽君
徐召霞,赵腾腾,柏 平,石丽君
●成果报告 Original Articles
不同强度有氧运动对SHR动脉平滑肌MaxiK通道功能重构的影响
徐召霞1,赵腾腾2,柏 平3,石丽君4
目的:研究不同运动强度对自发性高血压大鼠(SHR)的肠系膜动脉的大电导钙激活钾通道(MaxiK)功能重塑的影响。方法:54只3月龄雄性SHR随机分为3组:低强度有氧运动组(SHR-L,n=18),中强度有氧运动组(SHR-M,n=18)和安静组(SHR,n=18)。18只同龄雄性WKY作为空白对照组(WKY,n=18),运动组完成8周的运动训练。运动方案:坡度0°,60 min/d,5 d/w,SHR-L,14 m/min,40%~49%VO2max;SHR-M,20 m/min,55%~65%VO2max。8周运动结束后急性酶分离肠系膜动脉平滑肌细胞(VSMCs)。记录不同运动强度对肠系膜动脉MaxiK通道电流及通道蛋白亚基表达的影响。结果:1.运动训练前,与WKY组相比,SHR安静组体重(BW)无显著性差异(P>0.05),但心率(HR)和平均动脉压(MAP)均显著升高(P<0.05),经过8周的运动训练后,SHR-L组和SHR-M组的BW、HR和MAP都较SHR安静组明显降低(P<0.05),且与SHR-L组相比,SHRM组MAP降低程度更为显著(P<0.05);2.与WKY组相比,SHR安静组MaxiK通道NPo值显著升高(P<0.05);与SHR安静组相比,经过8周运动训练后,SHR-L和SHR-M组MaxiK通道NPo值明显降低(P<0.05),且SHR-M组比SHR-L组的降低作用更为显著(P<0.05);3.与WKY组相比,SHR安静组β1亚基和α亚基蛋白表达水平均升高,但β1亚基升高程度较α亚基更明显,即β1/α比值显著升高(P<0.05),与SHR安静组相比,8周运动训练可显著降低β1/α比值(P<0.05),而且SHR-M组比SHR-L组的改善作用更为显著(P<0.05)。结论:有氧运动可以纠正高血压相关的肠系膜血管平滑肌MaxiK通道病理性重塑,并由此改善由高血压引起的该通道的病理改变,延缓并改善高血压症状,在低强度有氧运动到中强度有氧运动范围内,运动对高血压症状的改善作用具有运动强度的依赖性。
运动强度;高血压;肠系膜动脉MaxiK通道
高血压是脑卒中、冠状动脉疾病、心脏衰竭以及肾脏疾病等疾病发展过程中的一个重要的危险因素[1]。在慢性高血压中,为了缓解灌注血压的升高,动脉和小动脉经历着广泛的生物学和结构适应[2]。其中一个典型的病理性改变就是,血管在应对各种生理刺激时,其收缩反应增强,舒张反应减弱,这导致当动脉和小动脉持续暴露在高血压环境时血管张力升高[3]。高血压的发展与VSMCs离子通道的重塑有关[4]。在肠系膜动脉VSMCs中,MaxiK高水平表达,该通道能够被膜去极化和细胞内钙离子浓度升高而激活,从而导致细胞膜超极化,以此对抗血管收缩[5]。
很多研究表明,肠系膜动脉MaxiK通道的改变与高血压有关,但是这些研究目前尚不一致。本实验室前期的研究发现,有氧运动可以诱导Wistar大鼠胸主动脉平滑肌细胞MaxiK通道活动增加。在原发性高血压大鼠(SHR)中MaxiK通道是否出现功能重塑,而且有氧运动已被公认作为治疗高血压的有效措施,那么在该实验模型中有氧运动是否会通过调控MaxiK通道功能重塑改善SHR血管功能,以及此种调控作用是否存在运动强度—效应关系,目前尚没有进行相应的研究。
本研究是以SHR和WKY肠系膜动脉平滑肌细胞为研究对象,采用电生理膜片钳全细胞记录模式和内面向外记录模式记录肠系膜动脉MaxiK通道电流,并结合Western blot技术分析MaxiK通道蛋白亚基表达变化,探讨肠系膜动脉平滑肌中MaxiK通道电流病理改变的分子机制,有氧运动对该通道结构和功能重塑的影响,以及不同运动强度与MaxiK通道重塑的关系,这将为运动改善高血压血管功能提供实验室依据。
1 材料与方法
1.1 实验动物
实验采用54只3月龄雄性SHR和18只3月龄雄性WKY(均购自北京维通利华公司)。SHR随机分到3个组中:安静对照组(SHR-C,n=18),低强有氧运动组(SHR-L,n=18),中强有氧运动组(SHR-M,n=18)。WKY-C(n=18)作为空白对照组。所有的动物分笼饲养,每笼4只,控制光照(12 h昼,12 h夜)和温度((22±1)°C)条件,自由进食饮水。研究方案符合第八版《实验动物的护理和使用指南》(Washington,DC:The National Academies Press,2011),并严格遵守《北京体育大学动物护理和使用条例》。
1.2 训练方案
运动组先经过一周的适应性训练,之后进行8周的跑台运动,坡度0°,60 min/d,5 d/w。依照组别分别给予不同强度的运动,即低强度有氧运动组(SHR-L:14 m/min,40~49%VO2max),中强度有氧运动组(SHR-M:20 m/min,55~65%VO2max)。强度设置参考文献[6-7]。运动持续时间和运动频率均与运动方案保持一致。SHR安静对照组和WKY空白对照组不做运动干预。
1.3 大鼠尾动脉无创血压测定
采用智能无创血压测试仪BP-2010A(购自北京软隆生物公司)测量大鼠安静时的尾动脉血压和心率。为避免环境应激对大鼠血压带来的影响,严格控制测试时间和环境温度,保持测试环境安静,温暖。运动组大鼠血压的测试安排在运动两天后进行。测量结束,软件根据脉搏波曲线自动拟合计算出大鼠的收缩压(SBP)和心率(HR)等。
测量步骤包括:(1)仪器预热。首先连接测试仪器面板上压力输出接口与数据采集处理系统,传感器与机体,进气口与出气口等装置。打开BP-2010A电源,按动加热箱控制面板上的温度按键,设定实验所需的加热温度(一般为37°C)。(2)固定大鼠。在大鼠固定前要尽量让其保持自由活动状态,将清醒的实验大鼠置于特制的鼠笼内固定,保持正常体位,将鼠笼放入加热箱内。将压力传感器穿过大鼠鼠尾,并固定于鼠尾根部。(3)心率、血压测定。从测试仪器面板上的实验项目菜单中选择“无创血压测量”命令,选择工具条上“启动实验”按钮,待界面出现稳定的脉搏波后即可启动开始按钮,实验过程中通过调节合适的增益值的大小来防止信号饱和或放大倍数过小,得到最佳的阻断波形,即可保存以供血压、心率分析。2次测量间隔时间要保证大鼠心率已恢复正常。
1.4 膜片钳电生理实验
1.4.1 肠系膜动脉平滑肌细胞分离[8]取出大鼠的肠系膜动脉及其分支,并置入4°C的无钙分离液中。分离液组成(mM):137 NaCl,5.6 KCl,1 MgCl2,10 Glucose,10 HEPES,0.42 Na2HPO4,0.44 NaH2PO4,4.2 NaHCO3。将肠系膜动脉周围的结缔组织仔细剥离以后,取二级及以下动脉分支,将其剪成约1~2 mm的小段并放入分离酶液中。为保证酶的消化效果,应在放入动脉之前将分离酶液预热到37°C。将含动脉段的分离酶液置于37°C恒温水浴锅中,消化期间可轻柔晃动分离酶液,以利于酶与动脉段充分接触。动脉组织消化38~45 min后取出,置于分离VSMCs的缓冲液中,在室温漂洗2~3次以终止消化。用钝头滴管缓慢并轻柔吹打约25次,用2 mm尼龙纱网过滤细胞悬液并滴入特制的浴槽,置于4°C冰箱,贴壁保存备用。为保证电生理实验细胞的良好活性状态,所有实验于获取细胞后6 h内完成。
1.4.2 全细胞和内面向外模式记录肠系膜动脉MaxiK通道电流 在室温下采用电压钳方式进行全细胞K+电流的测定。所测电流信号经Axon 700B amplifier(Axon Instruments Inc.,Foster City,CA,USA)放大,低通滤波2 000 Hz,采样频率10 000 Hz。硼硅玻璃电极中灌注电极内液,内液成分(mM):110 K-Asp,30 KCl,1 EGTA,3 Na2ATP,0.85 CaCl2,10 Glucose,10 HEPES,KOH调pH至7.2。浴液的成分(mM):134 NaCl,6 KCl,1 MgCl2,1.8 CaCl2,10 glucose,10 HEPES(pH为7.4)。电流-电压(I-V)关系从电压钳细胞中得出,将细胞钳制在-80 mV,给予连续电压刺激到+70 mV,阶跃为10 mV,刺激时间为350 ms。Iberiotoxin(IBTX)作为MaxiK通道的特异性阻断剂,常用来鉴定MaxiK通道电流。本研究在浴液中加入100 nM IBTX用以鉴定MaxiK电流。为了消除细胞大小对通道电流的影响,肠系膜动脉MaxiK膜电流通过膜电容的校准,获取电流密度。
单通道电流的记录是采用内面向外的记录模式。在电极内液和浴液对称性高钾(145 mM)时记录得到的肠系膜动脉MaxiK单通道原始电流[8]。膜片上通道的数量(N)和开放概率(Po)作为通道稳态活动的指标。
1.5 Western blot实验
采用蛋白免疫印记法将目标蛋白分离和提纯。向几条相邻的泳道中加入等质量的总蛋白(20 ug),实验所用一抗是多克隆抗体anti-KCa1.1(1:300)和多克隆抗体anti-sloβ1(1:300),均购自Alomone Labs,二抗为anti-rabbit IgG-HRP(1:4 000),购自Sigma-Aldrich。ChemiDOC XR(Bio-Rad)系统采集蛋白免疫反应条带,Quantity One(Bio-Rad)软件分析条带灰度值。各条带通过内参β-actin标准化定量,然后在各组间进行比较。
1.6 数据分析
所有数据均以mean±SEM表示,两组数据比较采用T检验,多组间数据比较采用单因素方差分析,P<0.05有显著性差异,P<0.01有非常显著性差异。N代表每组中动物的数量,n代表每组中细胞的数量。
2 结果
2.1 肠系膜动脉平滑肌细胞形态鉴定
采用急性酶消化肠系膜动脉获得单个散在,形态完整,贴壁良好的平滑肌细胞。采用倒置生物显微镜(Olympus,IX71-F22PH,Japan)观察细胞呈梭形或香蕉形,表面光滑,折光性好,立体感强,边界清晰而完整,这反映细胞活性状态良好。获取的各组细胞,如图1所示,可见各组细胞在形态、大小上无显著性差异,提示高血压和有氧运动强度对细胞的形态无显著影响。
图1 急性酶消化法分离的大鼠肠系膜动脉平滑肌细胞Figure1 Rat Mesenteric Arterial Smooth Muscle Cells Isolated By Acute Enzymatic Digestion注:A,WKY;B,SHR;C,SHR-L;D,SHR-M。
2.2 有氧运动对大鼠基础指标影响的比较
大鼠心血管方面的指标包括:体重(BW)、平均动脉压(MAP)、心率(HR)等,这些指标反映心血管系统的基本功能状态。本研究通过采集实验前后相关指标,以此分析有氧运动对大鼠基础指标的影响。WKY组、SHR组、SHR-L组以及SHR-M各组动物的BW、MAP、HR,如图2所示。在运动训练前,4组动物的体重相比并无显著性差异。8周的运动训练后,SHR-L和SHR-M的体重与SHR对照组相比明显降低(P<0.05),但不同强度运动组之间并无显著性差异(P>0.05)。运动前SHR平均动脉压((185.2±6.0)mmHg)高于WKY((118.0±5.3)mmHg),P<0.05。但是,运动训练后发现MAP明显降低。与SHR-L组相比较,MAP在SHR-M组中降低的更为明显(SHR-L:(173.4± 5.4)mmHg;SHR-M:(160.1±5.1)mmHg,P<0.05)。SHR组的心率高于WKY,但SHR-L和SHR-M组的心率都较SHR对照组明显降低,而SHR-L和SHR-M组之间没有显著性差异,P>0.05。
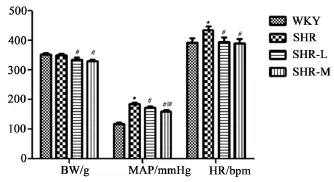
图2 有氧运动对BW,MAP和HR的影响Figure2 Effects of Aerobic Exercise on BW,MAP and HR注:*为与WKY组比较具有显著性差异,P<0.05;#为与SHR组比较具有显著性差异,P<0.05;※为与SHR-L组比较具有显著性差异,P<0.05。各组中n=12。
2.3 肠系膜动脉MaxiK全细胞电流密度的比较
全细胞K+电流如图3所示。数据分析显示,SHR组MaxiK通道全细胞电流密度明显高于WKY组,而有氧运动可以有效降低全细胞电流幅值,并且这一作用具有运动强度依赖性。在加入IbTX(100 nM)处理10 min后,全细胞K+电流被明显抑制,被抑制的成分即为IbTX敏感的MaxiK电流。
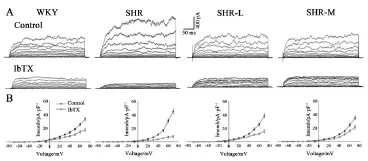
图3 WKY,SHR,SHR-L和SHR-M的肠系膜动脉平滑肌全细胞K+电流Figure3 Whole-cell K+Currents in Mesenteric Arterial Myocytes from WKY,SHR,SHR-L,and SHR-M.注:A,在去极化电压脉冲下全细胞K+电流,Control为对照组,IbTX为加入100 nM IbTX。B为I-V曲线。
为了进一步排除细胞大小对全细胞电流的影响,我们通过比较各组电流密度(即全细胞电流/膜电容)来表示高血压和有氧运动对MaxiK通道电流的影响。各组膜电容和MaxiK通道全细胞电流密度大小见表1。由此可知,4组全细胞膜电容无显著性差异,而SHR组MaxiK电流密度最大,有氧运动能够有效抑制这种病理性改变,且在一定运动强度范围内具有强度依赖性。
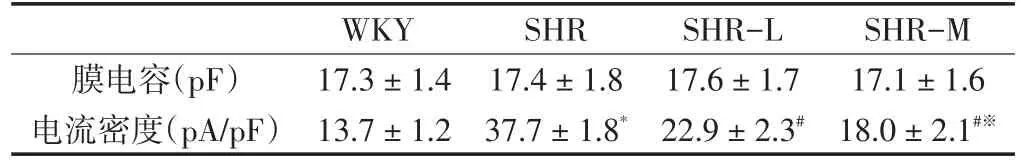
表1 有氧运动对大鼠肠系膜动脉平滑肌细胞MaxiK通道全细胞电流密度和电容的影响Table1 The Influence of Aerobic Exercise on Whole-cell MaxiK Current Density and Capacitance in Rat Mesenteric Arterial Smooth Muscle Cells
2.4 肠系膜动脉MaxiK单通道电流特性的比较
为了进一步明确SHR肠系膜平滑肌细胞肠系膜动脉MaxiK通道电流的增加是否与单通道活性增加有关。我们又进行了内面向外的单通道记录模式记录肠系膜动脉MaxiK通道电流。各组MaxiK通道单通道电流如图4所示。

图4 有氧运动对肠系膜动脉平滑肌MaxiK通道活动和门控特性的影响Figure4 Effects of Aerobic Exercise on Hypertension-associated Alterations in MaxiK Channel Activity and Gating Properties in Mesenteric Arterial Myocytes.注:图为钳制电位为+40 mV,1 μM[Ca2+]free时各组记录到的肠系膜动脉平滑肌细胞MaxiK单通道电流。
钳制电位为+40 mV,1 μM[Ca2+]free,各组MaxiK通道开放概率(NPo)值和单通道电导(G)见表2。数据显示,有氧运动并没有改变肠系膜动脉MaxiK通道的电导。这提示,有氧运动降低肠系膜动脉MaxiK通道活动是通过降低该通道NPo而实现的。

表2 有氧运动对大鼠肠系膜动脉平滑肌细胞MaxiK通道门控特性的影响Table2 Aerobic Exercise Modifying MaxiK Channel Gating Properties in VSMCs from Rat Mesenteric Arterial
2.5 肠系膜动脉MaxiK通道α、β1亚基表达的比较
Western blot测定肠系膜动脉肠系膜动脉MaxiK通道亚基的表达。如图5(A-C)所示,高血压能够引起α、β1亚基的显著增加,SHR组α和β1亚基的表达量分别是WKY组的1.6倍和4.4倍,SHR组的β1/α比值是WKY组的2.5倍。经过8周有氧运动训练后发现,运动可以降低由高血压引起的α、β1亚基表达的上调,而这种作用在SHR-M组比SHR-L组表现更为显著。以上数据提示,无论是组织还是细胞水平,与α亚基相比,高血压能够引起β1亚基表达的升高更为明显,有氧运动能够改善并逆转MaxiK通道亚基的病理性改变,且在一定范围内具有运动强度依赖性。
3 讨论
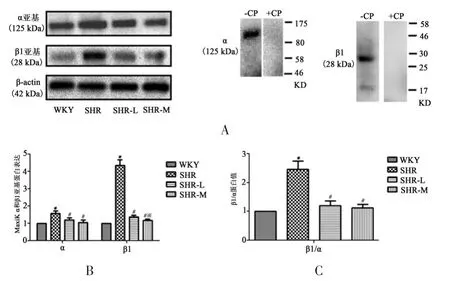
图5 肠系膜动脉平滑肌肠系膜动脉MaxiK α和β1亚基蛋白表达Figure5 Protein in Mesenteric Arterial MaxiK α and β1 Subunits in Mesenteric Smooth Muscle Cells.注:A.分别代表肠系膜动脉MaxiK α亚基,β1亚基和β-actin的West⁃ern blot条带。B代表肠系膜动脉MaxiK α和β1亚基蛋白的灰度值。C代表β1/α比值。每组n=6。*指与WKY相比具有非常显著性差异,P<0.01;#指与SHR相比具有非常显著性差异,P<0.01;※指与SHR-L相比具有非常显著性差异,P<0.01。
运动锻炼与健康促进两者之间的关系已经确认[9-11]。在疾病的发病率,总死亡率和众多慢性疾病的研究中已经揭示了不同的运动强度与健康促进之间的关系[11-13]。本实验室前期研究发现[8],经过8周的跑台运动,高血压大鼠的心率、体重、平均动脉压都明显降低。这些积极的影响表明有氧运动训练具有效性。研究同时发现,高血压大鼠在进行运动训练时,运动训练能够有效地降低MAP,且这一作用具有运动剂量的依赖性[9]。
研究发现,肠系膜动脉平滑肌细胞中MaxiK通道蛋白具有高表达的特性,该通道蛋白表达升高的变化趋势可能作为一种缓冲血管收缩的内源性代偿机制,尤其是在高血管张力发生过程中,阻力动脉血管平滑肌持续长时间强力收缩的情况下[14-15]。在以往的多篇研究中也报道过高血压发生时VSMCs的肠系膜动脉MaxiK通道蛋白表达上调[16-20]。
本研究通过电生理膜片钳实验发现,与WKY相比,SHR组的肠系膜动脉平滑肌细胞的全细胞K+电流明显增强。这一发现与以往多种高血压模型的主动脉和肠系膜动脉的研究结果一致[21-22]。单通道记录结果也显示,与WKY相比,SHR组的通道活动(NPo)明显增强。本研究同时也发现,有氧运动训练能够下调由高血压引起的NPo值的升高趋势,而且,与低强度有氧运动相比,中强度有氧运动对高血压引起的肠系膜动脉MaxiK通道功能病变的改善效果更为显著。
本实验室前期在对正常血压大鼠的研究中发现,运动训练可以有效降低大鼠的SBP,而对DBP和MAP没有影响,而且运动可以增强正常血压大鼠的肠系膜动脉平滑肌肠系膜动脉MaxiK通道活动[8]。在本研究中我们发现,有氧运动对正常大鼠和高血压大鼠血压的影响具有一致性,但是,运动训练对它们的肠系膜动脉MaxiK通道表达和活动的影响存在差异。在对这2种模型的研究中,有氧运动对其肠系膜动脉MaxiK通道表达的矛盾结论存在很多可能的解释。在多种动脉平滑肌细胞的研究中发现,运动训练可以通过改变肠系膜动脉MaxiK通道的门控特性进而影响其活动[8,23-24],即运动可以激活肠系膜动脉的MaxiK通道。但是,在高血压大鼠中,为了对抗慢性持续升高的灌注血压,肠系膜动脉平滑肌细胞MaxiK通道的功能表现为上调趋势[25]。因此,MaxiK通道功能的上调被视为高血压的结果而不是原因。
此外,与正常血压鼠相比,高血压大鼠的KV通道功能明显降低,这可能也是高血压发生时血管张力升高的一个原因[26]。KV通道是调节膜电位和血管张力的另一个重要的离子通道。KV通道的减弱可以引起细胞膜去极化,导致L型钙通道开放引起Ca2+内流。在最近的研究中发现,一方面,运动训练可以明显抑制SHR胸主动脉KV通道的下调,因此,由KV通道的下调引起的高血压可以在一定程度上得到改善;另一方面,运动训练还可以通过抑制肠系膜动脉MaxiK通道的功能上调从而进一步降压。鉴于有氧运动对MaxiK通道和KV通道可以产生不同效应,所以我们需要进一步的研究来明确,有氧运动的净效应是否是通过诱导SHR肠系膜动脉MaxiK通道的重塑来发挥作用的。
有报道,高血压大鼠的血压与肠系膜动脉MaxiK通道的全细胞K+电流呈正相关[20]。例如,应用血管紧张素转化酶抑制剂,ramipril,可以纠正肠系膜动脉MaxiK通道的电流密度来降低高血压大鼠的血压。此外,ramipril可以减弱SHR大鼠主动脉段的TEA引起的收缩[20]。脑动脉原位研究也提供了高血压大鼠肠系膜动脉MaxiK通道功能上调的证据[18]。经颅向软脑膜动脉内注射IbTX(100 nM),研究发现SHR的动脉收缩反应较WKY强烈。因此,肠系膜动脉MaxiK通道功能上调被认为是对抗高血压发展进程中出现的微循环血管床兴奋性增加和血管痉挛的适应性机制[2]。有氧运动可以调节肠系膜动脉MaxiK通道的表达和功能从而起到降低血压的效果。高血压大鼠在进行运动训练时发现,运动训练能够有效地降低MAP,而这一作用具有运动剂量的依赖性[9],这与本研究的结论相一致。
肠系膜动脉MaxiK通道的β1亚基能够调节肠系膜动脉MaxiK通道的钙敏感性,介导钙火花与MaxiK通道激活两者之间的耦联[27-28]。肠系膜动脉MaxiK通道的α和β1亚基的化学计量关系的改变提示机体的生理病理变化[29-30]。以前的研究表明,高血压时无论是主动脉还是微动脉,形成MaxiK通道孔道的α亚基表达都会增加[21,31]。在最近的研究发现,与WKY相比,SHR的肠系膜动脉平滑肌细胞α和β1亚基表达都明显升高。而且,在SHR肠系膜动脉平滑肌中,高血压诱导的β1亚基上调高于α亚基,即β1/α比值升高,这导致膜超极化和血管张力降低,从而起到缓冲高血压引起的一系列病理变化的作用。
本研究有2个新的发现,(1)在高血压持续影响下,SHR的动脉平滑肌细胞表现出病理性改变,主要包括与WKY相比,肠系膜动脉MaxiKβ1/α比值、MaxiK电流密度和开放概率、以及MaxiK在血管张力调节中的作用都发生相应的改变。(2)除了改善SHR基础生理指标以外,有氧运动还可以使高血压引起的肠系膜动脉MaxiK通道功能的上调纠正到正常水平,而这一作用在中强度的表现较低强度效果更为显著。这些结果提示,有氧运动可以纠正SHR外周阻力动脉的MaxiK通道的病理改变,并且在一定程度上具有运动强度依赖性,即在低强度有氧运动到中强度有氧运动范围内,随着运动强度的增加,这一纠正效果越明显。
该研究也存在一定的局限性,如研究中只关注了肠系膜动脉非内皮调节机制(如VSMCs的MaxiK通道)。有研究证实,与SHR对照组相比,运动训练能够提高SHR肠系膜小动脉内皮细胞的NO生物利用率[7]。因此,其他机制,例如运动可以改善与内皮NOS(eNOS)表达/活动相关的氧化应激活动降低和/或NO生物利用率提高,这些可能也是运动训练改善高血压的机制,还需要进行相关的深入研究。
4 结论
有氧运动除了改善高血压背景下的基础生理指标外,还可以纠正高血压相关的肠系膜动脉MaxiK通道病理性重构,从而改善并逆转高血压诱发的病理性变化,而且有氧运动对MaxiK通道病理性重塑的改善作用,在低强度到中强度范围内表现出强度依赖性的特点。
[1]SCHMIEDER R E.End organ damage in hypertension[J].Dtsch Arztebl Int,2010,107(49):866-873.
[2]JOSEPH B K,THAKALI K M,MOORE C L,et al.Ion channel remod⁃eling in vascular smooth muscle during hypertension:Implications for novel therapeutic approaches[J].Pharmacol Res,2013,70(1):126-138.
[3]HEISTAD D D,MAYHAN W G,COYLE P,et al.Impaired dilatation of cerebral arterioles in chronic hypertension[J].Blood Vessels,1990,27(2-5):258-262.
[4]HARDER D R,BRANN L,HALPERN W.Altered membrane electri⁃cal properties of smooth muscle cells from small cerebral arteries of hy⁃pertensive rats[J].Blood Vessels,1983,20(3):154-160.
[5]BRAYDEN J E,NELSON M T.Regulation of arterial tone by activation ofcalcium-dependentpotassium channels[J].Science,1992,256(5056):532-535.
[6]AGARWAL D,WELSCH M A,KELLER J N,et al.Chronic exercise modulates RAS components and improves balance between pro-and an⁃ti-inflammatory cytokines in the brain of SHR[J].Basic Res Cardiol,2011,106(6):1069-1085.
[7]ROQUE F R,BRIONES A M,GARCÍA-REDONDO A B,et al.Aero⁃bic exercise reduces oxidative stress and improves vascular changes of small mesenteric and coronary arteries in hypertension[J].Br J Pharma⁃col,2013,168(3):686-703.
[8]SHI L,LIU B,XUE Z,et al.Aerobic exercise increases BKCachannel contribution to regulation of mesenteric arterial tone by up regulating β1-Subunit[J].Exp Physiol,2013,98(1):326-336.
[9]FOULDS H J,BREDIN S S,CHARLESWORTH S A,et al.Exercise volume and intensity:a dose–response relationship with health benefits [J].Eur J Appl Physiol,2014,114(8):1563-1571.
[10]WARBURTON D E,NICOL C W,BREDIN S S.Health benefits of physical activity:the evidence[J].Can Med Assoc J,2006,174(6):801-809.
[11]WEN C P,WAI J P,TSAI M K,et al.Minimum amount of physical activity for reduced mortality and extended life expectancy:a prospec⁃tive cohort study[J].Lancet,2011,378(9798):1244-1253.
[12]KESANIEMI Y K,DANFORTH E J R,JENSEN M D,et al.Dose-re⁃sponse issues concerning physical activity and health:an evidencebased symposium[J].Med Sci Sports Exerc,2001,33(6):S351-S358.
[13]KOHL H W.Physical activity and cardiovascular disease:evidence for a dose response[J].Med Sci Sports Exerc,2001,33(6):S472-S483.
[14]HILL M A,YANG Y,ELLA S R,et al.Large conductance,Ca2+acti⁃vated K+channels(BKCa)and arteriolar myogenic signaling[J].FEBS Lett,2010,584(10):2033-2042.
[15]KIM N,CHUNG J,KIM E,et al.Changes in the Ca2+activated K+channels of the coronary artery during lef tventricular hypertrophy[J]. Circ Res,2003,93(6):541-547.
[16]ASANO M,MASUZAWA-ITO K,MATSUDA T.Charybdotoxin-sen⁃sitive K+channels regulate the myogenic tone in the resting state of ar⁃teries from spontaneously hypertensive rats[J].Br J Pharmacol,1993,108(1):214-222.
[17]LIU Y,HUDETZ A G,KNAUS H G,et al.Increased expression of Ca2+sensitive K+channels in aorta of hypertensive rats[J].Hypertension,1997,30(6):1403-1409.
[18]LIU Y,HUDETZ A G,KNAUS H G,et al.Increased expression of Ca2+sensitive K+channels in the cerebral microcirculation of genetical⁃ly hypertensive rats:evidence for their protection against cerebral va⁃sospasm[J].Circ Res,1998,82(6):729-737.
[19]MARTENS J R,GELBAND C H.Alterations in rat interlobar artery membrane potential and K+channels in genetic and nongenetic hyper⁃tension[J].Circ Res,1996,79(2):295-301.
[20]RUSCH N J,RUNNELLS A M.Remission of high blood pressure re⁃verses arterial potassium channel alterations[J].Hypertension,1994,23(2-6):941-945.
[21]LIU Y,PLEYTE K,KNAUS H G,et al.Increased expression of Ca2+sensitive K+channels in aorta of hypertensive rats[J].Hypertension,1997,30(6):1403-1409.
[22]XU H,BIAN X,WATTS S W,et al.Activation of vascular BK chan⁃nel by tempol in DOCA salt hypertensive rats[J].Hypertension,2005,46(5):1154-1162.
[23]LI N,SHI Y,SHI L,et al.The effect of aerobic exercise training on the biophysical properties of BKCachannels in rat cerebral artery smooth muscle cells[J].Eur J Appl Physiol,2013,113(10):2553-2563.
[24]ZHAO H C,WANG F.Exercise training changes the gating properties of large conductance Ca2+activated K+channels in rat thoracic aorta smooth muscle cells[J].J Biomech,2010,43(2):263-267.
[25]JOSEPH B K,THAKALI K M,MOORE C L,et al.Ion channel re⁃modeling in vascular smooth muscle during hypertension:Implications for novel therapeutic approaches[J].Pharmacol Res,2013,70(1):126-138.
[26]ZHANG Y,GAO Y J,ZUO J,et al.Alteration of arterial smooth mus⁃cle potassium channel composition and BKCacurrent modulation in hy⁃pertension[J].Eur J Pharmacol,2005,514(2-3):111-119.
[27]BRENNER R,PERÉZ G J,BONEV A D,et al.Vasoregulation by the beta1 subunit of the calcium-activated potassium channel[J].Nature,2000,407(6806):870-876.
[28]PLÜGER S,FAULHABER J,FÜRSTENAU M,et al.Mice with dis⁃rupted BK channel beta1 subunit gene feature abnormal Ca2+spark/ STOC coupling and elevated blood pressure[J].Circ Res,2000,87(11):E53-E60.
[29]AMBERG G C,SANTANA L F.Downregulation of the BK channel be⁃ta1 subunit in genetic hypertension[J].Circ Res,2003,93(10):965-971.
[30]ZHAO G,ZHAO Y,PAN B,et al.Hypersensitivity of BKCato Ca2+sparks underlies hyporeactivity of arterial smooth muscle in shock[J]. Circ Res,2007,101(5):493-502.
[31]COX R H,RUSCH N J.New expression profiles of voltage-gated ion channels in arteries exposed to high blood pressure[J].Microcircula⁃tion,2002,9(4):243-257.
The Effect of Different Intensity Aerobic Exercise on the Remodeling of MaxiK Channel in Mesenteric Artery from SHR
XU Zhaoxia1,ZHAO Tengteng2,BAI Ping3,SHI Lijun4
(Sport Science College,Beijing Sport University,Beijing 100084,China)
Objective:The purpose of this study is to determine the effects of exercise intensity on hypertension-associated changes in large-conductance Ca2+-activated K+(MaxiK)channels in mesenteric arteries from spontaneously hypertensive rats(SHR).Methods:Male SHR(n=54)were randomly as⁃signed to three groups:a low-intensity aerobic exercise group(SHR-L),a moderate-intensity aerobic exercise group(SHR-M),and a sedentary group(SHR).Age-matched male WKY(n=18)were used as normotensive controls.Aerobic exercise groups completed an 8-week exercise training.After 8 weeks of aerobic exercise,the segment of mesenteric arteries was carefully dissected free,and separated into smooth muscle cells by one step digestion.Results:SHR mesenteric arteries MaxiK channel subunit protein expression,β1/α ratio,whole cell current density and single-channel open probability was also in⁃creased compared with WKY(P<0.05).Aerobic exercise reduced systemic blood pressure and normalized hypertension-associated mesenteric arteries(P<0.05).MaxiK alterations to normotensive control levels in the SHR(P<0.05).These effects were more pronounced in the moderate-intensity group than in the low-intensity group.Conclusions:Aerobic exercise training can effectively correct the pathological adaptation of mesenteric arteries MaxiK channels in sponta⁃neously hypertensive rats by downregulation of β1/α to restore the vascular function in mesenteric arteries,which are intensity/volume dependent.
exercise intensity;hypertension;mesenteric arteries;MaxiK channel
G 804.7
A
1005-0000(2016)06-479-06
10.13297/j.cnki.issn1005-0000.2016.06.004
2016-08-06;
2016-10-14;录用日期:2016-10-15
国家自然科学基金项目(项目编号:31371201);体育总局科研课题资助项目(项目编号:2015B035)
徐召霞(1991-),女,山东日照人,在读硕士研究生,研究方向为运动与心脑血管功能调控。
北京体育大学运动生理学教研室,北京100084。
